Жан Абед
Катедра по медицина, Медицинско училище Icahn, Mount Sinai St. Luke’s и Mount Sinai Roosevelt Hospital, Ню Йорк, Ню Йорк, САЩ
Хани Джуде
Катедра по медицина, Медицинско училище Icahn, Mount Sinai St. Luke’s и Mount Sinai Roosevelt Hospital, Ню Йорк, Ню Йорк, САЩ
Ели Абед
Катедра по медицина, Медицинско училище Icahn, Mount Sinai St. Luke’s и Mount Sinai Roosevelt Hospital, Ню Йорк, Ню Йорк, САЩ
Матю Ким
Студент по медицина, Колеж по лекари и хирурзи, Колумбийски университет, Ню Йорк, Ню Йорк, САЩ
Haword Arabelo
Катедра по медицина, Медицинско училище Icahn, Mount Sinai St. Luke’s и Mount Sinai Roosevelt Hospital, Ню Йорк, Ню Йорк, САЩ
Раджан Гурунатхан
Катедра по медицина, Медицинско училище Icahn, Mount Sinai St. Luke’s и Mount Sinai Roosevelt Hospital, Ню Йорк, Ню Йорк, САЩ
Резюме
Дискусия
Anorexia nervosa е хранително разстройство, характеризиращо се с изключително ниско телесно тегло, страх от напълняване или изкривено възприемане на телесния образ и аменорея. Анорексията може да доведе до животозастрашаващи медицински усложнения и по този начин представлява голямо предизвикателство за управление. От основно значение за патогенезата на референтния синдром е отслабената сърдечно-белодробна система, аномалии на електролитите, чернодробна дисфункция, чернодробна хипоперфузия и недостатъчност.
Заключение
Като се има предвид клиничното представяне, този пациент вероятно се е появил на ръба на развиващ се синдром на откровено хранене, със сърдечна дисфункция и хиповолемия, водещи до чернодробна хипоперфузия и исхемичен хепатит. Впоследствие тя развива електролитни нарушения, характерни за синдрома на повторно хранене, които се управляват без големи усложнения. Нейният болничен курс е насърчителен не само за нейното възстановяване, но и за сътрудничеството на различните екипи, участващи в нейните грижи, и подчертава значението на мултидисциплинарен подход за грижа за пациенти с потенциални тежки усложнения от сложно психиатрично заболяване.
25-годишна жена с минала медицинска история, значима за нервната анорексия, за която е имала множество психиатрични признаци, депресия и разстройство с хиперактивност с дефицит на вниманието на флуоксетин и метилфенидат, които са се проявили със слабост за 1 ден Тя беше в обичайното си здравословно състояние до вечерта преди презентацията, когато започна да се чувства слабост след вечеря. На следващата сутрин тя трудно се изправи от леглото, почувства се дехидратирана и беше отпаднала. Пациентът съобщава, че нейното „нормално” тегло е между 90 и 100 паунда. Наскоро тя се изнесе от дома на родителите си, оттегли се социално, възобнови се и започна да се чувства депресирана. Оттогава нейните хранителни навици се характеризират с цикли на преяждане и гладуване, по време на които тя ще консумира цяла кутия тестени изделия или 20 ябълки, ще се почувства зле и след това ще гладува, докато отново не почувства глад. Тя отрича треска, гадене и повръщане, диария, пикочни симптоми и скорошно увеличаване на обема или честотата на упражненията. Тя също отрича настоящите мисли за самоубийство и убийство.
В спешното отделение жизнените показатели бяха значими за ректалната температура 93 F, сърдечната честота 56 BPM, кръвното налягане 80/55 и дихателната честота 14. Физикалният преглед беше забележителен за летаргия, отслабване и оток на оток на долните крайници. Електрокардиограмата показва синусова брадикардия, с удължен коригиран QT интервал от 0,54 и U вълни, приписван първоначално на дефицит на магнезий. В спешното отделение й бяха дадени 2 грама магнезий интравенозно. Лабораторните изследвания (Таблица 1) са забележителни за BUN 37 и Cr 0.6, глюкоза 31, Са 7.9, Mg 1.9, фос 3.5, AST 1,386, ALT 1 208, алкална фосфатаза 378 и удължено протромбиново време. Тя получава 10% декстроза във воден разтвор и е приета в Медицина за по-нататъшно лечение на аномалии на ЕКГ и повишени чернодробни трансаминази.
маса 1
Важни лабораторни резултати от приемането до изписването
| Натрий (137–145 mmol/l) | 133 | 130 | 132 |
| Калий (3,5-5,1 mmol/l) | 2.7 | 3.4 | 3.6 |
| Фосфор (2,5-4,5 mg/dl) | 3.5 | 2.1 | 3.4 |
| Урея азот (7–17 mg/dl) | 37 | 13 | 15 |
| Креатинин (0,52-1,04 mg/dl) | 0.6 | 0,3 | 0,3 |
| Калций (8,4-10,3 mg/dl) | 7.9 | 6.7 | 7.8 |
| Глюкоза (74–106 mg/dl) | 31 | 73 | 65 |
| AST (15–46 u/l) | 1386 | 2833 | 537 |
| ALT (13–69 u/l) | 1208 | 2114 | 1050 |
| Алкална фосфатаза (38–126 u/l) | 378 | 471 | 47 |
| PT (11,8-14,5 сек) | 22. | 23.1 | 15.3 |
| INR (0/9-1,1) | 1.9 | 2.1 | 1.2 |
| PTT (25–36,6 сек) | 36.1 | 26.6 | 34.4 |
| Магнезий (1,6-2,3 mg/dl) | 1.9 | 1.6 | 1.8 |
| Хемоглобин (12–16 g/dl) | 13.5 | 7.7 | 7.4 |
| Брой на левкоцитите (4,5-10,8 K/ul) | 3.1 | 1 | 1.9 |
| Тромбоцити (150–450 K/ul) | 83 | 21. | 67 |
В медицинското отделение пациентът е бил хипофосфатемичен, хипокалиемичен, хипокалциемичен и хипомагнезиемичен, изискващ интравенозни течности и често зареждане с електролити. Тя беше внимателно наблюдавана с многократно ежедневно вземане на кръв. В тясно сътрудничество със службите за хранене и ендокринна система, нейната диета бавно се усъвършенства с увеличаване на калориите. По време на хранителната си рехабилитация тя имаше енергичен апетит и нямаше проблеми с храненето или изпразването.
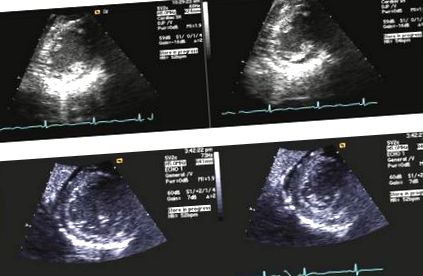
Ултразвукът на десния горен квадрант разкрива черен дроб с нормален размер, без структурни лезии и полип на жлъчния мехур, без данни за холестаза или холелитиаза. Нивата на ацетаминофен в кръвта и алкохола и токсичността на урината бяха незабележими. Работата за инфекциозни, автоимунни и генетични причини за хепатит беше незабележима. През това време AST и ALT на пациента достигнаха връх през високите 4000 s и бавно се насочиха надолу. Тя отказа чернодробна биопсия. В крайна сметка чернодробната недостатъчност на пациента се дължи на хронично недохранване и възможна чернодробна хипоперфузия в условията на лош орален прием. Пациентът остава в синусов ритъм на телеметрия, с пулс в диапазона от 40 и 100 удара в минута и устойчиво удължаване на QTc. Трансторакалната ехокардиограма (Фигура 1) разкрива хипокинетична лява камера, атрофия на стената на лявата камера и фракция на изтласкване от 10-15%. Следвайки кардиологичните препоръки, фосфорът, магнезият и калият на пациента се поддържат агресивно съответно> 3,5,> 2,0 и> 4,0, за да се намали рискът от torsades de pointes. Коригираният QT интервал в крайна сметка намалява към нормалния диапазон.
Трансхоракална ехокардиограма (TTE). A. Първоначален ТТЕ: Хипокинеза на лявата камера и EF 10-15%. Б.. TTE след възстановяване: EF 40%.
Психиатърът продължи да се среща и подкрепя пациента през цялото време на престоя му в болницата и присъстваше на обиколки, за да обсъди изписването на пациента и плановете за последващи действия. Иначе болничният й курс се отличаваше с непрекъснато намаляване на кръвната картина. По време на хоспитализацията й е установено, че е панцитопенична с абсолютен брой на неутрофилите до 700 и брой на тромбоцитите от 21 000. Тя беше поставена за кратко на обратна контактна изолация за профилактика на инфекции, докато нейният брой на белите и ANC се увеличи.
Пациентът се подобри драстично през първите няколко дни и до ден 4 на хоспитализация тя успя да направи амбулатория без помощ и да използва самостоятелно банята, като беше изписана до ден 10.
Дискусия
Anorexia nervosa е хранително разстройство, характеризиращо се с изключително ниско телесно тегло, страх от напълняване или изкривено възприятие на телесния образ и аменорея [1]. Въпреки че е описана най-вече в контекста на психиатрични заболявания, анорексията може да доведе до опустошителни, а понякога и животозастрашаващи медицински усложнения и по този начин представлява предизвикателно състояние за управление [2]. Сериозните усложнения включват електролитни нарушения, често в контекста на синдрома на повторно хранене, хипотермия, ендокринна дисфункция и многоорганна недостатъчност. Anorexia nervosa е най-вероятно отговорна за триадата на слабост на нашия пациент, чернодробна дисфункция и удължен QT интервал.
Храненето с недохранени пациенти с нервна анорексия може да бъде свързано с хипофосфатемия, сърдечна аритмия и делириум. Презареждането с фосфор трябва да започне рано и да се поддържат серумни нива над 3 mg/dL. Пациентите се нуждаят от внимателно наблюдение, тъй като свързаните сърдечни и неврологични събития е най-вероятно да се появят през първите седмици [3]. При хронично недохранени пациенти с анорексия, препоръчва се бавно и постепенно увеличаване на храненето с хранителни консултации, психотерапия и внимателно проследяване на телесното тегло, сърдечната честота и ритъма и серумните електролити, за да се осигури безопасна и ефективна хранителна рехабилитация и да се избегнат бързи електролитни промени. и претоварване с течности [4–6].
Слабостта и умората на пациента, в контекста на неотдавнашната история на започване на редовна диета, докато е в състояние на хронично недохранване, са свързани със синдрома на повторно хранене, който обикновено се появява 2 до 5 дни след започване на храненето [7]. Изчерпаните запаси от фосфат поради продължително гладуване, хипокалциемия и хипокалиемия могат да доведат до нарушена мускулна контрактилитет и впоследствие слабост, миалгия и тетания. Хипогликемията и анемията или панцитопенията от хронично недохранване също може да са допринесли за слабостта на пациента.
Нараняването на черния дроб с повишаване на чернодробните ензими е често усложнение и се смята, че стеатозата на черния дроб е основната основна патология. Лечението е хидратация, корекция на електролитите и дисбаланса на течностите и постепенна хранителна подкрепа за предотвратяване на синдром на повторно хранене [8]. Пациентът показва повишени серумни трансаминази, повишена алкална фосфатаза и удължено протромбиново време, които заедно предполагат остра чернодробна недостатъчност. Чернодробната дисфункция вероятно също допринася за хипогликемията на пациента, като компрометира чернодробната глюконеогенеза. Чернодробната хипоперфузия, дължаща се на аноректична хиповолемия, изчерпване на фосфати и тиамин вследствие на синдрома на повторно хранене, може да причини синергично бързо и дълбоко увреждане на хепатоцитите, което да доведе до изтичане на аланин и аспартат аминотрансферази в серума.
Брадикардията е често срещана находка при пациенти с нервна анорексия, вторична на хипотермия и може би като компенсаторен механизъм за спестяване на енергия при състояния на глад. Хипокалиемията, хипомагнезиемията и хипокалциемията са типични находки при синдрома на повторно хранене и могат да допринесат за аномалиите на EKG на пациента, показващи удължен QTc [9].
Аномалии на електролитите се срещат при нервна анорексия най-често в контекста на синдрома на повторно хранене, определен през 1990 г. от Соломон и Кирби като „метаболитните и физиологични последици от изчерпването, пренасищането, изместванията в отделите и взаимовръзките на метаболизма на фосфор, калий, магнезий, глюкоза, недостиг на витамини и реанимация с течности “[10]. От основно значение за патогенезата на синдрома на повторно хранене е отслабената сърдечно-белодробна система, която не е в състояние да поеме течността и натриевия товар, представени на организма по време на хранително напълване. Полученото разширяване на обема и задържането на течности могат да прогресират дори до сърдечна недостатъчност. Типичните електролитни аномалии включват хипофосфатемия, хипомагнезиемия, хипокалиемия и хипокалциемия с дефицит на тиамин и други витамини от комплекс В, както се вижда по време на болничния курс на този пациент.
Чернодробната дисфункция е често срещано медицинско усложнение на анорексията и нейното лечение. Точното му представяне и лабораторният профил обаче остават широко променливи, може би отразяващи липсата на знания относно етиологията и патофизиологията на това състояние. Едно ретроспективно проучване на 126 пациенти с анорексия нервоза - без анамнеза за предшестващо чернодробно заболяване, хепатотоксично излагане на наркотици или консумация на алкохол - които са били недохранени и впоследствие хоспитализирани за парентерално хранене, установява, че 43% са имали повишени серумни трансаминази при постъпване [11]. Авторите идентифицират 4 рискови фактора, свързани с тези лабораторни находки: млада възраст, нисък ИТМ, рестриктивен подтип на анорексия невроза и мъжки пол. Те също така отбелязват разрешаването на трансаминита в повечето случаи след хранително напълване за период от 4 седмици. Забележително е, че най-високите стойности, наблюдавани за AST и ALT, са съответно 2 120 и 2 614, доста под пиковите стойности на този пациент през 4000 s.
Доклад за случай от Япония през 1999 г. описва 20-годишна жена с нервна анорексия (ИТМ 12.1), която се е представяла в болницата с летаргия и замаяност и е установено, че е удължила PT, тромбоцитопения до 64 000 и AST и ALT от 5000 и 3980, съответно [12]. Тя е лекувана с плазмафереза за чернодробна дисфункция, но впоследствие развива белодробен оток, остра бъбречна недостатъчност, стомашно-чревно кървене и дисеминирана вътресъдова коагулация. Мащабната работа за инфекциозен и медикаментозен хепатит беше незабележима, както и изследването за мастни чернодробни промени и дефицит на антиоксиданти. Авторите спряха да предприемат чернодробна биопсия, тъй като пациентът в крайна сметка се възстанови, но чрез изключване стигнаха до заключението, че самото недохранване може да доведе до чернодробна недостатъчност.
Съвсем наскоро доклад от Великобритания на пациент с нервна анорексия и ИТМ от 9, приет за припадък, също описва повишаване на AST до 5 403 и коагулопатия с INR от 2,0 [13]. Няма анамнеза за употребата на алкохол или хепатотоксични наркотици и работата по вирусен и автоимунен хепатит и токсичност на парацетамол е незабележима. Чернодробните ензими се нормализират спонтанно, тъй като пациентът е бил рехабилитиран хранително и нейната остра чернодробна недостатъчност се дължи на епизод на хипотония (BP 80/50). Хипотонията се дължи на лош хранителен прием и вторична на сърдечната дисфункция от хронично недохранване доведе до чернодробна хипоперфузия и в крайна сметка до исхемичен хепатит.
По-нататъшното изследване на сърдечните аномалии на пациента разкрива хипокинеза на лявата камера и EF 10-15%. Кардиомиопатията Takotsubo, известна също като индуцирана от стрес кардиомиопатия, е описана като рядко усложнение при млади жени с нервна анорексия и обикновено се проявява по начин, подобен на острия миокарден инфаркт [14]. Състоянието се характеризира с преходна хипокинеза, акинеза или дискинеза на лявата камера със или без апикално участие; аномалии на регионалното движение на стената, простиращи се извън единичното съдово разпределение; наличие на стресиращ спусък в повечето случаи; отсъствие на коронарна артериална болест или данни за руптура на плака; нови аномалии на EKG или изтичане на сърдечни ензими; и отсъствие на феохромоцитом и миокардит. Патофизиологията на кардиомиопатията такасубо остава да бъде изяснена, но се смята, че включва излишък на катехоламин, водещ до зашеметяване на миокарда.
Като се имат предвид констатациите от анамнезата и физикалния преглед и преглед на съответната литература, пациентът вероятно е бил на ръба на развитие на синдром на откровено хранене със сърдечна дисфункция и хиповолемия, водеща до чернодробна хипоперфузия и исхемичен хепатит. Впоследствие тя развива електролитни нарушения, характерни за синдрома на повторно хранене, които се управляват без големи усложнения. Нейният болничен курс е насърчителен не само за нейното възстановяване, но и за сътрудничеството на различните екипи, участващи в нейните грижи, и подчертава значението на мултидисциплинарен подход за грижа за пациенти с потенциални тежки усложнения от сложно психиатрично заболяване.
Съгласие
От пациента беше получено устно по телефона съгласие за публикуване на този доклад за случая и всички придружаващи изображения.
- Диета и възстановяване от анорексия нервоза - смесват ли се
- Полова идентичност и хранителни разстройства Anorexia Nervosa в транссексуалната общност Oliver-Pyatt
- Ранни хранителни разстройства ... всъщност те са Anorexia Nervosa; Здраве; Медицина в американската история
- Сърдечна недостатъчност - сърдечна недостатъчност; CardioSecur
- Диета за дете с вродени сърдечни заболявания; Фондация Little Moppet Heart