Тошики Йонеда
Такааки Томофуджи
2 Център за усъвършенствани изследвания за устни и краниофациални науки, Стоматологично училище при университета Окаяма, 2-5-1 Шиката-чо, Кита-ку, Окаяма 700-8558, Япония
Мунейоши Кунитомо
Дайсуке Екуни
Коичиро Ирие
Tetsuji Azuma
Тацуя Мачида
Хисатака Мияи
Kouhei Fujimori
Манабу Морита
Резюме
1. Въведение
Затлъстяването, определено като необичайно или прекомерно натрупване на мазнини, което увеличава риска от хронично заболяване, е все по-често свързано с пародонтоза. Докладите показват, че хората, които затлъстяват, имат по-висок риск от развитие на пародонтална болест (относителен риск (RR) = 1,33, 95% доверителен интервал (CI) = 1,21–1,47) в сравнение с аналозите с нормално тегло [1]. Доказано е също, че затлъстелите лица имат значително по-висок риск от преживяване на пародонтална болест, отколкото индивиди с нормално тегло след адаптиране към важни ко-фактори (RR = 1,36, 95% CI = 1,04–1,78) [2]. Тези наблюдения показват, че затлъстяването е риск за пародонтоза.
Затлъстяването е свързано със системно увеличаване на производството на реактивни кислородни видове (ROS) [3,4]. Въпреки че ROS са продукти на нормалния клетъчен метаболизъм, свръхпроизводството на ROS индуцира оксидативен стрес чрез увреждане на ДНК, липиди и протеини [5]. Оксидативният стрес играе решаваща роля в патогенезата на редица заболявания, включително пародонтоза [6]. Проучванията in vitro показват, че оксидативният стрес стимулира диференциацията на остеокластите [7,8]. Проучванията при животни също предполагат, че оксидативният стрес участва в прогресията на алвеоларната костна резорбция [9,10,11,12]. В неотдавнашен преглед основата за връзката между затлъстяването и пародонтозата лежи на основно вътреклетъчно ниво, което включва оксидативен стрес [13]. По този начин оксидативният стрес на венеца, дължащ се на затлъстяването, може да индуцира прогресията на пародонталната болест чрез повишена алвеоларна костна резорбция.
Молекулярният водород е антиоксидант, който може да намали оксидативния стрес [14], а пиенето на богата на водород вода (HW) може да увеличи концентрацията на молекулярен водород в кръвта и тъканите [15]. В стоматологията проучвания върху животни демонстрират, че HW може да намали оксидативния стрес на венеца след стареене [16] и пародонтална болест [17]. Неотдавнашно проучване разкри също, че пиенето на HW активира генната експресия на антиоксидантна защита, допринасяйки за ускоряване на зарастването на раната на лигавицата на устната кухина при плъхове [18]. В тези проучвания са използвани плъхове с нормално тегло. Следователно, антиоксидантният ефект на HW може да предложи клинични ползи дори при плъхове със затлъстяване, като ограничава индуцирания от затлъстяването оксидативен стрес. Не е ясно обаче как HW влияе върху оксидативния стрес на венците и резорбцията на алвеоларната кост в резултат на затлъстяването.
В настоящото проучване предположихме, че пиенето на HW може да предотврати оксидативен стрес на венците и резорбция на алвеоларната кост при затлъстяване. 8-хидроксидезоксигуанозин (8-OHdG), който се образува, когато гуанинът в ДНК претърпи окислително увреждане, обикновено се приема като надежден индикатор за оксидативен стрес [19]. В допълнение, храненето на субекти с високо съдържание на мазнини е един от полезните експериментални модели за изследване на прогресията на пародонталната болест при затлъстяване [20,21]. Целта на настоящото проучване беше да се изследват ефектите на HW върху нивата на 8-OHdG на венеца и резорбция на алвеоларната кост при затлъстели плъхове, хранени с диета с високо съдържание на мазнини.
2. Материали и методи
2.1. Животни
В това проучване са използвани мъжки плъхове Fischer 344 (на 8 седмици). Плъховете са настанени в климатизирана стая (23-25 ° C) с 12-часов цикъл светлина-тъмнина. Експериментите са проведени в съответствие с институционалните насоки на Комитета за контрол върху изследванията на животните към университета в Окаяма (OKA-2014200).
2.2. Експериментален дизайн
Плъховете бяха разделени на случаен принцип в три групи от по шест плъха: За контролната група плъховете получават чиста вода (дестилирана вода) и редовна диета (MF, Oriental Yeast Co. Ltd., Osaka, Япония); за групата с високо съдържание на мазнини (HFD), плъховете получават чиста вода и диета с високо съдържание на мазнини (F2HFD1, Oriental Yeast Co. Ltd., Osaka, Япония) [22]; за групата HFD + HW, плъховете получават HW и диета с високо съдържание на мазнини. В това проучване не индуцирахме експериментален пародонтит във всички групи. Чиста вода или HW се дава на плъховете на всеки 12 часа, сутрин и вечер, в затворен стъклен съд, докато достигнат 20-седмична възраст. HW се дава веднага след приготвянето му. Стъкленият съд с тръба за сипър беше прикрепен към клетката и плъховете пиеха вода с помощта на тръба за сипър [16,17]. HW се приготвя чрез електролиза на вода, използвайки BLUE OCEAN H2mini (HWP-200WWD, Tech. Co. Ltd., Токио, Япония). Водата се електролизира, за да се получат следните химични продукти: 2H2O → 2H2 + O2. Измерихме концентрацията на водород в HW (1 мин и 24 часа след електролиза на вода), като използвахме разтворител на разтворен водород (KM2100DH, Kyoei Electronic Laboratory Co. Ltd., Saitama, Япония) три пъти на всеки етап. Концентрацията на водород (средно ± стандартно отклонение, µg/L) след 1 min е 301,7 ± 65,1, а тази след 24 h е 186,3 ± 55 µg/L.
След експерименталния период животните бяха умъртвени под дълбока анестезия с диетилов етер.
2.3. Измервания на серумни параметри
Кръвни проби бяха събрани от сърцето. Серумът се отделя чрез центрофугиране при 1500 × g за 15 минути и се съхранява при -80 ° С до анализ. Общият холестерол в серума, холестеролът на липопротеините с много ниска плътност (VLDL), холестеролът на липопротеините с ниска плътност (LDL), холестеролът на липопротеините с висока плътност (HDL), общите триглицериди, VLDL триглицеридите, LDL триглицеридите и HDL триглицеридите са измервани с проникване на гел високоефективна система за течна хроматография (Skylight Biotech, Акита, Япония) [23]. Нивото на серума 8-OHdG също е анализирано с помощта на комплект ELISA (Японски институт за контрол на стареенето, Шизуока, Япония) [24].
2.4. Измервания на ниво на венеца на 8-OHdG
Митохондриалната ДНК е изолирана от гингивална тъкан на максиларни моларни области с помощта на комплект за екстрактор на ДНК (Wako Pure Chemical Industries, Осака, Япония). Нивото на 8-OHdG в изолираната митохондриална ДНК се анализира с помощта на комплект ELISA (Японски институт за контрол на стареенето, Шизуока, Япония) [24].
2.5. Микрокомпютърна томография (КТ) Оценка на челюстта
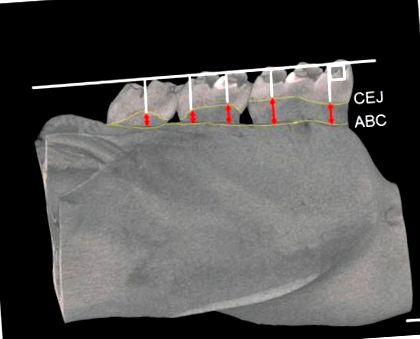
Долночелюстните кости бяха сканирани с микро-CT устройство (RmCT, Ригаку, Токио, Япония) със следните настройки: (1) дебелина на парче от 50 μm; (2) напрежение от 90 kV; и (3) електрически ток от 0,1 mA. Триизмерни изображения са получени с помощта на система за анализ на костите (TRI/3D-BON, Ratoc, Токио, Япония). Площта на фуркацията на първия моларен корен е взета за анализ на процента костен обем/общ обем (BV/TV%), трабекуларен номер (Tb. N), дебелина на трабекула (Tb. Th) и трабекуларно отделяне (Tb. Sp). Разстоянието между цименто-емайловия възел (CEJ) и алвеоларния костен гребен (ABC) беше измерено на 5 точки за всеки мандибуларен молар (първи кътник [M1] до трети кътник [M3]) като алвеоларна костна резорбция [25]. Разстоянията от тези 5 точки бяха сумирани като алвеоларна костна резорбция (Фигура 1) [25].
Области на измерване за алвеоларна костна резорбция при плъхове. Изображението µCT показва как да се измери разстоянието между CEJ и ABC. Червените върхове на стрелки показват степента на резорбция на алвеоларната кост. CEJ: цименто-емайлов възел; ABC: алвеоларен костен гребен. Лента = 500 µm.
2.6. Изолация на РНК и анализ на PCR масив
Общата РНК на HFD групата и HFD + HW групата се извлича от гингивална тъкан (100 mg на плъх) на долночелюстните моларни области с помощта на mirVava ™ PARISTM Kit (Life Technologies, Carlsbad, CA, USA). РНК от същата група се обединява (два плъха на една проба). Съдържанието на РНК се измерва със спектрофотометър (Beckman Du 640) (Beckman Coulter, Brea, CA, USA). Обща РНК (1 μg РНК от всяка проба) беше използвана за обратна транскрипция с RT2 First Strand Kit (Qiagen, Hilden, Германия). За да се профилира генната експресия, се извърши анализ на PCR масив, използвайки RTR Profiler PCR Array (плъх оксидативен стрес, PARN-065ZA) (Qiagen) и RT2 SYBR Green qPCR Master Mix (Qiagen) на система Mx3000P в реално време QPCR (Agilent Technologies, Токио, Япония). Получени са стойностите на прага на цикъла (Ct) и данните за генната експресия са анализирани с инструмент за онлайн анализ (RT2 Profiler PCR array Data Analysis версия 3.5, http://pcrdataanalysis.sabiosciences.com/pcr/arrayanalysis.php) ( Qiagen). Данните бяха скринирани за експресията на 84 гена, свързани с оксидативен стрес. Стойностите на промяна на сгъване нагоре или надолу (HFD + HW група/HFD група) са изчислени от генната експресия (2 - ΔCt).
2.7. Статистически анализ
Данните са изразени като средни стойности ± стандартни отклонения. Еднопосочен ANOVA, последван от метода на Tukey, беше използван за сравнение на три групи, използвайки статистически софтуерен пакет (SPSS версия 22.0; IBM, Токио, Япония). За анализ на PCR масив беше използван t-тест на Student.
3. Резултати
3.1. Резултати от телесно тегло и наддаване на телесно тегло
Стойностите са представени като средно ± стандартно отклонение на шест плъха. * p † p Фигура 2). Нивото на венците на 8-OHdG в групата HFD + HW също е по-ниско от това в групата HFD (p Фигура 3). Групата HFD + HW, в сравнение с групата HFD, също показва по-ниско разстояние между CEJ-ABC (p 2) или регулиране надолу (Таблица 3). От тях, три гена (изоцитрат дехидрогеназа 1 (Idh1), супероксиддисмутаза (Sod) 2 и Sod3) бяха регулирани нагоре и един ген (група анемия на Fanconi C (Fancc)) беше понижен в HFD + HW групата. Този раздел може да бъде разделен на подзаглавия. Той трябва да предоставя кратко и точно описание на експерименталните резултати, тяхната интерпретация и експерименталните заключения, които могат да се направят.
Таблица 3
Диференциално експресирани гени, участващи в оксидативен стрес на гингивална тъкан между HFD групата и HFD + HW групата.
| Idh1 | изоцитрат дехидрогеназа (NADP (+)) 1, цитозолна | 4.04 | 0,014 |
| Sod2 | супероксиддисмутаза 2 | 2.25 | 0,032 |
| Sod3 | супероксиддисмутаза 3 | 3.35 | 0,034 |
| Fancc | Анемия на Фанкони, комплементарна група С | -2,88 | 0,046 |
Стойността на р е изчислена чрез t-тест на Student.
4. Дискусия
В настоящото проучване плъховете на диета с високо съдържание на мазнини, в сравнение с контролните плъхове, показват повишено наддаване на телесно тегло и по-високи нива на серум и венеца 8-OHdG на 20 седмици. 8-OHdG е показател за оксидативен стрес [18]. Тези открития показват, че при затлъстелите плъхове диетата с високо съдържание на мазнини предизвиква системно увеличаване на оксидативния стрес. От друга страна, пиенето на HW потиска ефекта от диетата с високо съдържание на мазнини върху наддаването на телесно тегло и показва по-ниски нива на серум и венеца 8-OHdG в сравнение със затлъстелите плъхове. Възможно е HW да потиска затлъстяването, което от своя страна може да потисне системното увеличаване на оксидативния стрес, включително оксидативен стрес на венците.
Някои проучвания са изследвали антиоксидативните ефекти на HW при затлъстяване. Например, едно проучване върху животни разкрива, че пиенето на HW намалява затлъстяването и намалява чернодробния оксидативен стрес при модел на мишки [26]. Клинично проучване също така показва, че консумацията на HW намалява нивото на пероксидация на липидите в урината значително от изходното ниво до седмица 8 при затлъстели пациенти [27]. Те са в съответствие с нашите открития, които показват, че пиенето на HW предотвратява затлъстяването и оксидативния стрес на венците.
В нашите открития затлъстелите плъхове на диета с високо съдържание на мазнини показват по-голямо разстояние между CEJ-ABC, по-нисък BT/TV и по-висок Tb. Sp от контролните плъхове, което предполага, че прогресията на алвеоларната костна резорбция следва затлъстяването. Резултатите също така разкриха, че плъховете се хранят с високо съдържание на мазнини и HW, в сравнение с HFD плъховете показват по-ниско разстояние между CEJ-ABC и по-голямо BT/TV. Гингивалният оксидативен стрес участва в прогресията на алвеоларната костна резорбция [11,12]. Потискането на затлъстяването чрез пиене на HW може да отслаби алвеоларната костна резорбция чрез ограничаване на оксидативния стрес на венците.
Това проучване показва, че пиенето на HW повишава регулирането на генната експресия на Sod2 и Sod3 в венечните тъкани. Sod2 и Sod3 са антиоксидантни ензими, които катализират превръщането на супероксидните радикали във водороден прекис и кислород [28,29]. Това предполага, че повишените антиоксидантни свойства на венечните тъкани от HW също могат да предпазят пародонталните тъкани от системно повишаване на оксидативния стрес.
Настоящите резултати също показаха, че HW понижава регулацията на генната експресия на Fancc. Тъй като Fancc се счита за ген, реагиращ на оксидативен стрес [30], и се предполага, че регулирането на Fancc отразява намаления оксидативен стрес на венците.
Съобщава се, че пиенето на HW може да подобри метаболизма на холестерола [27], което може да има пряко влияние върху костната резорбция [31]. Въпреки това, в нашите открития няма значителни разлики в серумния холестерол и триглицеридите между плъховете с и без прием на HW. Те предполагат, че оксидативният стрес на венците и резорбцията на алвеоларната кост не са свързани със серумния холестерол и триглицеридите в нашия животински модел.
В това проучване плъховете на диета с високо съдържание на мазнини са склонни да показват по-ниски нива на общ и VLDL триглицериди в серума в сравнение с контролните плъхове. Тези открития са подобни на тези от предишното проучване при птици на диета с високо съдържание на мазнини [32]. Намалените серумни концентрации на триглицериди могат да отразяват възможна метаболитна свръхкомпенсация в отговор на добавените хранителни мазнини [33].
Клинично проучване показа, че затлъстяването може да повлияе на разрушаването на пародонталната тъкан и тежестта на заболяването чрез увеличаване на нивото на оксидативен стрес при наличие на пародонтално заболяване [34]. Друго проучване също така предполага, че пародонталният оксидативен стрес, генериран от затлъстяване, изглежда е свързан с пародонтална болест [35]. Такива доказателства подкрепят концепцията, че затлъстяването може да доведе до прогресиране на пародонталната болест чрез увеличаване на оксидативния стрес. От друга страна, настоящият доклад показва, че пиенето на HW потиска затлъстяването, оксидативния стрес на венците и резорбцията на алвеоларната кост при модели на плъхове. Нашето предишно проучване също установи, че тренировъчните упражнения предотвратяват затлъстяването и оксидативния стрес на венците при плъхове на диета с високо съдържание на мазнини [22]. Терапията против затлъстяване за намаляване на оксидативния стрес може да бъде полезна за предотвратяване на пародонтални заболявания, свързани със затлъстяването.
В предишното ни проучване добавките с броколи инхибираха ефектите от диета с висок холестерол върху диференциацията на остеокластите в пародонталната тъкан [36]. Също така се съобщава, че добавянето на коензим 10 противодейства на негативните ефекти на n-6 полиненаситени мастни киселини върху свързаната с възрастта алвеоларна костна загуба [37]. Освен това, настоящото проучване демонстрира, че пиенето на HW отслабва алвеоларната костна резорбция, свързана със затлъстяването. Действието на адекватна консумация на хранителни вещества би било важно за поддържане и/или подобряване на здравето на пародонта.
Когато приемате лекарство, е необходимо да внимавате за страничните ефекти. HW обаче няма известни странични ефекти в предишни проучвания върху животни и хора [16,17,18,27]. Следователно HW може да представлява полезно превантивно лечение срещу пародонтоза, свързано със затлъстяването, без странични ефекти.
Нашето проучване има някои ограничения. Например не бяха събрани данни по отношение на циркулиращите възпалителни молекули, като фактор на туморна некроза-α. Затлъстяването може косвено да доведе до увеличаване на циркулацията на възпалителни молекули, които могат да увеличат възпалението, индуцирано от бактериални патогени. Освен това, докато показахме превантивни ефекти на HW върху затлъстяването и оксидативния стрес на венците, не можахме да изясним напълно връзката между тези патологични механизми и ефектите на HW. Необходими са допълнителни проучвания, за да се изясни този въпрос.
5. Заключения
В заключение, в рамките на изследването, пиенето на HW може да инхибира оксидативен стрес на венците, предизвикан от затлъстяване, и по този начин да предотврати резорбцията на алвеоларната кост при модели на плъхове. Необходими са обаче клинични проучвания, за да се изясни дали пиенето на HW може да предотврати усложнения, свързани с наднорменото тегло, включително пародонтоза.
Благодарности
Тази работа беше подкрепена от безвъзмездни средства за научни изследвания (№ 16K11855, № 16K11856 и № 16K20693) от Министерството на образованието, културата, спорта, науката и технологиите, Токио, Япония.
Принос на автора
Тошики Йонеда, Такааки Томофуджи, Дайсуке Екуни, Тецуджи Азума и Манабу Морита замислят и проектират експериментите. Toshiki Yoneda, Taaaki Tomofuji, Koichiro Irie, Muneyoshi Kunitomo, Tetsuji Azuma, Tatsuya Machida, Hisataka Miyai и Kouhei Fujimori извършиха експериментите и допринесоха с реагенти/материали/инструменти за анализ. Тошики Йонеда, Такааки Томофуджи, Дайсуке Екуни и Манабу Морита са написали ръкописа. Всички автори са прочели и одобрили окончателния ръкопис.
Конфликт на интереси
Авторите не декларират конфликт на интереси.
- Прекомерно преработеното месо и костно брашно и фитазните ефекти върху бройлери, предизвикани от субклиника
- Обръщане на ефектите от стреса Как да лекуваме надбъбречната умора
- Preggo Започнете да пиете кокосова вода днес, ако сте имали; t Започнато облекло за кърмене по майчинство
- Приемът на безплатни пълноценни питейни води за хранителни вещества е свързан с по-високо качество на диетата сред французите
- Хора без флуор в питейната си вода - Dental Health Services Victoria