Резюме
Въведение
Метоксиморфолинил доксорубицин (MMDX; неморубицин) е производно на доксорубицин, което показва повишена цитотоксичност към човешки туморни клетки и хематопоетични предшественици, когато се инкубира с чернодробни микрозоми, които съдържат високо P450 метаболитна активност. 20, 21 Потенцирането на активността на MMDX се дължи на метаболитно активиране от експресирани в черния дроб ензими CYP3A. 22, 23, 24 The P450-генерираният активен метаболит на MMDX наскоро беше идентифициран и показа, че има много по-висока сила спрямо култивираните клетки и забележителна ефективност спрямо туморни ксенотрансплантати при голи мишки в сравнение с MMDX. 25 Активираният MMDX запазва активност срещу туморни клетки с различни механизми на резистентност към класически противоракови агенти, включително самия MMDX. 26, 27 Тролеандомицин, ензимно-селективен инхибитор на CYP3A, блокира активирането на чернодробната MMDX, като по този начин намалява антитуморната активност и токсичността на костния мозък, демонстрирайки, че активираният MMDX допринася както за противотуморната активност, така и за токсичността на гостоприемника in vivo. 28 Следователно трябва да се разработят стратегии за намаляване на системната експозиция на MMDX, за да се оптимизира терапевтичният индекс на това ново антрациклиново пролекарство.
В по-ранно проучване CYP3A4 беше показан като най-активният катализатор на MMDX активиране в панел от ензими на плъх и човешки CYP3A. 27 В момента оценяваме терапевтичното въздействие на въвеждането CYP3A4 в туморни клетки в комбинация с лечение с MMDX инвитро и in vivo. В допълнение, ние използваме аденовирус с дефект на репликация, за да улесним CYP3A4 трансфер на ген към човешки туморни клетки. Потенциалната полезност на условния репликационен аденовирус за подобряване CYP3A4 генетично доставяне също беше изследвано. Нашите открития демонстрират поразителния терапевтичен потенциал на CYP3A4 в комбинация с лечение с MMDX и освен това предполагат, че експресията на ендогенни туморни клетки на CYP3A4 при отделни пациенти може да служи като важен фактор, определящ реакцията на MMDX in vivo.
Материали и методи
Допълнителни материали и методи
Материали и методи, използвани за уестърн блотинг, P450 редуктазен анализ, количествен PCR анализ в реално време, CYP3A4 аденовирусен препарат и медиирана от аденовирус РНК транскрипция, протеинова експресия и ензимна активност са достъпни онлайн като допълнителна информация.
Клетъчни линии
CHO/HR, CHO/3A4 и CHO/3A4/HR клетки 29 са получени от д-р Томас Фридбърг (Център за биомедицински изследвания, Университет в Дънди, Великобритания) и са отгледани в α-MEM хранителна среда, съдържаща диализиран 10% фетален говежди серум (FBS) ) (CHO/3A4 и CHO/3A4/HR клетки) или в модифицираната от Dulbecco среда на Eagle (DMEM), съдържаща 10% FBS, 10 m M хипоксантин и 1,6 m M тимидин (Invitrogen, Carlsbad, CA). 9L и 9L/3A4 клетки (виж по-долу) бяха култивирани в DMEM + 10% FBS. Човешки туморни клетъчни линии U251 (мозъчен тумор) и A549 (рак на белия дроб) са получени от д-р Доминик Скудиеро (NCI, Bethesda, MD).
Генериране на 9L/3A4 клетки чрез ретровирусна инфекция
Анализ за инхибиране на клетъчния растеж
9L и CHO клетки се посяват в трикратни гнезда на 96-гнездова плака при 3000 клетки на гнездо 24 часа преди лечението с лекарството. Клетките се третират с различни концентрации на MMDX или IFA в продължение на 4 дни. След това клетките се оцветяват с кристално виолетово (A595) и се изчислява относителната клетъчна преживяемост. 27 IC50 стойности бяха определени от полулогаритмична графика на точките с данни, използвайки Prism 4 (Graphpad Software Inc., Сан Диего, Калифорния).
Количествено определяне на производството на 4-OH-IFA и образуването на активно MMDX от туморни клетки, експресиращи CYP3A4
9L/3A4 клетки се поставят в 12-гнездни културални плаки при 1,5 х 105 клетки на гнездо в 1,5 ml хранителна среда. Двадесет и четири часа по-късно, IFA в различни концентрации се добавя към клетките заедно с 5 m М полукарбазид, за да улови и стабилизира метаболита 4-OH-IFA. След 4 часа обработка, аликвотна част от хранителната среда (0,5 ml) се отстранява от всяка ямка и се съхранява при -80 ° С, докато стане готова за анализ на 4-OH-IFA. Клетките, останали на плочата, се промиват с буфериран с фосфат физиологичен разтвор и се оцветяват с кристално виолетово. Използва се високоефективен анализ на течна хроматография C18 за количествено определяне на 4-OH-IFA чрез флуоресценция след дериватизация на неговия страничен продукт акролеин до 7-хидроксихинолин. 32 Стандартни криви за 4-OH-CPA са генерирани, като се използва 4-OOH-CPA, разтворена в среда за клетъчна култура (0-40 μ M). 32 Клетъчната активност на IFA 4-хидроксилазата се изчислява от интегрирани зони на пикове, определени от софтуера Millennium 32.
CYP3A4-активираният MMDX метаболит, освободен в хранителната среда, се анализира, както следва. 9L и CHO клетки, експресиращи CYP3A4, и CYP3A4-дефицитни контролни клетки, се посяват в плаки с 12 гнезда при 1,5 х 105 клетки на гнездо. Двадесет и четири часа по-късно MMDX в различни концентрации се добавя към клетките в 1,5 ml хранителна среда за 2 h, като по това време 0,5 ml от супернатантата на културата се отстранява от 9L и 9L/3A4 клетъчни култури и се смесва с 0,5 ml от пресен α-MEM + 10% диализиран FBS. Успоредно с това, 0,5 ml супернатант на културата се отстраняват от третирани с MMDX клетъчни линии СНО и се смесват с 0,5 ml пресен DMEM + 10% FBS. Аликвотна част от 0,2 ml от всяка проба се добавя към трикратни гнезда от 9L клетки, посяти 24 часа по-рано при 3000 клетки на гнездо в 96-гнездови плаки (‘9L индикаторни клетки’). 9L индикаторните клетки се култивират в продължение на 4 дни в 0,2 ml среда, съдържаща MMDX метаболити и след това се оцветяват с кристално виолетово, за да се определят относителните клетъчни номера като индекс на нивото на активен MMDX метаболит, образуван от всяка клетъчна линия по време на първоначалната 2 h MMDX инкубация Период.
Аденовирусна инфекция на човешки туморни клетъчни линии и тестове за цитотоксичност на MMDX
Клетките A549 и U251 се посяват в 24-ямкови плаки по 14 000 клетки на гнездо и се заразяват 24 часа по-късно с Adeno-3A4 (множественост на инфекцията (MOI) 0–400) или самостоятелно, или в комбинация с Onyx-017 (MOIs 0, 0,7 и 2). Клетките се инкубират с вирусите в продължение на 4 часа в 0,2 ml хранителна среда на гнездо, след което към всяка ямка се добавят 0,8 ml прясна среда. Вирусът се отстранява след 24 часа и към клетките се добавя 1 ml прясна среда, съдържаща MMDX (0–8 n M). След 2 дни лечение с MMDX, средата беше заменена с 1 ml прясна среда, съдържаща MMDX, за допълнителни 4 дни. Оцелелите клетки бяха оцветени с кристално виолетово.
Анализ за забавяне на растежа на тумора
Резултати
Ретровирусна експресия на човешки CYP3A4 хемосенсибилизира 9L глиосаркомни клетки до MMDX и IFA
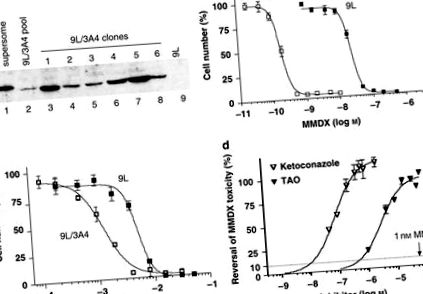
Ретровирус, кодиращ CYP3A4 cDNA, се използва за заразяване на 9L туморни клетки, които са избрани въз основа на придобитата им резистентност към пуромицин. Протеинът CYP3A4 е открит в получения пул от резистентни на пуромицин клетки, както е показано чрез Western blotting (Фигура 1а). Изборът на клетки, показващи повишена чувствителност към MMDX, дава клонинги с повишени нива на протеин CYP3A4. 9L/3A4 клонинг 5 имаше най-високото съдържание на протеин CYP3A4, 15.3 pmol CYP3A4 на mg общ клетъчен протеин и беше използван във всички следващи експерименти. Стойността на IC50 на MMDX към 9L/3A4 клетки, 0.2 n M, е 120 пъти по-ниска от тази на P450-дефицитни 9L клетки (IC50 = 23,9 п М) (Фигура 1b и Таблица 1). Тази мощна цитотоксичност на активирания MMDX контрастира с тази на пролекарството IFA на CYP3A4, която изисква милимоларни концентрации, за да убие 9L/3A4 клетки (Фигура 1в и Таблица 1). За да се провери ролята на метаболизма на CYP3A4 в активирането на MMDX към цитотоксични метаболити, 9L/3A4 клетки се третират с MMDX (1 n M) заедно с нарастващи концентрации на инхибиторите на CYP3A4 кетоконазол и тролеандомицин. Цитотоксичността на MMDX е напълно блокирана от кетоконазол (0,5 μM) и тролеандомицин (20 μM) (Фигура 1г).
PСвръхекспресията на 450 редуктаза повишава цитотоксичността на MMDX и IFA
Adeno-3A4 инфекция на човешки туморни клетъчни линии
Adeno-3A4, изтрит от E1 и E3 регион, дефектиращ репликация аденовирус, кодиращ CYP3A4 cDNA с пълна дължина, беше използван за индуциране на експресия на CYP3A4 в две човешки туморни клетъчни линии, A549 белодробни и U251 мозъчни ракови клетки. Клетките U251 са по-податливи на аденовирусна инфекция, отколкото клетките A549, както се определя с помощта на аденовирус, кодиращ бактериална β-галактозидаза, визуализирана чрез оцветяване на заразените клетки с хромофорен субстрат X-gal (данните не са показани). При Adeno-3A4 MOI от 150, CYP3A4 РНК се увеличава до ∼ 6000 пъти в двете клетъчни линии, както се определя чрез количествена PCR в реално време (допълнителна фигура S1A). Нивата на CYP3A4 РНК в заразените с Adeno-3A4 клетки (MOI 75) са подобни на тези, открити в 9L/3A4 клетки. Adeno-3A4 също индуцира дозозависимо увеличение на CYP3A4 протеина (допълнителни фигури S1B и S2) и метаболитна активност, изследвана чрез образуването и освобождаването на 4-OH-IFA в културалната среда на клетки, инкубирани с IFA (допълнителна фигура S1C) . Като цяло, производството на 4-OH-IFA на pmol CYP3A4 протеин е два до четири пъти по-високо в 9L/3A4 клетки, отколкото в заразените с Adeno-3A4 клетки A549 и U251.
Инфекцията с Adeno-3A4 е довела дозозависими увеличения на MMDX токсичност към U251 клетки (IC50 = 1,4 n M при 100 MOI Adeno-3A4; Фигура 3а). MMDX е бил цитотоксичен за заразените с Adeno-3A4 клетки A549, но само при високи вирусни дози (IC50 = 4.7 n M при 200 MOI; Фигура 3b) (вж., IC50 (MMDX) = 24 n M в A549 контроли 27). В опит да хемосенсибилизират клетките до MMDX при по-ниски MOI на Adeno-3A4, клетките бяха коинфектирани с Onyx-017, изтрит от E1B-55kd онколитичен аденовирус, който селективно се репликира в p53-дефицитни туморни клетки и може да се използва като помощен вирус за коамплифицират и увеличават експресията и клетъчното предаване на дефектиращ с репликация вирус, кодиращ CYPs 2B6 и 2B11. 6, 34 Коинфекцията на туморни клетки A549 или U251 с Adeno-3A4 + Onyx-017 доведе до 50- до 60-кратно увеличение на CYP3A4 РНК в сравнение с инфекция само с Adeno-3A4 (допълнителна фигура S3A), придружена от големи увеличения в аденовирусна E3 РНК, получена от Onyx-017 (допълнителна фигура S3B). Обаче са получени само умерени увеличения на CYP3A4 протеин, въпреки че се наблюдава и повишена експресия на имунореактивен протеин с по-високо молекулно тегло CYP3A4 в клетки, заразени с двата вируса (допълнителна фигура S2). Onyx-017 повишава метаболитната активност на CYP3A4, зависима от Adeno-3A4 (допълнителна фигура S3C) и зависимата от CYP3A4 цитотоксичност MMDX (фигура 3c), макар и в много по-малка степен от увеличаването на CYP3A4 РНК (допълнителна фигура S3A).
Цитотоксичност на MMDX към инфектиран с Adeno-3A4 U251 (а) и клетки A549 (б и ° С), без (а и б) или с (° С) Оникс-017 коинфекция. Клетки, посяти за една нощ в 24-ямкови плаки (14 000 клетки на гнездо), бяха заразени с Adeno-3A4 или Adeno-βgal при посочения MOI за 24 часа, или самостоятелно (а и б) или в комбинация с Onyx-017 ((° С); при MOI 0,7 и 2). Клетките се третират с MMDX в прясна хранителна среда при посочените концентрации, започващи 24 часа след инфекцията. Културната среда беше заменена със среда, съдържаща пресен MMDX 2 дни по-късно, за да се сведе до минимум присъщата токсичност на вируса и инкубацията продължи още 5 дни (общо 7-дневно лечение с MMDX). Данните се изразяват като процент клетъчна преживяемост в сравнение със съответните контроли без лекарства, определени чрез оцветяване с кристално виолетово, средно ± sd (н= 3). При липса на MMDX, Adeno-3A4 беше умерено токсичен за U251 клетки (⩽ 30% клетъчно убиване при MOI 50 и 100), но не и за A549 клетки (M при 8 MOI Adeno-3A4 + 2 MOI Onyx-017 срещу ефект без A459 клетки, заразени само с 8 MOI Adeno-3A4 MMDX, метоксиморфолинил доксорубицин; MOI, множественост на инфекцията.
Влияние на CYP3A4 върху противотуморната активност на MMDX in vivo
В отделни експерименти мишки, носещи 9L/3A4 тумори, бяха третирани с MMDX чрез i.p. инжектиране на всеки 6 дни, или като серия от пет инжекции при 40 μg на kg телесно тегло или като серия от четири инжекции при 60 μg на kg телесно тегло. При i.p. не се наблюдава антитуморна активност и токсичност за гостоприемника. път на администриране на MMDX (Таблица 2). За разлика от тях, i.v. Лечението с MMDX предизвика силна системна токсичност, като четири от четири мишки умират в рамките на 7 дни (9L тумори) и три от четири мишки умират в рамките на 10 дни (9L/3A4 тумори) след завършване на първия цикъл на лечение с MMDX (Фигура 4а и Таблица 2 ). Тази токсичност беше очевидна и от загубата на телесно тегло от 3–7 g, наблюдавана при 9L и 9L/3A4 мишки, носещи тумор след i.v. Инжектиране на MMDX (Фигура 4b). Въпреки че се наблюдава загуба на телесно тегло от 2 g в 9L/3A4 мишки, носещи тумор, на 10 и 17 ден след първия i.t. Инжектиране на MMDX, възстановяване на телесно тегло и не са настъпили смъртни случаи, причинени от лекарства (Фигура 4b). Известна токсичност се наблюдава след втория цикъл на i.t. Лечение с MMDX, като две мишки умират след третото инжектиране на MMDX. По този начин MMDX, даден от директен i.t. доставката е ефективна при регресия на 9L тумори, които експресират CYP3A4, с драстично намалена токсичност за гостоприемника в сравнение с i.v. медикаментозно лечение.
Дискусия
Токсичността на активирания MMDX се проявява при концентрации на наномоларни пролекарства, което ни позволи да проведем тези проучвания при концентрации на MMDX, които са> 10 000 пъти по-ниски от Кm за MMDX, 16 μ M. 25 Независимо от това, въпреки много ниската концентрация на MMDX, има достатъчно образуване на активния метаболит MMDX, за да повлияе на убиването на туморни клетки. Тази висока сила на MMDX е запазена in vivo, където ниските лекарствени дози (60 μg на kg телесно тегло) индуцират значителен антитуморен отговор, въпреки факта, че циркулиращите концентрации на MMDX обикновено са М след болусно приложение на MMDX, 51 което е> 1000 пъти по-ниско от Кm (MMDX) за метаболизма на CYP3A4. За разлика от тях, цитотоксичността на IFA изисква милимоларни концентрации на пролекарство, в съответствие с Кm (IFA) от ∼ 1 m M, изложен от CYP3A4. 32
Човешки туморни клетки, заразени с Adeno-3A4, показват умерено повишаване на MMDX чувствителността в сравнение с това, наблюдавано в случая на инфектирани с ретровирус 9L клетки. Усилията за по-нататъшна хемосенсибилизация на туморните клетки с помощта на аденовирус на репликиращ се тумор на клетки Onyx-017 за насърчаване на репликацията и увеличаване на експресията от дефектирал в репликацията аденовирус P450 вектор 6, 34 бяха само частично успешни. Въпреки че коинфекцията на туморни клетки с Onyx-017 + Adeno-3A4 води до 50- до 60-кратно увеличение на CYP3A4 РНК в сравнение само с Adeno-3A4 инфекция, се постигат само умерени увеличения на CYP3A4 протеин и активност. По-нататъшно проучване ще бъде необходимо за разработване на стратегии за увеличаване на i.t. CYP3A4 протеин и активност in vivo, например, като се възползвате от наскоро описания стабилизиращ ефект на NFκB върху CYP3A4 протеин, 52 преди тази CYP3A4 генна терапия да може да бъде приложена в клиниката. Независимо от това, това проучване предоставя доказателство за концепцията за потенциала на CYP3A4 за генна терапия, базирана на активиране на пролекарства в контекста на висок фон на чернодробна CYP3A активност.
В обобщение, настоящите доказателствени концепции установяват терапевтичната ефикасност на лечението с MMDX в комбинация с трансфер на ген CYP3A4 и демонстрират силния противораков потенциал на тази нова комбинация ген-пролекарство. Въпреки това, ефикасността на експресията на протеин CYP3A4 в туморните клетки трябва да бъде подобрена, за да може тази стратегия да бъде приложена в клиниката. Тези проучвания също подчертават значението на нивото на експресия на туморни клетки, а не на нивото на чернодробна експресия на CYP3A4 за ефективни химиотерапевтични отговори на MMDX при липса на генно терапевтично лечение и предполагат, че биопсиите на туморни пациенти трябва да бъдат изследвани за нива на CYP3A4 протеин, за да се идентифицират лица, които са най-склонни да се възползват от лечение с MMDX и може би други CYP3A4 пролекарства.