Syed S. Quadri
1 DeBusk College of Osteopathic Medicine, Lincoln Memorial University, Harrogate, Тенеси, Съединени американски щати
Сайлъс Кълвър
2 Катедра по медицина, Университет на Вирджиния, здравна система, Шарлотсвил, Вирджиния, Съединени американски щати
Нрупама Рамкумар
3 Отдел по нефрология и хипертония, Център за здравни науки на Университета в Юта, Солт Лейк Сити, Юта, Съединени американски щати
Доналд Е. Кохан
3 Отдел по нефрология и хипертония, Център за здравни науки на Университета в Юта, Солт Лейк Сити, Юта, Съединени американски щати
Хелми М. Сираги
2 Катедра по медицина, Университет на Вирджиния, здравна система, Шарлотсвил, Вирджиния, Съединени американски щати
Свързани данни
Всички съответни данни са в хартията.
Резюме
Въведение
Затлъстяването е национална и глобална епидемия, която излага индивида на по-висок риск от сърдечни заболявания, инсулт, диабет и високо кръвно налягане (BP). До 75% от есенциалната хипертония се дължи на повишеното телесно тегло [1] и фактът, че намаляването на телесното тегло значително намалява кръвното налягане, подкрепя тази причинно-следствена връзка. [2–4] Основните механизми, регулиращи връзката между затлъстяването и повишеното задържане на натрий, водещо до повишен АТ, не са напълно разбрани.
Една от известните причини за повишен АТ по време на затлъстяване е нарушената бъбречна натриуреза, която увеличава бъбречната задръжка на натрий при затлъстяване. [5] Други фактори, допринасящи за затлъстяването, предизвикано от задържане на натрий, са повишена активност на симпатиковата нервна система, повишена активност на ренин-ангиотензин-алдостероновата система (RAS), намалени нива на натриуретични пептиди, компресия на мазнини в бъбреците и увеличаване на възпалителните цитокини. [6,7 ] Разбирането ни за всички включени фактори далеч не е изчерпателно. Докато затлъстяването увеличава задържането на натрий в различни части на нефрона, [5] точните механизми, регулиращи тези промени, не са напълно обяснени.
Чувствителният към амилорид епителен натриев канал (ENaC) е важен транспортер, който играе критична роля за поддържане на Na + хомеостазата, като засилва неговата абсорбция. [8] ENaC се състои от три субединици, α, β и γ; [9], които са силно изразени от дисталния извит канал до събирателния канал в нефрона. [10,11] От трите субединици, α-ENaC е критичен за активност на канала [9], докато β- и γ- ENaC субединиците играят допълваща роля към функцията на α-ENaC. [9] При затлъстяване, повишеното регулиране на ENaC се свързва с повишено задържане на натрий, допринасящо за развитието на повишен BP [12,13] и наскоро демонстрирахме, че намалената бъбречна експресия на α-ENaC увеличава екскрецията на натрий в урината. [14] Тези открития подчертават значението на разбирането на регулацията на α-ENaC при хипертония, предизвикана от затлъстяване.
RAS играе съществена роля в регулирането на кръвното налягане, бъбречната хемодинамична и тубулна реабсорбция на натрий. (Про) рениновият рецептор (PRR) е компонент на RAS, който се свързва с ренин и проренин и засилва тяхната каталитична активност. [15] PRR е единичен трансмембранен протеин, локализиран главно в бъбречната васкулатура, проксималните и дисталните тубули и събирателните канали. [9,15,16] Активирането на PRR стимулира различни пътища на сигнална трансдукция, включително ERK и митоген-активирана протеин киназа. [17, 18] Докато първоначално PRR беше описан като компонент на RAS, неговата независима роля от RAS в обработката на натрий чрез α-ENaC също беше демонстрирана наскоро. [14]
Към днешна дата няма проучвания, които да изследват значението на PRR в антинатриурезата, предизвикана от затлъстяване. Въз основа на съвременните познания ние предполагаме, че при диета с високо съдържание на мазнини (HFD), индуцирана затлъстяване, PRR насърчава повишено задържане на натрий в бъбреците и по-висок BP чрез регулиране на α-ENaC натриевия канал. В настоящото проучване ние използвахме наскоро разработен индуцируем модел на нокаут на PRR за широк нефрон, за да проверим нашата хипотеза. [19]
Материали и методи
Подготовка на животни
Комитетът по грижа и употреба на животните от Университета на Вирджиния одобри всички протоколи за изследване. На мишките беше позволено една седмица да се адаптират към нашето съоръжение за грижа за животните и им беше осигурена вода от чешмата ad libitum и нормална натриева диета (Harlan-Teklad, Madison, WI). Кетамин/ксилазин са били използвани за анестезия по време на събиране на бъбречна интерстициална течност, събиране на органи и евтаназия.
Индукция на специфичен за нефрона PRR KO
В настоящото изследване използвахме наскоро разработени специфични за нефрона индуцируеми PRR KO мишки, които бяха генерирани, както е описано по-рано. [19] Тези мишки бяха любезно предоставени от д-р. Доналд Е. Кохан и Нирупама Рамкумар, Център за здравни науки на Университета в Юта, Солт Лейк Сити, Юта. Накратко, тези мишки са отгледани на фон C57BL/6J и са полуизвършени за Pax8-rTA и LC1 и са хомозиготни за флоксиран PRR ген. Специфичният за нефрон PRR нокаут се предизвиква от прилагането на доксициклин в питейна вода, както е описано по-долу. В тези проучвания са използвани както мъжки, така и женски мишки. Започвайки на 10-седмична възраст, специфичните за нефрона PRR KO мишки (n = 6) са снабдени с чешмяна вода ad libitum и са били хранени с редовна диета (RD, 12% мазнини, 0,4% натриев хлорид) (Harlan-Teklad) или с високо съдържание на мазнини диета (HFD, 45% мазнини от свинска мас, 0,3% натриев хлорид) (Research Diets) за общо 10 седмици. За индуциране на широкофункционален нефрон PRR KO, след първите 4 седмици диетично лечение, мишките са били третирани с 2 mg/ml доксициклин в 2% захароза питейна вода в продължение на 12 дни, докато контролните мишки (тези, които не са подложени на PRR нокаут) са получавали 2% захароза вода само за същия период. След това всички мишки бяха поставени обратно върху нормална чешмяна вода за остатъка от 10-седмичното диетично лечение.
Генотипиране
ДНК се извлича от опашки на мишки и PCR се извършва, като се използват следните праймери:
PAX-8-rtTA (600 bp), напред: 5’-CCATGTCTAGACTGGACA AGA-3 ’; реверс: 5’-CTCCAGGCC ACATATGAT TAG-3 ’ .
PRR (600 bp), напред: 5 ′ - GGGGGGTAAATTGTTGATGAGTCTTGGAGCATAGC-3 ′; обратна 5′-GAAGCCCATGGACAGTGCAGCTACGTCTGGGATTCGA-3 ′ .
LC-1 (480 bp), напред: 5′- TCGCTGCATTACCGGTCGATGC-3 ′; обратна 5′-CCATGAGTGAACGAACCTGGTCG-3 ’ .
Систолично кръвно налягане, телесно тегло, прием на храна, 24 часа урина
АН се оценява на ден 0 (изходно ниво) и седмица 10 след диета, както е описано по-рано [20] при неанестезирани мишки, като се използва неинвазивна многоканална система за кръвно налягане с маншет (IITC Life Sciences, Woodland Hills, CA). Накратко, мишките бяха поставени в камера върху нагревателна подложка при 37 ° C за 10 минути и прехвърлени в система за кръвно налягане с маншет (IITC Life Sciences, Woodland Hills, CA). Маншетът на опашката беше свързан с цилиндър със сгъстен въздух чрез разположение на входящите и изходящите клапани, което позволяваше надуване и изпускане на маншета с постоянна скорост. Напрежението на маншета на опашката се записва непрекъснато. Сигналите от сензорите за пулс и налягане бяха усилени и след това цифровизирани с аналогово-цифрова платка, монтирана в настолен компютър. Всички мишки бяха аклиматизирани към апарата за кръвно налягане, преди да се направят измервания на маншета на опашката. Теглото на тялото, приемът на храна и събирането на урина за 24 часа са направени с помощта на отделни метаболитни клетки. Определя се общият обем на урината и аликвотните части от урината се съхраняват при -80 ° C, докато се анализират.
RT-PCR анализ
Количествената верижна реакция с обратна транскриптаза-полимеразна реално време (RT-PCR) се използва за определяне на промените в експресиите на PRR и ENaC в бъбречна медуларна mRNA. РНК (n = 4 всяка група) се екстрахира с използване на Trizol (Invitrogen, Carlsbad, СА). Обратната транскрипция на РНК се извършва, като се използва комплект за синтезиране на cDNA от първа верига (Bio-Rad, Hercules, СА). PCR се анализира, използвайки SYBR Green Supermix (Bio-Rad). Последователностите на Mouse Primer бяха както следва: PRR, напред последователност 5’-TCTCCGAACTGCAAGTGCTA-3 ’; обратна последователност 5’-CTGCAAACTTTTGGAGAGCA-3 ’; α –ENaC, пряка последователност 5′-CTAATGATGCTGGACCACACC-3 ’; обратна последователност 5’-AAAGCGTCTGCTCCGTGATGC-3 ’; β-актин, пряка последователност 5’-AGCCATGTACGTAGCCATCC-3 ’; обратна последователност 5’-ACCCTCATAGATGGGCACAG-3 ’. Реакциите бяха извършени в три екземпляра и средните стойности на праговите цикли бяха усреднени. Резултатите от mRNA за специфични целеви гени бяха изчислени с нормализиране до β-актин mRNA.
Уестърн петно
Антитела към PRR (1: 1000 разреждания, Abcam, Cambridge, MA, USA), p-SGK-1 (1: 1000 разреждания, клетъчна сигнализация, САЩ), SGK-1 (1: 1000 разреждания, клетъчна сигнализация, САЩ), α-ENaC (1: 500 разреждания; ASC-030, лаборатории Alamone, Израел) бяха използвани в Western blot на бъбречен медуларен протеин, както беше описано по-рано. [20,21] Протеиновите експресии бяха нормализирани до β-актинов протеин (1: 1000 разреждания, Санта Круз, Далас, Тексас, САЩ) Имуноблотинг беше направен, като се използва n от 4 за всички групи на лечение.
In vivo събиране и анализи на бъбречна интерстициална течност (RIF) за Ang II
In vivo RIF за измервания на Ang II се събира чрез микродиализа в края на изследването, както е описано по-рано. [22] Концентрациите на Ang II бяха определени с помощта на наличен в търговската мрежа комплект ELISA (Cayman Chemical, Ann Arbor, MI, USA). [23]
Статистически анализ
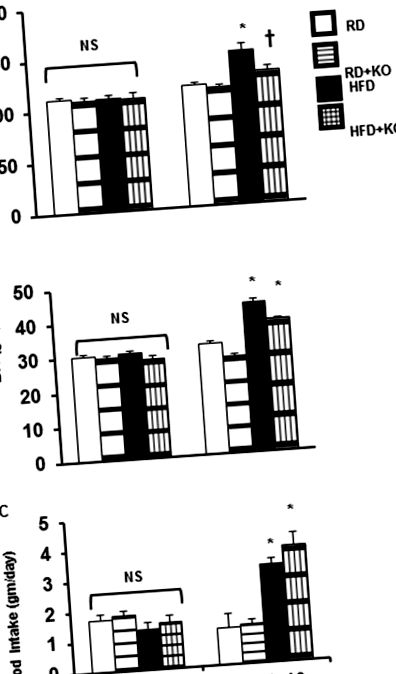
Сравненията между различните групи на лечение се оценяват чрез тест t на Student, когато е подходящо, или чрез еднопосочен ANOVA, последван от тест на Tukey за post-hoc сравнения. Данните бяха изразени като средна стойност ± SE. P Фиг. 1А), BW (HFD 43,2 ± 1,125 gm, срещу RD 31,9 ± 0,89654 gm, P Фиг. 1B) и 24-часов прием на храна (RD 1,2 ± 0,48 gm, срещу HFD 3,2 ± 0,21 gm, P Фиг. 1С). В сравнение с контролите на HFD, индукцията на PRR KO (HFD + PRR KO) значително намалява SBP (HFD 149.4 ± 6.04 mmHg спрямо HFD + PRR KO 129 ± 3.75 mmHg P Фиг. 1А). PRR KO не променя BW (HFD 43,2 ± 1,125 gm, срещу HFD + PRR KO 38,0 ± 0,36 gm) (Фигура 1B) или 24-часовия прием на храна (HFD 3,2 ± 0,21 gm срещу HFD + PRR KO 3,8 ± 0,42 gm) (Фигура 1С). Нямаше значителни разлики в BP, BW и 24-часов прием на храна в началото (ден 0) (Фигура 1).
(A) Систолично кръвно налягане (SBP), (B) телесно тегло (BW) и (C) 24-часов прием на храна на изходно ниво и след 10 седмици след редовна диета (RD) и диета с високо съдържание на мазнини (HFD) при мишки с или без PRR KO. Данните са представени като средна стойност ± SEM, NS няма значителна разлика, * p Фиг. 2A и 2B). В края на 10 седмици, в сравнение с контролите на RD, контролните мишки, хранени с HFD (HFD 1,3 ± 0,08 ml/ден, срещу RD 2,54 ± 0,18 ml/ден, P Фиг. 2А). В сравнение с контролите на RD, RD + PRR KO значително повишава UV с 62% (RD + PRR KO 4,12 ± 0,37 ml/ден срещу RD 2,54 ± 0,18 ml/ден, P Фиг. 2А).
Изразяване на PRR в отговор на HFD
Бъбречната медуларна PRR иРНК и протеинова експресия е показана на фигури ЗА и ЗВ. В сравнение с RD, експресията на PRR на бъбречната медуларна и белтъчна експресия е значително увеличена при мишки, хранени с HFD, съответно с 69% и 47% (P Фиг. 3E и 3F) и фосфорилиране на p-SGK-1 с 48% (P Фиг. 3C) при мишки, хранени с HFD. В сравнение само с RD, RD + PRR KO значително атенюира бъбречната експресия на иРНК и протеини на α-ENaC съответно с 55% и 27% (P Фиг. 3E и 3F). В сравнение само с HFD, HFD + PRR KO мишките също значително намаляват бъбречната експресия на mRNA и протеини на α-ENaC съответно с 67% и 83% (P Фиг. 3E и 3F) и p-SGK-1 с 50%, (P Фиг. 3С). Няма промени в общата експресия на SGK-1 (Фигура 3D).
Бъбречна интерстициална течност ангиотензин II (Ang II)
Експресия на бъбречна интерстициална течност (RIF) на ангиотензин II в бъбреци на RD и HFD мишки със или без PRR KO. Данните са представени като средно ± SEM, * p Фиг. 4). Нашите открития имат значителни терапевтични последици за лечението на хипертония при затлъстяване, тъй като потенциално представляват нова цел за регулиране на бъбречната работа с натрий извън предварително установените механизми. Индуцираната от затлъстяването антинатриуреза и повишеното АН все пак е сложно болестно състояние и са необходими допълнителни проучвания, за да се разбере по-добре как връзката между PRR и α-ENaC се вписва в по-широкия обхват на бъбречните промени, които настъпват при затлъстяването.
Отчет за финансиране
Това проучване беше подкрепено от Националните здравни институти безвъзмездна помощ DK114875, DK078757 и HL091535 за HMS. Финансистите не са играли роля в дизайна на проучването, събирането и анализа на данни, решението за публикуване или подготовката на ръкописа.