А. А. А. Премаратне
Училище за биологични науки, Университет на Кентърбъри, Частна чанта 4800, Крайстчърч 8140, Нова Зеландия
Дейвид У. М. Люнг
Училище за биологични науки, Университет на Кентърбъри, Частна чанта 4800, Крайстчърч 8140, Нова Зеландия
Резюме
Активността на аминопептидазата (AP) в зрели, но твърди плодове на Actinidia deliciosa се характеризира с използване на L-левцин-p-нитроанилид като субстрат. Ензимната активност е най-висока при алкални условия и е термолабилна. EDTA, 1,10-фенантролин, йодоацетамид и Zn 2+ имат инхибиторен ефект, докато ниска концентрация на дитиотреитол (DTT) има стимулиращ ефект върху активността на АР на киви. DTT обаче не е от съществено значение за ензимната активност. Получените резултати показват, че кивито AP е тиол-зависима металопротеаза. Активността му е била най-висока в семената, последвана от сърцевината и околоплодната тъкан на плода. Профилът на елуиране на активността на АР от колона DEAE-целулоза предполага, че в кивито има поне два AP-ензима: една неадсорбирана и една адсорбирана фракция. Заключението е, че полезните хранителни аминопептидази от киви могат да бъдат разкрити с помощта на по-специфични субстрати.
1. Въведение
Киви (Actinidia spp.) Е важна търговска култура в Нова Зеландия. Плодът съдържа високо ниво на цистеинова ендопептидаза, наречена актинидин (E.C. 3.4.22.14), намираща се в кората на плода [1]. Поради тази протеолитична активност на кивито, той се използва за омекотяване на месото и предотвратяване на втвърдяването на желе на основата на желатин.
Аминопептидазите (AP), особено тези от микробни източници, са важни ензими за преработка на храни и се използват широко за модифициране на протеини в храната [2–4]. Продуктите от животински отпадъци също бяха изследвани като потенциален източник на полезни AP [5]. Възможно е също така AP от растения да са от полза в хранително-вкусовата промишленост [6]. Наскоро беше демонстрирано, че AP на листа от зеле или нахутни котиледони могат да се използват за катализиране на хидролизата на пептидни връзки, включително тези на хидрофобните горчиви пептиди в соевите протеинови хидролизати, което води до продукти с по-малко горчив или нежен вкус, които имат приложения за преработка на храни [ 7, 8]. Въпреки това, за отстраняване на протеиновите хидролизати или други хранителни нужди, атрактивна алтернатива би била използването на AP от плодове, отглеждани в търговската мрежа, които обикновено се консумират в прясно състояние, като киви, които заслужават вече да се считат за безопасни за хранително-вкусовата промишленост.
Като цяло има много изследвания върху семенните аминопептидази [9-11], но има малко информация за появата и характеристиките на активността на АР в плодовете. Важното е, че тъй като няма предварително проучване на AP от киви, предпоставка за целта на оценката на употребата на AP от този плод за приложения за преработка на храни е разследване на появата и биохимичните характеристики на активността на аминопептидазата (AP) на киви. Тук се използва L-левцин-p-нитроанилид (L-leu-p-NA) като субстрат, локализация и някои основни биохимични характеристики на активността на АР в плодовете на Actinidia deliciosa и опит за частично пречистване на ензима, който обикновено е достатъчно за хранителни ензими са отчетени тук.
2. Материали и методи
2.1. Екстракция на ензими
Зрял, но твърд киви (Actinidia deliciosa cv. Hayward) е получен от местен супермаркет в Крайстчърч, Нова Зеландия. Освен ако не е посочено друго, целият киви се бели и нарязва на малки парченца преди ензимната екстракция. Тъканите от киви се смилат в хаванче и се добавят 0,1 М калиев фосфатен буфер рН 8,0, допълнен с 1% (w/v) неразтворим поливинил полипиролидон (PVPP), 5% (v/v) глицерол и 3 mM DTT. Съотношението на теглото на тъканта (g) към обема на екстракционния буфер (ml) е 2: 1. Хомогенатът се филтрира през 2 слоя синтетичен плат и се центрофугира при 10 000 х g за 20 минути при 4 ° С. Супернатантът беше внимателно отстранен и използван като суров екстракт от целия плод. Процесът на екстракция се извършва в студено помещение или на ледена баня.
2.2. Определяне на общата концентрация на протеин
Концентрацията на протеини в екстрактите се определя въз основа на принципа на свързване на брилянтно синьо багрило с протеин на Coomassie [12]. Изготвена е стандартна крива на протеина, като се използват серийни разреждания на BSA (говежди серумен албумин; BDH, Англия).
2.3. Определяне на активността на аминопептидазата (AP)
2.4. Ефект на температурата върху активността на AP
Ефектът на температурата върху активността на AP е определен в три различни експеримента. За да се намери оптималната температура за ензимната активност, активността на AP в суровите екстракти от целия плод се определя при различни температури на инкубация, вариращи от 25 ° C до 70 ° C за 1 h. В друг експеримент за изследване на термична стабилност, 150 μl от ензимните екстракти бяха предварително инкубирани с 0,45 ml калиев фосфатен буфер (рН 8,0) в продължение на 30 минути при горните температури на изпитване. След преинкубация се добавя субстратът, за да се инициира ензимната реакция за определяне на активността на АР при 37 ° С за 1 h.
2.5. Ефект на pH върху активността на AP
Ефектът на pH върху активността на AP в суровите екстракти от плодове се определя чрез заместване на калиевия фосфатен буфер при pH 8.0 в сместа за анализ, с трите буферни смеси (25.0 mM оцетна киселина, 25.0 mM MES и 50.0 mM Tris) при различни стойности на pH, вариращи от 6 до 10, както е описано в [13]. След това беше определена активността на AP.
2.6. Ефект на различни класове протеолитични ензимни инхибитори и промотори върху активността на AP
Суровите ензимни екстракти бяха предварително инкубирани с 0,45 ml 0,1 М калиев фосфатен буфер (рН 8) в присъствието на различни инхибитори или активатори за 30 минути при 37 ° С. След предварителна инкубация ензимната реакция се инициира чрез добавяне на субстратен разтвор (L-leu-p-NA) и се определя активността на АР. Концентрацията на активаторите в реакционната смес по време на предварителната инкубация е 1.0 или 10.0 mM. Тестваните химикали са EDTA, 1, 10-фенантролин, PMSF, DTT, йодоацетамид и NEM.
2.7. Ефект на двувалентни катиони върху активността на АР
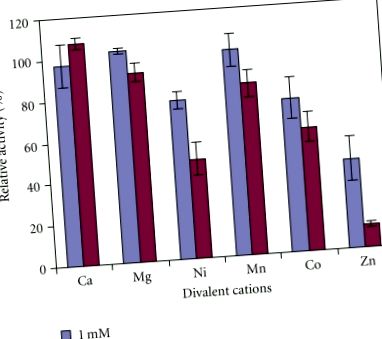
Суровите ензимни екстракти бяха предварително инкубирани при 37 ° С в продължение на 30 минути с 0,45 ml 0,1 M калиев фосфатен буфер в присъствието на хлоридите на Mn 2+, Co 2+, Ni 2+, Mg 2+, Ca 2+ или Zn 2+. Концентрацията на двувалентни катиони в реакционната смес по време на предварителната инкубация е 1.0 или 10.0 mM. След предварителна инкубация се добавя субстратен разтвор (L-leu-p-NA), за да се започне ензимната реакция и се определя активността на АР.
2.8. Частично пречистване на аминопептидаза
Целият киви (550 g) се нарязва на малки парченца и се хомогенизира в 225 ml 0,1 M калиев фосфатен буфер (pH 8,0), допълнен с 1% (w/v) неразтворим PVPP, 5% (v/v) глицерол и 3 mM DTT (буфер за екстракция). Хомогенатът се филтрира през 2 слоя синтетичен плат. Филтратът се центрофугира при 10 000 х g при 4 ° С в продължение на 20 минути и супернатантата се отстранява и се използва като суров екстракт. Към суровия екстракт се добавя твърд амониев сулфат ((NH4) 2SO4) и получената 25–75% утайка се разтваря в 7,5 ml 0,01 M калиев фосфатен буфер, съдържащ 10% (v/v) глицерол и 0,2 mM DTT (буфер) А). След диализа на 25–70% амониева сулфатна фракция срещу буфер А, се използва DEAE целулозна колона (10 × 2 cm) за отделяне на фракциите. Свързаните протеини се елуират с буфер А и след това свързаните протеини се елюират със 100 ml от буфер А, съдържащ линеен градиент от 0,00-1,0 М KCl.
2.9. Статистически анализ
Статистическият анализ на данните е извършен с помощта на софтуера STATISTIX 8.0. Сравнението между леченията беше анализирано с помощта на еднопосочен дисперсионен анализ (ANOVA). Там, където се наблюдава статистическа значимост, се провежда тест за честна разлика на значимостта на Tukey (HSD), за да се определи колко значими са от съответната нула стойностите. Стандартните грешки бяха изчислени и графично представени като симетрични ленти за грешки.
3. Резултати и дискусия
3.1. Активност на аминопептидаза (AP) в различни части на плодовете на Actinidia deliciosa
В предварителните експерименти, когато суровите екстракти от целия плод са били приготвени с натриев фосфат или калиев фосфатен буфер (рН 7.0), активността на АР не се открива. Кивито съдържа повече от 80 летливи аромат и ароматични съединения, включително терпенси, естери, алдехиди, алкохоли с различни нива на монотерпени и фенолни съединения [14, 15]. Тези съединения биха могли да повлияят на изолирането и активността на аминопептидазата. Тук е установен надежден протокол (както е описан в раздел 2) за извличане на AP от киви и определяне на неговата активност, като се използва L-левцин-p-нитроанилид (L-leu-p-NA) като субстрат. Настоящото проучване за първи път установява, че кивито има АР активност и някои полезни параметри по отношение на неговата екстракция, анализ, стабилност, локализация и пречистване.
Активност на АР е открита във всички части на плода на A. deliciosa на различни нива. Най-високата специфична (единици/mg разтворим протеин) и общата (единици/g прясно тегло) активност на АР е локализирана в семето, последвано от сърцевината, вътрешния и външния перикарп, съответно (Таблица 1). За разлика от това, в хиподермата на напълно узрелите гроздови плодове са установени по-високи ензимни активности, отколкото в семената или плътта [13].
маса 1
Аминопептидазна активност в различни части на киви a .
| Външен перикарп | 0,38 ± 0,15 | 0,37 ± 0,10 |
| Вътрешен перикарп | 0,64 ± 0,19 | 0,52 ± 0,07 |
| Ядро | 2,91 ± 0,68 | 3.68 ± 0.96 |
| Семе | 60,15 ± 7,99 | 5,78 ± 0,48 |
активност на аминопептидаза (AP) се определя в екстракти от всяка тъкан от три различни плода на A. deliciosa. Представени са средни стойности ± стандартни грешки.
3.2. Ефекти на рН и температурата върху активността на AP Kiwifruit
Активността на AP в суровите екстракти от целия киви е най-активна при алкално рН (Фигура 1; ANOVA, P Фигура 2). Той е най-стабилен при 37-40 ° C (Фигура 3), но става нестабилен, тъй като само по-малко от 15% от неговата активност остава при температури по-високи от 55 ° C (ANOVA, P Фигура 4). За разлика от това, 1 mM DTT имаше лек стимулиращ ефект (ANOVA, P 2+, Mg 2+, Co 2+, Ni 2+, Mn 2+ и Zn 2+ с хлорид като противодействащ йон бяха изследвани (Фигура 5 При концентрации на метални йони от 1 mM само Zn 2+ значително инхибира АР активността на киви (ANOVA, P 2+ (ANOVA, P 2+, Co 2+ и Mn 2+. При тази концентрация Ca 2+ и Mg 2 + не са имали значителни ефекти. Това предполага, че активността на АР може да се различава от тази на предварително проучена протеаза в киви, която е инхибирана от калциеви йони [21]. Освен това активността на АР на киви е различна от тази при картофите, Arabidopsis, домат, свине и Е. coli pep A, тъй като те са силно активирани от йони Mn 2+ и Mg 2+, но също така са инхибирани от йони Zn 2+ [16–18]. Активността на АР на киви също се различава от тази на гроздови плодове което не е инхибирано от EDTA, 1,10-фенантролин или метални йони [13].
Ефект на двувалентните катиони върху активността на аминопептидазата в суровите екстракти от целия плод на A. deliciosa. Ензимната активност при липса на каквито и да било катиони (контрола) се приема като 100%. Представени са средни стойности на три различни екстракта ± стандартни грешки.
3.4. Частично пречистване на аминопептидаза от киви
Два основни пика на активност на АР бяха разделени с помощта на DEAE целулозна колонна хроматография: неадсорбираната и адсорбираната фракции (Фигура 6), което предполага, че има най-малко две изоформи на активност на АР в плодовете на A. deliciosa. В тези фракции беше установено, че само няколко полипептиди с ниско молекулно тегло присъстват след SDS PAGE (данните не са показани). Това може да е лесен начин за получаване на относително чиста хранителна аминопептидаза от киви. По-нататъшни проучвания, използващи по-специфични субстрати, могат да доведат до някои полезни аминопептидази от хранителен клас от киви. Техниките на рекомбинантна ДНК също могат да бъдат приложени за масово производство на AP, произхождащи от киви.
Профил на елуиране от DEAE целулозна колона с активност на аминопептидаза (AP) и съдържание на протеин в концентрирана фракция от утаяване на амониев сулфат на сурови екстракти от плодове A. deliciosa. Първите 30 фракции се елуират с 10 тМ калиев фосфатен буфер (рН 8), допълнен с 10% глицерол. Следващите фракции се елуират с линеен градиент от 0 до 1.0 М KCI в същия буфер. Една единица ензимна активност се определя като промяна в една единица абсорбция при 410 nm на час при 37 ° C. Съдържанието на протеин се измерва при 280 nm.
- Оценка на диета и интервенция за физическа активност, базирана на подслон, за възрастни без дом - Пълна
- ОЦЕНКА НА ПОТЕНЦИАЛНИТЕ ПОЛЗИ ОТ КРАСТВАЦИТЕ ЗА ПОДОБРЕНО ЗДРАВЕ И ГРИЖА ЗА КОЖАТА • JARLIFE
- Хранителна Klebsiella pneumoniae Вирулентен потенциал, антибиотична устойчивост и рискове за храната
- Доказателство Кратко 3 Деца; диета и училища - Центърът за изследване на диетата и активността
- Динамика на състоянието на физическа активност при пациенти със степен на затлъстяване от ІІІ до ІІІ степен в отговор на физическо