Свързани термини:
- Сорбитол
- Кросповидон
- Магнезиев стеарат
- Твърдост на таблета
- Микрокристална целулоза
- Скорбялен гликолат натрий
- Прахообразен поток
Изтеглете като PDF
За тази страница
Приложение ASAP: Нестабилен кандидат за наркотици в ранно развитие
Анджали Агравал,. Зеена Уилямс, в Ускорена предиктивна стабилност, 2018
3.2.2 Оценка на прототипи на таблетни формулировки с общи помощни вещества
Таблица 9. Състави на прототипни таблетни формулировки
| 50 | 50 | 50 | 50 | 50 | 50 |
| 47 | 44 | 22. | 0 | 22. | 0 |
| 0 | 0 | 22. | 0 | 0 | 0 |
| 0 | 0 | 0 | 44 | 22. | 0 |
| 0 | 0 | 0 | 0 | 0 | 44 |
| 3 | 3 | 3 | 3 | 3 | 3 |
| 0 | 3 | 3 | 3 | 3 | 3 |
Таблица 10. ASAP Резултати от прототипи на таблетни формулировки
| 0,51 | 5.2 | 6.6 | 4.9 | 4.4 |
| 0,85 | 6.2 | 6.9 | 6.3 | 4.7 |
| 0,62 | 6.1 | 7.0 | 6.1 | 4.6 |
| 0,82 | 6.1 | 4.9 | 7.7 | 4.7 |
| 0,85 | 6.3 | 5.1 | 7.7 | 4.9 |
| 0,75 | 6.0 | 5.0 | 7.3 | 4.6 |
Таблица 11. Сравнително предвиждане на срока на годност (години) на прототипи на таблетни формулировки, използващи ASAPprime®
| 29.366 ± 4.641 | 32,545 ± 4,952 | 31,813 ± 4,657 | 43.167 ± 4.904 | 42,016 ± 4,924 | 41,43 ± 4,463 | |
| 20,745 ± 3,298 | 23,088 ± 3,522 | 22,531 ± 3,313 | 30,792 ± 3,490 | 29.932 ± 3.500 | 29.541 ± 3.324 | |
| 0,013 ± 0,004 | 0,019 ± 0,005 | 0,018 ± 0,005 | 0,031 ± 0,005 | 0,029 ± 0,005 | 0,029 ± 0,004 | |
| 0.949 | 0,979 | 0.969 | 0.947 | 0.948 | 0.962 | |
| Предвиден срок на годност (години) a | ||||||
| 0,51 | 0,65 | 0,64 | 3.59 | 2.87 | 3.0 | |
| 0,63 | 0,81 | 0,74 | 3.74 | 3.12 | 3.61 | |
| 0,76 | 1.28 | 1.20 | 10.6 | 8.28 | 7,98 | |
| 0,62 | 0,90 | 0,82 | 4.54 | 4.74 | 4.85 | |
Също така беше отбелязано, че при сравняване на резултатите от ASAP на F # 3 и F # 5 (Таблица 11), където MCC е използван при същия процент (Таблица 9), скорбялата изглежда е в състояние да смекчи дестабилизиращия ефект на MCC и направи формулировка F # 5 жизнеспособна опция, въпреки включването на несъвместимо помощно вещество MCC.
Захарни алкохоли ☆
Таблетиране
Въпреки че всички прахообразни полиоли могат да бъдат компресирани на ротационни машини, за да се получат таблетки, сорбитолът е най-разпространеният полиол, използван в тази област.
Прахообразният сорбитол има отлични свойства на течливост за таблетиране. Добрата течливост е много важна, за да се осигури еднакво тегло на таблетката. В сравнение с други директно компресируеми материали, прахообразният сорбитол дава високо увеличение на якостта на опън в зависимост от силата на компресия и следователно е много подходящ за директно компресиране. Поради доста високата им хигроскопичност, таблетките на основата на сорбитол трябва да бъдат защитени или съхранявани при относително сухи условия, за да се избегне омекотяване поради влага. Пригодността на таблетките сорбитол, дори тези, компресирани при ниско налягане, е изключително ниска и се подобрява допълнително чрез съхранение при относителна влажност, близка до равновесната. Цялостната ефективност на сорбитол на прах при таблетиране зависи от различни фактори, като например размера и разпределението на частиците, кристалната морфология и условията на компресия.
ЗАХАРНИ АЛКОХОЛИ
Тублет
Въпреки че всички прахообразни полиоли могат да бъдат компресирани на ротационни машини, за да се получат таблетки, сорбитолът е най-разпространеният полиол, използван в тази област.
Прахообразният сорбитол има отлични свойства на течливост за таблетиране. Добрата течливост е много важна, за да се осигури еднакво тегло на таблетката. В сравнение с други директно компресируеми материали, прахообразният сорбитол дава високо увеличение на якостта на опън в зависимост от силата на компресия и следователно е много подходящ за директно компресиране. Поради тяхната доста висока хигроскопичност, таблетките на основата на сорбитол трябва да бъдат защитени или съхранявани при относително сухи условия, за да се избегне омекотяване поради събиране на влага. Целесъобразността на таблетките сорбитол, дори тези, компресирани при ниско налягане, е изключително ниска и се подобрява допълнително чрез съхранение при близка до равновесната относителна влажност (ERH). Цялостната ефективност на сорбитол на прах при таблетиране зависи от различни фактори, като размер и разпределение на частиците, кристална морфология и условия на компресия.
OXPIRT: Онтологична eXpert система за производство на родова таблетка с незабавно освобождаване
Нопфадол Шалортам,. Phuriwat Leesawat, в Formulation Tools for Pharmaceutical Development, 2013
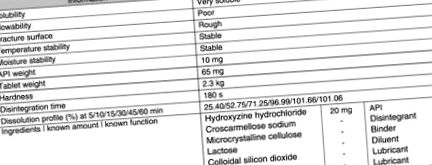
Хидроксизин хидрохлорид
Информация за оригиналния хидроксизин хидрохлорид е дадена на фигура 8.9 .
Фигура 8.9. Информация за хидроксизин хидрохлориден продукт от предварително формулиране и оригиналния му патент
Правилата IF-THEN, свързани с информацията на фигура 8.9, са изброени в таблица 8.6 .
Таблица 8.6. Правила, използвани за регулиране на концентрацията на генеричния хидроксизин хидрохлорид
| Аз | АКО И ТОГАВА |
| II | АКО И ТОГАВА |
| III | АКО времето за разпадане на оригинала е по-малко или равно на 180 s> И ТОГАВА |
| IV | АКО ТОГАВА |
| V | АКО И И И И И ТОГАВА |
Фигура 8.10. Резултат от OXPIRT за генеричен продукт на хидроксизин хидрохлорид.
Резултат от OXPIRT се изисква да бъде произведен в лаборатория, за да се изследват свойствата на таблетките за стандартен контрол на качеството. Фигури 8.11 и 8.12 показват съответно профил на разтваряне и графика, сравняващи оригиналната и родовата версия, получени от Фигура 8.10, а резултатът показва фармацевтична еквивалентност, тъй като факторите на разлика (f1) и сходство (f2) са в приемливи граници.
Фигура 8.11. Резултат от фармацевтичната еквивалентност между оригиналния и генеричния хидроксизин хидрохлорид
Фигура 8.12. Профил на разтваряне на оригинална таблетка Atarax® и родова таблетка хидроксизин хидрохлорид
Експертна система за разработване и формулиране на таблетки с осмотична помпа push-pull, съдържащи лошо водоразтворими лекарства
Авто регулиране
Когато потребителят избере „автоматично“ на диаметъра на инструмента в интерфейса за избор на помощни вещества, регулирането на теглото на сърцевината на таблетката ще се извърши автоматично, което означава, че системата ще оптимизира теглото на таблетката в широк диапазон само според правила. Това ще бъде изпълнено по следния начин.
Изчислява се теглото на сърцевината на таблетката от първоначалната формулировка. След това отидете на (ii).
Суспензията в лекарствения слой се увеличава с 10%, ако теглото на сърцевината на таблетката е по-малко от 300 mg. Всички останали помощни вещества в сърцевината на таблетката се променят със същата скорост. След това отидете на (iii).
Ако теглото на сърцевината на таблетката е между 300 mg и 400 mg, се преминава към следващата стъпка, която ще модифицира формулировката, за да се намери тази, която може да освободи лекарството, както се очаква.
Ако теглото на сърцевината на таблетката е над 400 mg, изтласкващият слой се намалява до 40% от лекарствения слой, което означава, че изтласкващият слой се намалява до 40%/60% от първоначалното му количество, включително набъбващия агент, осмотичен агент, свързващо вещество, пигмент и смазка в тласкащия слой. Първоначалната употреба на слоя за изтласкване е 60% от слоя с лекарството според правилата. След това отидете на (iv).
Изчислява се теглото на сърцевината на таблетката на модифицираната формулировка. След това отидете на (ii).
Изчислява се теглото на сърцевината на таблетката на модифицираната формулировка. Ако основното тегло е не повече от 800 mg, тогава се преминава към следващата стъпка, която ще модифицира формулировката, за да се намери тази, която може да освободи лекарството, както се очаква.
Ако теглото на сърцевината е по-голямо от 800 mg, изтласкващият слой се намалява до 25% от лекарствения слой, което означава, че изтласкващият слой се намалява до 25%/60% от първоначалното му количество. И тогава се изчислява теглото на сърцевината на таблетката на модифицираната формулировка. Ако теглото на сърцевината все още е по-голямо от 800 mg този път, системата ще завърши процеса и ще покаже съобщение, за да информира потребителя, че системата не може да намери целевата формулировка. Или преминава към следващата стъпка, която ще модифицира формулировката, за да намери тази, която може да освободи лекарството, както се очаква.
Работният процес е показан на фигура 4.16 .
Фигура 4.16. Работен процес на промяна на теглото на сърцевината (автоматично ограничение на теглото на сърцевината). Изход: системата не може да получи приемлив резултат, след това излиза от процесите и информира потребителя. Отидете на следващата стъпка: системата получава приемлив резултат и след това преминава към следващата стъпка
Интегрирано приложение на принципите за качество по дизайн към лекарствения продукт и разработването на неговата стратегия за контрол
6.3 Потенциалност и еднородност на съдържанието
Параметрите на процеса и материалните атрибути, изследвани въз основа на оценка на риска за потентност и еднородност на съдържанието, са показани на фиг. 14 .
Фиг. 14. Атрибути на материала и параметри на процеса, оказващи влияние върху потентността и еднородността на съдържанието (Badawy et al., 2016).
Параметрите на смесване и размерът на частиците на лекарственото вещество представляват нисък риск поради високото натоварване на лекарството на бриваниб аланинат в таблетките (50% w/w). Следователно те не са проучени за тяхното въздействие върху потентността на таблетките и еднородността на съдържанието. При формулировки с голямо натоварване с лекарство, еднородността на потентността и съдържанието обикновено се контролират предимно от средното тегло на таблетката и варирането на теглото. Следователно те се считат за критични за контрола на тези CQA.
Атрибутите на материала в процес, за които е известно, че влияят на варирането на теглото на таблетката по време на компресиране, включват гранулационно разпределение на частиците и свойства на потока. Параметрите на процеса на мокро гранулиране и смилане бяха оценени за ефекта им върху разпределението на гранулационните частици, свойствата на течливостта и варирането на теглото на таблетката при компресия в гореспоменатите проучвания на DOE. Въпреки че промяната в параметрите на мокро гранулиране и смилане причинява известна промяна в крайното разпределение на размера на частиците на сместа и скоростта на потока (измерена от тестера на потока на Erweka) (фиг. 8), тази промяна в разпределението на размера на гранулите и скоростта на потока не оказва влияние върху варирането на теглото на таблетката в изследванията на компресията. Следователно параметрите за мокро гранулиране и смилане се считат за некритични по отношение на тяхното въздействие върху ефикасността и еднородността на съдържанието.
Нова технология за модернизиране на фармацевтичното производство
37.4.5 Компресия
Сегрегация по време на пълнене на матрицата, което води до проблеми с еднородността на съдържанието, може да възникне, ако прахообразният материал има широко разпределение на частиците или вариране на плътността. Времето, необходимо за запълване на матрицата, може да бъде повлияно от ниска обемна плътност, лоша свиваемост или сплотеност на прахообразния материал, което води до променливост на теглото на таблетката и недостатъчна твърдост на таблетката. 18 Променливостта на твърдостта на таблетката може да повлияе на производителността на продукта (т.е. разтварянето). 42,43 Излишното количество фини частици може да доведе до проблеми с компресията, като таван. В допълнение, физиохимичните свойства на активната съставка могат да повлияят на склонността към температурно зависими полиморфни трансформации по време на процеса на уплътняване. 46
Таблетните преси са друг пример за оборудване, което в момента работи непрекъснато. Въпреки това, за да може таблетирането да бъде интегрирано с операциите нагоре по веригата в непрекъсната линия, динамиката на нивото на пълнене в захранващия бункер може да се различава от тази, наблюдавана при традиционното партидно производство. 18 Един оперативен подход е да се избере скоростта на купола на таблетната преса, за да съответства на желаната скорост на линията на процеса. Тогава нивото на пълнене в бункера може да се остави да варира по време на работа, за да служи като буфер за абсорбиране на вариацията на скоростта на потока нагоре по веригата.
Настройка на спецификацията и контрол на производствения процес за твърди лекарства за перорално приложение
25.5.1 Изпитвания на материали в процес и атрибути за качество
Изпитванията на материали в процеса са един от критичните компоненти на контрола на процеса. Те могат да се извършват по време на производството на лекарствено вещество или лекарствен продукт, а не като част от официалната група от тестове, които се провеждат преди пускането на продукта. 1 Тестове в процеса, които се използват само с цел коригиране на параметрите на процеса в рамките на работен диапазон (например твърдост и ронливост на ядрата на таблетките, които ще бъдат покрити, и индивидуалното тегло на таблетката) не са включени в спецификациите. Таблица 25.7 изброява типични тестове на материали в процес за твърди орални дозирани форми.
Таблица 25.7. Примери за тестове в процес на твърди перорални дозирани форми