Резюме
Заден план
Метаболитният синдром (MetS) е установен като риск от сърдечно-съдови заболявания и смъртност при пациенти на хемодиализа. Приемът на енергия (EI) е важна хранителна терапия за предотвратяване на MetS. Изследвахме връзката на самоотчетените хранителни EI с метаболитни аномалии и MetS сред пациентите на хемодиализа.
Методи
Дизайнът на напречно сечение беше извършен от септември 2013 г. до април 2017 г. в седем центъра за хемодиализа. Данните бяха събрани от 228 пациенти на хемодиализа с приемлив доклад за EI, на възраст 20 и повече години, подложени на три сесии на хемодиализа седмично в продължение на поне 3 месеца. Диетичният EI се оценява чрез тридневен диетичен запис и се потвърждава чрез 24-часово диетично изземване. Съставите на тялото бяха измерени чрез анализ на биоелектричния импеданс. Биохимичните данни бяха анализирани с помощта на стандартни лабораторни тестове. Граничните стойности на дневния EI са 30 kcal/kg и 35 kcal/kg за възраст ≥ 60 години и
Въведение
Разпространението на лекуваната крайна фаза на бъбречно заболяване (ESRD) непрекъснато се увеличава от 2001 до 2014 г. във всички страни и се превръща в тежест за всяка държава и здравна система [1]. През 2014 г. разпространението на пациентите с ESRD, подложени на диализа в Тайван, е 3093 пациенти на милион население, като около 90% от тях получават лечение в центъра на хемодиализа [1]. Беше обобщено, че хранителният фактор е замесен като рисков фактор за развитието на метаболизма при хронично бъбречно заболяване, особено при пациенти с ESRD [2].
Хранителната терапия е призната за ефективен подход за предотвратяване на метаболитни аномалии и неблагоприятни резултати при хора с хронични заболявания [3,4,5,6,7,8]. Повишеният хранителен прием на енергия се споменава в насоките на Националната бъбречна фондация - Резултати за бъбречната болест (K/DOQI) [9]. Препоръчително е ежедневното консумиране на достатъчно енергия да гарантира азотния баланс и да предотвратява катаболизма на протеините и разрушаването на тъканите, което би могло да оптимизира хранителния статус и резултатите от хемодиализата [9]. Въпреки това, дневният прием на макро-хранителни и микро-хранителни вещества е до голяма степен неадекватен при пациенти на хемодиализа [10]. Повече от половината пациенти на хемодиализа са имали проблеми да следват указанията за здравословна диета (свързани с приема на енергия и хранителни вещества), които са свързани с поведението, техническите затруднения, физическите условия, времето и приготвянето на храна [11]. Неадекватният хранителен прием също е възможен резултат от значителна промяна в начина на живот по време на диализно лечение. От друга страна, придържането към сложен и рестриктивен хранителен прием допълнително изостря хранителния дефицит при тази група пациенти [9, 12,13,14].
Разпространението на метаболитния синдром е високо при пациентите с ESRD, подложени на хемодиализа [15]. MetS е замесен като рисков фактор за развитието на диабет, сърдечно-съдови заболявания, рак и смъртност от всички причини [16,17,18,19]. Разпространението на метаболитния синдром варира в зависимост от различни критерии за оценка, напр. 51%, 66,3% и 75,3% според Националната програма за образование за холестерол, Панел за лечение на възрастни III (NCEP ATP III), Международната федерация по диабет (IDF) и критериите за хармонизиране на метаболитния синдром (HMetS), съответно [20]. Това показва, че все още няма нито едно определение, което да отразява реалния спектър на епидемиологията на MetS. Следователно в настоящото проучване бяха използвани две дефиниции с различни фокуси за оценка на MetS: Дефиницията на Американската асоциация на клиничните ендокринолози (AACE), фокусирана върху хипергликоземията, беше глюкоцентрична [21]; и хармонизиране на метаболитен синдром дефиниция е съгласувано със съвместно изявление на IDF, Американската асоциация за сърцето (AHA) и Националния институт за сърцето, белите дробове и кръвта (NHLBI), Световната сърдечна федерация, Международното дружество за атеросклероза и Международната асоциация за Изследване на затлъстяването, което се отнася до събирането на коремно затлъстяване и свързаните с него рискови фактори за ССЗ [22].
Имаше малко проучвания, изследващи приема на диета сред пациенти на хемодиализа. Едно проучване сравнява състоянието на прием на диета между 54 пациенти с HD и 47 пациенти, които не са с HD, и между деня на диализата и деня на недиализа сред възрастни хора в Бразилия [23]. Другото проучване в Съединените щати изследва само връзката между приема на енергия в храната и промените в телесния състав при 13 пациенти с HD [24]. В допълнение, диетичният подход беше намерен като ефективна терапия за намаляване на повечето от рисковете за MetS в рандомизирано контролирано проучване [25]. Пациентите на хемодиализа обаче са с високо разпространение на метаболитен синдром и като цяло изпитват трудности при постигане на препоръчания прием на енергия. Доколкото ни е известно, ролята на хранителния прием на енергия върху метаболитните нарушения сред пациентите на хемодиализа остава да бъде проучена.
Това проучване трябваше да изследва връзката на неадекватен хранителен прием на енергия с метаболитни аномалии и метаболитен синдром сред пациенти, които получават хемодиализно лечение от седем центъра за хемодиализа. Предполага се, че пациентите на хемодиализа с докладван неадекватен хранителен енергиен прием (IDEI) имат по-голяма вероятност да имат метаболитни аномалии или метаболитен синдром.
Методи
Проучване дизайн и настройка
Изготвен е проект на напречно сечение от септември 2013 г. до април 2017 г. Събрахме данни от 492 пациенти от центрове за хемодиализа в седем болници. Пробата от проучване се състои от 165 от болница в Тайпе, Медицински университет - Тайпе, болница Wan Fang, 39 от Медицински университет в Тайпе, болница Shuang Ho, 41 от болница Cathay, 57 от болница Тайбе Tzu-Chi, 49 от Wei-Gong Мемориална болница и 50 от болница Lotung Poh-Ai.
Размер на пробата
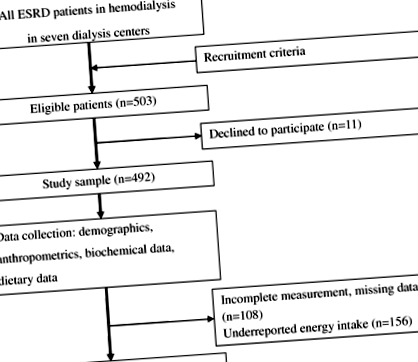
Размерът на извадката в дизайн на напречно сечение се изчислява по формулата: \ (n = \ frac \) Къде н (размер на пробата), Z. (ниво на доверие), P (очаквано разпространение) и д (прецизност, съответстваща на размера на ефекта) [26]. Пробата от 92 беше изчислена с Z. = 1,96 за грешка от тип I от 5%, P = 0,745, тъй като разпространението на MetS е 74,5% при пациенти на хемодиализа [27], и д = 0,1, както се препоръчва за медицинско проучване [28]. В настоящото проучване крайната проба от 228 пациенти е подходяща за анализ и е изобразена на фиг. 1.
Блок-схема на вземане на проби от пациентите и процедура на изследване. ESRD: Краен стадий на бъбречно заболяване
Критерии за набиране на пациенти
Пациентите в настоящото проучване са изпълнили критериите за набиране, както е споменато другаде [29,30,31].
Процедура за събиране на данни
Лекарите и медицинските сестри във всяка болница проверяват за квалифицирани пациенти, които отговарят на критериите за набиране. След това интервюиращите (регистрирани диетолози) се свързаха с допустимите пациенти и поискаха доброволното им участие.
Допустимите пациенти са подписали формуляра за информирано съгласие, преди да участват в лични или телефонни интервюта, проведени от регистрирани диетолози (тридневен хранителен прием, физическа активност). Медицинските карти бяха прегледани след интервютата. Измервани са също антропометрични и енергийни разходи. Лицензирани медицински сестри събираха кръвни проби на първата диализна сесия през учебната седмица, след това биохимичните данни бяха анализирани с помощта на налични лабораторни тестови комплекти, процедурата беше описана подробно другаде [32].
Мерки
Характеристики на пациентите
Информацията относно възраст, пол, реколта на хемодиализа, съпътстващи заболявания, изчислени с помощта на индекса на коморбидност на Чарлсън [33], история на хипертония, сърдечно-съдови заболявания и захарен диабет тип 2 (T2DM), индекс на телесна маса, ИТМ (kg/m 2), преди -диализно систолно (SBP) и диастолично (DBP) кръвно налягане също бяха оценени с помощта на медицински записи. Обиколката на талията (WC), телесната мастна маса (FM) бяха оценени с помощта на устройство за анализ на био-електрически импеданс (InBody S10, Biospace, Сеул, Корея), подробната процедура беше описана другаде [34]. Повишената телесна мастна маса се определя като FM ≥ 25% за мъжете, FM ≥ 30% за жените, съответно [35]. Изчислени са и интердиалитични печалби на тегло (IDWG). По-висока IDWG, свързана с по-висока BP при пациенти на хемодиализа [36].
Физическа дейност
Кратката версия на Международния въпросник за физическа активност беше използвана за оценка на нивото на физическа активност. Пациентите бяха попитани за прекараното им време (дни в седмицата и минути на ден) на различни нива на физическа интензивност (енергични, умерени, ходене и седене), попълването на въпросника отне 4 до 15 минути [37]. Общият резултат за физическа активност се изчислява като сбор от минути, прекарани в дейности на различни нива на енергично, умерено, ходене и седене през последните седем дни, умножено съответно на 8,0, 4,0 и 3,3, 1,0 [38]. Общият метод, използващ метаболитна еквивалентна задача, отбелязана в минута на седмица (наречена MET-min/wk), е използван за представяне на физическата активност [39].
Диетичен енергиен прием
Използвахме тридневен запис на хранителен прием, за да оценим приема на пациента и потвърдихме данните чрез 24-часово диетично изземване, подробностите бяха споменати другаде [32, 40]. Накратко беше събрана информацията, свързана с имена на храни, марка, съставки, методи на готвене, порция или тегло, местоположение на хранене и време. За анализ на хранителни вещества е използван софтуерът e-Kitchen, софтуер за анализ на хранителни вещества (Nutritionist Edition, Enhancement plus 3, версия 2009, Тайчунг, Тайван).
Препоръчителният дневен хранителен енергиен прием е бил ≥35 kcal/kg за пациенти на възраст под 60 години и ≥ 30 kcal/kg за тези на възраст над 60 години, съответно [9]. Неадекватният хранителен прием на енергия се определя като пациенти, консумирали по-малко от препоръчителните нива. За да се подобри надеждността на мерките и анализите, данните за енергийния прием на хранителни вещества (EI), които се отчитат по-малко, бяха изключени от окончателния анализ, ако съотношението на EI: REE 2 за тайванци) [50]. (3) TG ≥150 mg/dL, HDL-C 0,5 mg/dL) [52], повишен инсулин (FPI ≥ 12 mU/L) [53, 54], iPTH ≥300 pg/mL [55]. В допълнение, лошият хранителен статус, включително nPNA
Резултати
Средните ± SD на възрастта, реколтата на хемодиализа, физическата активност, CCI и междудиализното нарастване на теглото са съответно 59,4 ± 11,3, 5,5 ± 5,0, 4831,3 ± 1893,1, 4,6 ± 1,5 и 3,0 ± 1,7. От изследваната извадка има 64,9% мъже, 38,2% диабет, 48,2% хипертония и 29,8% сърдечно-съдови заболявания, 28,5% с повишено ниво на hs-CRP, 54,5% повишена телесна мастна маса. REE е по-нисък при пациенти с неадекватен EI (1014,5 ± 280,4) от тези с адекватен EI (1100,9 ± 274,7), с стр = 0,023. По отношение на метаболитните аномалии, преобладаването на IFG, наднормено тегло или затлъстяване, повишен WC, висок BP, висок TG и нисък HDL-C са съответно 64,9%, 36,4%, 26,3%, 81,6%, 39,0% и 61,0%. Разпространението на метаболитния синдром е 63,2%, както е диагностицирано по AACE критерии, и 53,9%, както е диагностицирано по HMetS критерии. Разпространението на метаболитните аномалии (не хипертония) и синдромите са статистически значимо по-високи при пациенти на хемодиализа с неадекватен EI, отколкото тези, които имат адекватна EI (Таблица 1). От пациентите 60,5% съобщават за по-малко от препоръчителното ниво на хранителен прием на енергия. Пациентите с неадекватна ЕИ по-често консумират неадекватни протеини и мазнини, но консумират по-малко минерали, вода и витамини от тези с адекватна ЕИ (Таблица 2).
Резултатите от двувариантните логистични регресионни анализи показват, че по-високата възраст се свързва с по-голямо разпространение на IFG и AACE-MetS с нечетно съотношение, OR = 1,03, 95% доверителен интервал, 95% CI, 1,00–1,05, стр Таблица 3 Двувариатен анализ на ефектите от личните фактори и приема на диета върху метаболитни аномалии и метаболитен синдром
Съобщава се за неадекватен хранителен прием на енергия, свързан с 1,83–6,20 пъти метаболитни аномалии или метаболитен синдром. Това беше значително свързано с по-високо разпространение на IFG (OR = 2.50, 95% CI, 1.43–4.37, стр Таблица 4 Асоциации на хранителния прием и метаболитни аномалии и метаболитен синдром чрез многовариантни логистични регресионни анализи
При анализи на подгрупи неадекватният EI показва значителна връзка с по-високо разпространение на AACE-MetS в групата без хипертония (OR = 4,09, 95% CI, 1,55-10,77, стр = 0,004) и групата на не-сърдечно-съдовите заболявания (OR = 2,59, 95% CI, 1,23–5,42, стр = 0,012); и свързано с HMetS в група диабет (OR = 8,33, 95% CI, 2,08–33,37), стр = 0,003), нехипертония (OR = 5,33, 95% CI, 1,97–14,40, стр = 0,001), хипертония (OR = 2,59, 95% CI, 1,05–6,37, стр = 0,038) и не-ССЗ (ИЛИ = 3,79, 95% CI, 1,80–7,97, стр Таблица 5 Асоциация между неадекватен енергиен прием и метаболитен синдром в подгрупите на медицинската история a
Дискусия
В настоящото проучване резултатите изясниха, че се съобщава за неадекватен хранителен прием на енергия (IDEI), свързан с повече аномалии на MetS и по-висок дял на MetS. Съобщените IDEI силно определят 2,26 до 8,17 пъти метаболитни аномалии и MetS, диагностицирани или по критерии AACE или HMetS. При пациенти на хемодиализа IDEI нарушава енергийния баланс и азотния баланс, увеличава разрушаването на тъканите и белтъчния катаболизъм, които причиняват MetS и влошават резултатите от диализата [64]. От друга страна, беше установено, че MetS е високорисков за много хронични здравословни проблеми като затлъстяване, T2DM, сърдечно-съдови заболявания, рак и всички причини за смърт [16,17,18,19]. Поради това ранната идентификация на MetS и хранителната терапия бяха силно препоръчителни за намаляване на неблагоприятните здравословни проблеми [25, 65]. В допълнение, пациентите, които са консумирали адекватно богат на енергия протеин, могат да подобрят баланса на телесните протеини, телесният състав, който допълнително подобрява резултатите от хемодиализата [66].
Настоящото проучване показа, че около 60% от пациентите на хемодиализа консумират нисък хранителен прием на енергия. Това беше в съответствие с надеждна предишна публикация, в която пациентите са имали най-много 75% от приема на енергия и протеини, както се препоръчва от насоките K/DOQI [9]. Разпространението на MetS беше високо в настоящото проучване (63,2% AACE-MetS, 53,9% HMetS), а в предишни проучвания в Южен Тайван беше 61,0%, измерено по критерии NCEP-ATP III [15]. В сравнение с предишни проучвания, разпространението на MetS е по-ниско в настоящото проучване, отколкото в проучване в Бразилия (74,5%), използвайки критериите HMetS [27], и в Съединените щати (69,3%), използвайки критериите NCEP-ATP III [67].
Настоящите резултати илюстрират, че неадекватният хранителен EI е свързан с високо разпространение на HMetS в различни подгрупи. В проучване, проведено в Италия, авторите установяват, че пациентите с MetS съобщават за по-нисък енергиен прием от тези без MetS [76]. Това предполага, че MetS, диагностициран чрез критерии за хармонизиране на метаболитния синдром, е по-чувствителен от AACE-MetS по отношение на енергийния прием. На практика, за да се подобрят резултатите от хемодиализата, адекватният хранителен EI се препоръчва от насоките K/DOQI, които могат да намалят рисковете от MetS [9].
Настоящото проучване демонстрира, че по-голямото разпространение на IFG и AACE-MetS се наблюдава при по-възрастни пациенти. Асоциацията е установена и в предишни проучвания върху общата популация в Норвегия, която MetS е диагностицирана или по NCEP-ATP III, или по критерии на IDF [60], и при лица в САЩ [61]. Това подчерта, че възрастните хора са по-склонни да имат метаболитни отклонения, рискове от ССЗ и диабет тип 2. Следователно дефинициите на MetS трябва да бъдат специално класифицирани за възрастни хора, тъй като се нуждаят от цялостна оценка на рисковите фактори. От друга страна, мъжете по-често изпитват наднормено тегло/затлъстяване, но по-рядко имат повишена обиколка на талията в сравнение с жените. Това може да се обясни, че мъжете имат по-голяма коремна висцерална мастна тъкан (вероятно съответстваща на ИТМ), но по-малко коремна подкожна мастна тъкан (вероятно съответстваща на обиколката на талията) от жените [77].
Проучването, проведено върху 153 пациенти на хемодиализа в три диализни центъра в Техеран, демонстрира, че разпространението на MetS сред жените е по-високо от това сред мъжете [62]. В настоящото проучване обаче полът е бил значително свързан с метаболитни аномалии, но не и с AACE MetS или HMetS. Това предполага, че полът трябва да се вземе предвид при оценка или лечение на пациенти с MetS, наличието на метаболитни нарушения при мъжете или жените може да зависи от техния специфичен начин на живот и поведение.
По-дългият период на хемодиализа показва защитното въздействие върху MetS сред изследваните пациенти на хемодиализа. Това по някакъв начин изразява качеството на хемодиализата в диализните центрове в Тайван, което отразява ефективността на програмата за мултидисциплинарна помощ в болниците от 2003 г. за борба с хроничните бъбречни заболявания и свързаните с тях съпътстващи заболявания [78]. В допълнение, пълното възстановяване на разходите за диализа от Националното здравно осигуряване в медицинската система на Тайван може допълнително да оптимизира качеството на грижите [79], което от своя страна намали разпространението на метаболитните нарушения в това проучване.
Физическата активност не е свързана с метаболитни аномалии или MetS в настоящото проучване. Преглед на няколко рандомизирани проучвания обаче заключава, че физическата активност намалява вероятността от развитие на MetS; ако няма противопоказания, трябва да се помисли за по-интензивни физически упражнения или тренировки за съпротива, за да се предотврати и лекува MetS [63]. В допълнение, пациентите, които са извършвали редовни упражнения, са имали по-добри резултати от диализата и ползи за здравето, както се съобщава в международно проучване върху пациенти на хемодиализа [80].
И накрая, повишеното ниво на hs-CRP не показва връзката с MetS и неговите компоненти. В противоречие съществуваше връзка в предишното проучване, че възпалителните биомаркери имат корелация с MetS при пациенти на хемодиализа [62]. Повишеното ниво на hs-CRP може да бъде ключов независим предиктор за неблагоприятни резултати при пациенти на хемодиализа с MetS. Следователно намаляването на серумното ниво на hs-CRP трябва да се обмисли за предотвратяване на MetS, CVD и накрая смъртността сред пациентите на хемодиализа.
Заключения
Това беше първото проучване, изследващо връзката на докладвания хранителен ИИ с метаболитни аномалии и MetS, диагностицирани от AACE и критерии за хармонизиране на метаболитния синдром при пациенти на хемодиализа. Установихме, че неадекватният EI е с високо разпространение и е свързан с до 2.26–8.17 гънки на MetS и неговите компоненти. Насърчаването на адекватен хранителен прием на енергия следвайки насоките K/DOQI може да помогне за подобряване на диализното качество, предотвратяване на MetS, минимизиране на негативните ефекти от метаболитните нарушения и техните последици, от своя страна, оптимизиране на качеството на грижите и подобряване на качеството на живот на пациентите с ХД . Предлагат се бъдещи проучвания за внимателно проучване на механизма и оценка на ефекта от диетичните енергийни интервенции.
Съкращения
Метаболитен синдром, диагностициран от Американската асоциация на клиничните ендокринолози
- По-голямото хранително натоварване с киселина потенциално увеличава серумните триглицериди и разпространението на затлъстяването при възрастни
- Високият хранителен прием на магнезий е свързан с ниска инсулинова резистентност в Нюфаундленд
- Високият хранителен прием на наситени мазнини се свързва с намалено качество на спермата сред 701 млади
- По-високи диетични протеини по време на отслабване Мускулни щадящи Филипс - 2018 - Затлъстяване - Wiley Online
- Ниският хранителен прием на натрий увеличава риска от смърт при перитонеална диализа на Американското общество на