Резюме
Заден план
Сред Felidae, регистрирани на Корейския полуостров, тигърът Panthera tigris, леопард Panthera pardus, и рис Рис рис сега са застрашени, докато леопардовата котка Prionailurus bengalensis, останалата котешка, е глобално застрашено месоядно животно. Тук изследвахме хранителните навици на леопардовите котки, като анализирахме плячката на ДНК в скат и стомашно съдържание. Също така тествахме дали плячкосната ДНК в проби от скат, събрани от естествени местообитания, може точно да идентифицира видовете плячка от съдържанието на стомаха.
Резултати
След визуален анализ на съдържанието на стомаха от 11 леопардови котки, убити по пътищата, молекулярен анализ на цитохрома б генът на митохондриалния геном от 56 подпроби от съдържанието на стомаха позволи да се идентифицират 7 вида бозайници, 1 вид птици и 1 вид земноводни. При анализа на няколко слепи подпроби (напр. Кости), изолирани от фекални проби, бяха идентифицирани пет вида плячка, използвайки контролни маркери в техниката на денатурираща градиентна гел електрофореза (DGGE) и допълнителен анализ на секвенирането.
Заключения
Нашите резултати показват, че DGGE анализът може да служи като потенциален инструмент за изучаване на диети, повишавайки възможността за неинвазивен подход за изучаване на хранителните навици на леопардовите котки.
Заден план
Има 12 подвида на леопардовата котка Prionailurus bengalensis, и те се различават значително по външен вид и избор на местообитание. Prionailurus bengalensis euptilurus е единственият подвид, за който се съобщава, че живее в Манджурия (Китай), Източна Русия, Цушима (Япония) и Корея (Nowell and Jackson 1996). Леопардовата котка е включена в списъка и защитена съгласно Приложения I и II към Конвенцията за международна търговия със застрашени видове от дивата фауна и флора (CITES); конкретно, P. bengalensis в Индия, Бангладеш и Тайланд е посочен в Приложение I на CITES поради ниското му изобилие P. bengalensis в други области е изброено в Приложение II (Nowak 1999). Подвидът P. bengalensis euptilurus е определен за застрашен вид клас II, тъй като е почти изчезнал в Корея.
Леопардовата котка е харизматична мегафауна, с привлекателни характеристики; той обаче е уязвим и за изчезване поради загуба на местообитания и преследване. Определянето на хранителните навици на този котешки вид може да бъде ключов фактор в екологичните проучвания и усилията за опазване (Farrell et al. 2000). Диетичните навици на леопардовата котка са изследвани в Тайланд (Rabinowitz 1990; Grassman 2000; Austin 2002; Grassman et al. 2005), Tsushima, Japan (Tatara and Doi 1994) и Филипините (Fernandez and De Guia 2010). Определянето на такива диетични навици обаче зависи от морфологичната идентификация във връзка с микроскопския анализ на косата на жертвите. Въпреки че беше успешно предприета молекулярна скатология за определяне на специфични за видовете ДНК в някои пленници (например морски лъвове Steller) и други диви бозайници (например ягуара и пумата; Farrell et al. 2000; Deagle et al. 2005), този генетичен скрининг техника не е прилагана за диви леопардови котки.
Тук използвахме молекулярен анализ за изследване на хранителните навици на леопардовите котки в Корея от скат и стомашно съдържание. Също така изследвахме дали генетичният скрининг с помощта на техниката на денатурираща градиентна гел електрофореза (DGGE) може точно да идентифицира плячката ДНК в сравнение с ДНК, получена от съдържанието на стомаха. Установихме, че молекулярната скатология предоставя надеждна информация за предпочитанията на плячката на леопардовите котки и може да допринесе за настоящата необходимост от стратегии за опазване и управление на тази глобално застрашена дива популация.
Методи
Проби
Между октомври 2005 г. и септември 2006 г. стомасите на 11 мъртви леопардови котки бяха събрани по пътищата в Гурие, Корея (Таблица 1). Когато леопардова котка е намерена убита на пътя, нейните координати са маркирани с помощта на GPS (Sportrak MAP, Magellan SporTrak, Thales Navigation, San Dimas, CA, USA); записват се полът, датата и кота; и е направена снимка (Nikon D70, Токио, Япония) на образеца. Стомасите се съхраняват при -70 ° C, докато се анализират. Смляното стомашно съдържание се визуално анализира и също се подлага на молекулярен анализ.
Скатът от леопардови котки се диференцира от други малки месоядни животни по отношение на формата и размера и/или наличието на специфични за вида следи (Grassman et al. 2005). Среден диаметър от 1 см за ската на леопардовата котка е използван като еталон. Ако приемем, че канибализмът не се е появил (Grassman et al. 2005), друг критерий за идентифициране на леопардови котки е наличието на погълната коса по време на автоматичното поддържане. Диетата на леопардовите котки беше изследвана чрез анализ на тяхната скат. Скат е събран от Samcheok през 2006 г., Goheung през 2011 г. и Gwangju през 2011 г. в Корея (Таблица 1). Скарата се поставя в найлонов чорап с фина мрежа и се измива за отделяне на съдържанието. След това съдържанието се изсушава на слънце и се съхранява в 70% алкохол.
ДНК екстракция
Двадесет и пет милиграма от всяка отделна проба от тъкан, пръст и опашка от съдържанието на стомаха бяха изолирани. Костните проби от кучетата леопардови котки бяха внимателно почистени с помощта на скалпел за еднократна употреба и сгъстен въздух и бяха смлени на фин прах в малък хаван. ДНК беше извлечена от костните прахове, тъканите, пръстите на краката и опашките с помощта на QIAamp комплект за кръв и тъкани (Qiagen, Валенсия, Калифорния, САЩ), съгласно инструкциите на производителя. ДНК беше извлечена от 61 проби (56 различни подпроби от съдържанието на стомаха и 5 слепи подпроби от кости, изолирани от скат).
Стандартна полимеразна верижна реакция
Извършена е стандартна полимеразна верижна реакция (PCR) с помощта на комплект за усилване на ДНК AccuPower® HotStart PCR PreMix (Bioneer, Daejeon, Корея) с праймери за пълните човешки митохондриални ДНК последователности L14841 (5′-AAAAAGCTTCCATCCAACATCTCAGCATGATGAAA-3 ′) и ′ -AAACTGCAGCCCCTCAGAATGATATTTGTCCTCA-3 ′) (Kocher et al. 1989) за усилване на 307-bp фрагмент от цитохрома б ген. Към всяка проба се добавят 2 μl геномна ДНК матрица. Условията за PCR бяха както следва: 40 цикъла на денатурация при 94 ° С за 1 min, отгряване при 51 ° C за 1 min и удължаване при 72 ° C за 2 min. Пробите се разделят, като се използват 2.0% агарозни гелове.
DGGE анализ
За да идентифицираме допълнителни последователности в нашите PCR продукти, използвахме DGGE, техника, която може да отдели различни ДНК последователности (Myers et al. 1987). Разделянето се осъществява чрез електрофореза на ДНК фрагментите, като се използва полиакриламиден гел, който съдържа градиент с нарастваща концентрация на денатуранти. Подвижността на фрагментите се определя от тяхното поведение на топене при денатурирането им и това зависи в голяма степен от последователността. DGGE се извършва с помощта на системата V20-HCDC (Scie-Plas, Саутхемптън, Великобритания). За проби, разделени с помощта на DGGE, праймерът GC-L14841 (5′-CGCCCGCCGCGCCCCGCGCCCGTCCCGCCGCCCCCGCCCGAAAAAGCTTCCATCCAACATCTCAGCATGATGAAA-3 ′) е преработен, за да включва G-C скоба и температурата на C ° и най-ниската температура от 1989 г., C ° и др. Другите условия на PCR остават същите като тези, използвани за стандартната PCR. Шаблонът е 1 μl от разреждане 1:10 на незалепналия PCR продукт.
PCR продуктите се зареждат директно върху 8% полиакриламидни гелове, потопени в 1 × TAE буфер (40 mM Tris ацетат при рН 7.4, 20 mM натриев ацетат и 1 mM EDTA). Геловете се приготвят с денатурантен градиент от 35%
64% (7 M карбамид; GIBCO-BRL, Гранд Айлънд, Ню Йорк, САЩ) и 40% дейонизиран формамид (v/v; Сигма-Олдрич, Сейнт Луис, Мисури, САЩ). Електрофорезата се извършва при постоянно напрежение 70 V и температура 56 ° C и се провежда в продължение на 15 h. След електрофорезата геловете се инкубират в продължение на 15 минути в дестилирана вода, съдържаща етидиев бромид (0,5 mg/ml), изплакват се в продължение на 10 минути с дестилирана вода и се снимат с помощта на системата SynGene Genius (Core Bio система, Сеул, Корея). Преди секвенирането, PCR продуктите се пречистват с помощта на QIAquick PCR комплект за пречистване (Qiagen), съгласно инструкциите на производителя.
Анализ на обхвата на DGGE
Лентите DGGE се изрязват с помощта на стерилен скалпел и се прехвърлят в 30 μl стерилна дестилирана вода. Този разтвор се съхранява през нощта при 4 ° C, преди да се използва 1-μl аликвотна част за повторно амплифициране (с PCR) на изолирания продукт с оригиналния набор от грундове (без последователността на GC-затягане на праймера), като се използват същите условия на амплификация по-горе. PCR продуктите бяха проверени с помощта на електрофореза в агарозен гел и след това бяха пречистени с помощта на QIAquick PCR комплект за пречистване (Qiagen), съгласно инструкциите на производителя.
Анализ на последователността
Секвенирането беше извършено с помощта на комплекти праймери L14841 и H15149 в Genotech (Daejeon, Корея). ДНК последователностите бяха сравнени с публично достъпни последователности в GenBank с помощта на основния инструмент за локално търсене на подравняване (Altschul et al. 1990).
Резултати
Съдържание на стомаха
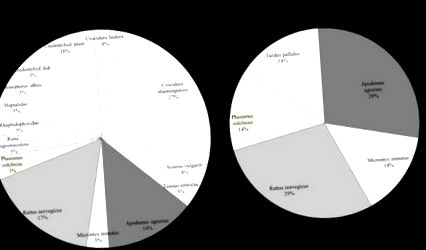
Процент предмети от плячка, идентифицирани в скапата на леопардовата котка P. bengalensis събран. Областите за изследване са в Gurye, Goheung, Gwangju и Samcheok, Корея.
DGGE анализ
Анализът DGGE позволи да се идентифицират осем вида плячка (C. shantungensis, S. vulgaris, T. sibiricus, A. agrarius, M. minutus, R. norvegicus, P. colchicus, и R. nigromaculata) (Фигура 2а). Усилването на всеки вид създава една лента, която не мигрира с никоя от останалите ленти на плячката на DGGE гела. DGGE анализът на разпръснати проби показва резултати, подобни на тези от съдържанието на стомаха, и линии 2, 3 и 4 могат да бъдат идентифицирани като един от осемте таксона от съдържанието на стомаха (Фигура 2b). Линии 1 и 5 не съответстват на нито една от пробите от съдържанието на стомаха и следователно тези две ленти бяха изрязани от гела и секвенирани; самоличността им беше потвърдена Turdus pallidus ([GenBank: EU154651.1], максимално отстъп 96%) и R. norvegicus ([GenBank: JX105356.1], макс. Отстъп 97%).
Денатуриращо градиентно гел електрофорезно разделяне на mtDNA цитохром b PCR продукти. а) PCR продукти, амплифицирани от геномна ДНК матрица от стомашно съдържимо на леопардовата котка: осем вида смес (M), R. norvegicus (път 1), T. sibiricus (път 2), A. agrarius (път 3), R. nigromaculata (път 4), M. minutus (път 5), P. colchicus (лента 6), S. vulgaris (платно 7), и C. shantungensis (път 8). б) PCR продукти, амплифицирани от ДНК, извлечена от скат (пътеки 1
5): осем вида смес (M), T. pallidus (лента 1, Samcheok), R. norvegicus (път 2, Samcheok), A. agrarius, M. minutus (лента 3, Gwangju), P. colchicus (лента 4, Gwangju), A. agrarius, R. norvegicus (път 5, Goheung). а, P. colchicus; б, Sciurus vulgaris; ° С, T. sibiricus; д, A. agrarius; д, M. minutus; е, R. norvegicus; ж, C. shantungensis; з, R. nigromaculata.
Дискусия
Нашите резултати показаха, че 71,6% от предметите на плячка, идентифицирани в съдържанието на стомаха и скап на леопардовата котка, са малки бозайници (Таблица 1), което показва, че това е основна плячка на този вид. Тези резултати са в съответствие с тези от Борнео (Rajaratnam et al. 2007), Тайланд (Grassman et al. 2005) и Tsushima, Japan (Tatara and Doi 1994), където предпочитанията за плячка са идентифицирани чрез морфологични анализи. Процентът на хищничество на гризачи е висок, което може да се дължи на относителното изобилие и наличието на гризачи през цялата година.
Космите от леопардови котки бяха открити в голям брой в стомаха и разпръснати проби от резултатите от визуалния анализ и секвенирането (8 от 56 анализирани проби бяха потвърдени като коса от леопардова котка). Космите в пробите от стомаха и разсейките най-вероятно са резултат от собственото им поддържане, а не от канибализъм (Grassman et al. 2005). Растенията са съставлявали 9,1% от съдържанието на стомаха. Като се има предвид, че шимпанзетата (Пан троглодити) и Аляска кафяви мечки (Ursus arctos) консумират продукти с високо съдържание на фибри за борба с паразитите (Huffman 1997), възможно е това да е същата причина за консумацията на растения сред леопардовите котки. В допълнение, няколко проучвания предполагат, че това явление е неволно последствие от храненето с животинска плячка и че консумацията на растения от снежния леопард Uncia uncia и леопардова котка P. bengalensis вероятно ще осигури минерални или витаминни добавки, които не могат лесно да бъдат получени от животинска плячка (Shehzad et al. 2012). Остава обаче неясно дали растенията са били случайно или умишлено изядени.
В стомаха на леопардовите котки са открити два екземпляра риба. Единият беше идентифициран като Monopterus albus, но другият образец не може да бъде идентифициран поради липсата на подходящи набори праймери за амплифициране на прицелната ДНК. Въпреки че не може да се изключи, че леопардовата котка може да е яла мъртви риби в рамките на техните домашни ареали, тези резултати може да са показателни за способността й да плува, да лови и да яде риба (Lekagul и McNeeley 1977). Това е още по-очевидно от факта, че рибите са били открити в стомаха на индивиди, посещаващи бреговете на реката в това проучване (напр. Река Сеом-Джин), както и от факта, че са определени 1,2% от жертвите на леопардови котки. да бъдем риба от Татара и Дой (1994).
Заключения
Препратки
Altschul SF, Gish W, Miller W, Myers EW, Lipman DJ: Основен инструмент за търсене на локално подравняване. J Mol Biol 1990 г., 215: 403–410.
Остин SC: Екология на симпатичните месоядни животни в националния парк Као Яй, Тайланд. Тексас: доктор дисертация, Texas A&M University-Kingsville и Texas A&M University, College Station; 2002 г.
Deagle B, Tollit D, Jarman S, Hindell M, Trites A, Gales N: Молекулярна скатология като инструмент за изследване на диетата: анализ на плячка ДНК в плът от пленни морски лъвове Steller. Мол Екол 2005 г., 14: 1831–1842. 10.1111/j.1365-294X.2005.02531.x
Farrell LE, Romant J, Sunquist ME: Диетично разделяне на симпатрични хищници, идентифицирани чрез молекулярен анализ на скат. Мол Екол 2000 г., 9: 1583–1590. 10.1046/j.1365-294x.2000.01037.x
Фернандес DAP, De Guia APO: Хранителни навици на висайските леопардови котки (Prionailurus bengalensis rabori) в полетата със захарна тръстика на западните негроски Филипини. Asia Life Sci 2010 г., 20: 143–154.
Grassman L Jr: Движения и диета на леопардовата котка Prionailurus bengalensis в сезонна вечнозелена гора в Южен централен Тайланд. Акта Териол 2000 г., 45: 421–426.
Grassman LI, Tewes ME, Silvy NJ, Kreetiyutanont K: Пространствена организация и диета на леопардовата котка (Prionailurus bengalensis) в северен централен Тайланд. J Zool 2005 г., 266: 45–54. 10.1017/S095283690500659X
Hofreiter M, Poinar HN, Spaulding WG, Bauer K, Martin PS, Possnert G, Paabo S: Молекулярен анализ на диета от земни ленивци през последното заледяване. Мол Екол 2000 г., 9: 1975–1984. 10.1046/j.1365-294X.2000.01106.x
Хъфман МА: Текущи доказателства за самолечение при примати: мултидисциплинарна перспектива. Am J Phys Anthropol 1997 г.,104(25): 171–200.
Kisand V, Wikner J: Ограничена разделителна способност на 16S рДНК DGGE, причинена от свойствата на топене и тясно свързани ДНК последователности. J Microbiol Meth 2003 г., 54: 183–191. 10.1016/S0167-7012 (03) 00038-1
Kocher TD, Thomas WK, Meyer A, Edwards SV, Pääbo S, Villablanca FX, Wilson AC: Динамика на еволюцията на митохондриална ДНК при животни: амплификация и секвениране с консервирани праймери. Proc Natl Acad Sci САЩ 1989 г., 86: 6196–6200. 10.1073/pnas.86.16.6196
Lekagul B, McNeeley J: Бозайници от Тайланд. Асоциация за опазване на. Банкок: Дивата природа; 1977 г.
Myers RM, Maniatis T, Lerman LS: Откриване и локализация на едноосновни промени чрез денатурираща градиентна гел електрофореза. Методи в ензимологията 1987 г., 155: 501–527.
Nowak RM: Бозайниците на Уокър по света. 6-то издание. Балтимор, доктор по медицина: Университетската преса на Джон Хопкинс; 1999 г.
Nowell K, Jackson P: Диви котки: проучване на състоянието и план за действие за опазване. Жлеза, Швейцария: IUCN; 1996 г.
Рабиновиц А: Бележки за поведението и движенията на леопардови котки, Felis bengalensis, в суха тропическа горска мозайка в Тайланд. Biotropica 1990 г., 22: 397–403. 10.2307/2388557
Rajaratnam R, Sunquist M, Rajaratnam L, Ambu L: Диета и избор на местообитания на леопардовата котка (Prionailurus bengalensis borneoensis) в селскостопански пейзаж в Сабах, Малайзия Борнео. J Trop Ecol 2007 г., 23: 209–217. 10.1017/S0266467406003841
Shehzad W, McCarthy TM, Pompanon F, Purevjav L, Coissac E, Riaz T, Taberlet P: Предпочитание за плячка на снежен леопард (Panthera uncia) в Южна Гоби, Монголия. PloS One 2012 г., 7: e32104. 10.1371/journal.pone.0032104
Taberlet P, Waits LP, Luikart G: Неинвазивно генетично вземане на проби: погледнете, преди да скочите. Тенденции Ecol Evol 1999 г., 14: 323–327. 10.1016/S0169-5347 (99) 01637-7
Татара М, Дой Т: Сравнителен анализ на хранителните навици на японска куница, сибирска невестулка и леопардова котка на островите Цушима, Япония. Ecol Res 1994 г., 9: 99–107. 10.1007/BF02347247
Благодарности
Благодарим на Bum Jun Jo за неговата упорита работа и съдействието при работа на терен. Също така изразяваме благодарността си към TY Choi, CG Choi и DG Choi за събирането на мъртви леопардови котки.
Информация за автора
Принадлежности
Департамент по биологични науки, Колеж по природни науки, Национален университет Chonnam, 77 Yongbong-ro Bukgu, Gwangju, 500-757, Южна Корея
Ohsun Lee, Sua Lee, Dong-Ha Nam & Hak Young Lee
Можете също да търсите този автор в PubMed Google Scholar
Можете също да търсите този автор в PubMed Google Scholar
Можете също да търсите този автор в PubMed Google Scholar
Можете също да търсите този автор в PubMed Google Scholar
Автори-кореспонденти
Допълнителна информация
Конкуриращи се интереси
Авторите заявяват, че нямат конкуриращи се интереси.
Принос на авторите
OL, SL, HYL и D-HN извършиха молекулярно-генетичните изследвания, участваха в подреждането на последователностите и изготвиха ръкописа. Всички автори прочетоха и одобриха окончателния ръкопис.
Оригинални подадени файлове на автори за изображения
По-долу са връзките към оригиналните подадени файлове за изображения на авторите.
- Роля на хранителните навици и диетата при появата и тежестта на кариеса сред градското юношеско училище
- Пълнотекстово взаимодействие на хранителни вещества между резултата от метаболитния генетичен риск и хранителната мастна киселина
- Нощ Глава 9 Резюме и анализ GradeSaver
- Намаляването на хранителния натрий до 1000 mg на ден намалява невроваскуларната трансдукция, без да стимулира
- Намаляването на хранителния натрий до 1000 mg на ден намалява невроваскуларната трансдукция, без да стимулира