Джефри Д. Браунинг
* Катедра по вътрешни болести, Югозападен медицински център на Тексаския университет в Далас, Далас, Тексас
† Катедра по вътрешни болести, Център за изследване на напреднали изображения, Югозападен медицински център на Тексаския университет в Далас, Далас, Тексас
Жани Бакстър
† Катедра по вътрешни болести, Изследователски център за напреднали образи, Югозападен медицински център на Тексаския университет в Далас, Далас, Тексас
Сантхош Сатапати
† Катедра по вътрешни болести, Изследователски център за напреднали образи, Югозападен медицински център на Тексаския университет в Далас, Далас, Тексас
Шон К. Бърджис
* Катедра по вътрешни болести, Югозападен медицински център на Тексаския университет в Далас, Далас, Тексас
† Катедра по вътрешни болести, Изследователски център за напреднали образи, Югозападен медицински център на Тексаския университет в Далас, Далас, Тексас
§ Катедра по фармакология, Югозападен медицински център на Тексаския университет в Далас, Далас, Тексас
Резюме
Основните субстрати за енергийния метаболизъм при хората са глюкозата и мастните киселини (FA), като относителната важност на всеки зависи от наличността на храна (хранени на гладно и глад) (1, 2). В нахранено състояние инсулинът е повишен, преобладава използването на глюкоза и има нетен поток на свободен FA от черния дроб към мастната тъкан. При прехода от хранене към гладно инсулинът пада, което води до повишено освобождаване на свободни FA от мастна тъкан, които се използват от чисти тъкани (например мускули и черен дроб) за производство на енергия или се съхраняват като триглицериди (TG). Скоростта на липолитично освобождаване по време на гладуване и гладуване надхвърля енергийните нужди на цялото тяло по сексуално диморфен начин, като жените и мъжете имат скорост на освобождаване ∼64% и ∼50% по-висока от степента на окисление, съответно (3). Това може да доведе до сексуално диморфен метаболизъм на липидите и глюкозата в мускулите и черния дроб.
Настоящото проучване изследва промените в съдържанието на TG в чиста тъкан по време на 48-часов пост при здрави мъже и жени, използвайки протонно-магнитна резонансна спектроскопия (1 H-MRS) и свързва тези открития с промените в въглехидратния, липидния и енергийния метаболизъм, определени чрез биохимични калориметрични и базирани на MRS измервания на стабилни изотопи. Използвани са множество стабилни изотопни маркери за оценка на отговора на гладно при производството на чернодробна глюкоза, гликогенолиза, глюконеогенеза и метаболитни пътища на цикъла на трикарбоксилната киселина (TCA). Жените и мъжете бяха изследвани поотделно, за да се определи дали известният полово диморфен метаболизъм на гладно (16) се простира до натрупване на липиди в постно тъкан и метаболизма по време на гладуване.
ПРОЕКТИРАНЕ И МЕТОДИ НА ИЗСЛЕДВАНИЯТА
Участници
Здрави хора бяха назначени за обучение в Югозападния медицински център на Тексаския университет. Изследваната популация е съставена от девет жени и девет мъже, чиито характеристики са представени в маса 1 . Всички изследвани жени са били в пременопауза и две са приемали орални контрацептиви. Протоколът и формулярът за съгласие бяха одобрени от UTSW Institutional Review Board и всички участници предоставиха писмено информирано съгласие преди записването.
МАСА 1.
Характеристика на субектите при записване по пол
| Жени (n = 9) | Мъже (n = 9) | P Стойност | |
| Възраст (г) | 24 (23–42) | 21 (21–23) | 0,189 |
| Етническа принадлежност/раса (n) | |||
| Неиспанско бяло | 6 | 7 | 0,599 |
| Неиспанско черно | 2 | 1 | 0,527 |
| Испанци | 1 | 0 | 0,303 |
| Азиатски | 0 | 1 | 0,303 |
| Индекс на телесна маса (kg/m) | 27 (22–32) | 25 (23–27) | 0,427 |
| Глюкоза (mg/dl) | 86 (84–90) | 90 (85–93) | 0,907 |
| Общ холестерол (mg/dl) | 167 (163–184) | 164 (155–194) | 0,489 |
| HDL-c (mg/dl) | 60 (52–64) | 40 (37–49) | 0,021 |
| LDL-c (mg/dl) | 91 (83–109) | 119 (93–135) | 0,343 |
| Триглицериди (mg/dl) | 67 (58–79) | 52 (50–94) | 0,604 |
| AST (U/l) | 19 (17–22) | 23 (19–24) | 0,176 |
| ALT (U/l) | 16 (11–20) | 20 (18–22) | 0,064 |
Стойностите са средни с интерквартилен диапазон в скоби. Данни, анализирани чрез несдвоен t-тест и хи-квадрат тест. ALT, аланин аминотрансфераза; AST, аспартат аминотрансфераза; HDL-c, липопротеинов холестерол с висока плътност; LDL-c, липопротеинов холестерол с ниска плътност. Преобразувания: триглицериди, HDL-c и LDL-c (mg/dl) × 0,02586 = mmol/l; глюкоза (mg/dl) × 0,05551 = mmol/l.
Дизайн
Участниците бяха приети в Центъра за клинични и транслационни изследвания (CTRC), където постиха 48 часа. На ден 0 субектите са яли самостоятелно приготвен обяд в 12:00 и са били допуснати до CTRC в 16:00. Субектите останаха на гладно от момента на приемане на ден 0 до 12:00 на ден 2. Между 08:30 и 09:00 (ден 1 и 2) всички субекти бяха подложени на измерване на дихателния коефициент с помощта на индиректен калориметър Delta Trak II (Sensormedics, Йорба Линда, Калифорния). Чернодробното и интрамиоцелуларното съдържание на TG бяха измерени при постъпване и в 12:00 на ден 1 и 2. Подгрупа от участници (жени = 6, мъже = 7) бяха подложени на допълнителни проучвания, използвайки стабилни изотопни маркери. Между 22:00 и 09:00 (ден 0–1), субектите са получили два индикатора перорално: [U-13 C] пропионат (~ 1200 mg) в 08:30 и разделени дози от 70% [2 H] вода (5 g/kg телесна вода, изчислено като 60% от телесното тегло при мъжете и 50% от телесното тегло при жените) в 22:00, 02:00 и 06:00. На субектите е било позволено да пият 0,5% [2 H] вода ad libitum през останалата част от гладуването. След това на субектите се дава 2,25 mg/kg болус от [3,4-13 С] глюкоза интравенозно, последвано от 2-часова инфузия (0,0225 mg/kg/min). В края на инфузионния период се извършва вземане на кръв от 50 ml. Тези процедури бяха повторени на 2-ия ден от гладуването, с изключение на зареждането през нощта със 70% [2Н] вода.
Диетичен прием на макроелементи преди гладуване
Диетичните записи са събрани за 3 дни преди проучването и оценени от диетолога на CTRC. Диетите се състоят от 48% (обхват, 43-50%) въглехидрати, 38% (обхват, 37-40%) мазнини и 15% (обхват, 14-17%) протеини. Диетичният състав на макроелементите е сравним между половете; дневният енергиен прием обаче е значително по-голям при мъжете в сравнение с жените (2 825 [диапазон, 2 654–3 140] спрямо 1,563 [1,424–2 100] kcal/ден; P = 0,010).
Изотопи и други материали
Седемдесет процента [2 H] вода и 99% [U-13 C] пропионат (натриева сол) са получени от Cambridge Isotopes (Andover, MA). Изследвана стерилност и пироген [3,4-13 С] глюкоза е получена от Omicron Biochemicals, Inc. (South Bend, IN). Други често срещани реактиви са закупени от Sigma (Сейнт Луис, Мисури).
Кръвни проби
На всеки 4 часа от всеки субект се взема 3 ml кръв. Кръв се събира в нехепаринизирани, съдържащи EDTA епруветки и веднага се центрофугира, за да се изолира плазмата. Пробите незабавно бяха замразени и поддържани при -80 ° C, след което бяха размразени веднъж и анализирани. Концентрациите на плазмена глюкоза, холестерол, TG и липопротеин с висока плътност (HDL-c) бяха определени с помощта на спектрофометричен анализатор Vitros 250 (Ortho-Clinical Diagnostics, Rochester, NY). Използвани са ензимно-свързани имуносорбентни тестове за измерване на плазмените концентрации на инсулин, лептин и адипонектин (Millipore, Billerica, MA), както и на концентрациите на без плазма мастни киселини (FA) (Wako Chemicals USA, Richmond, VA). Плазмените кетонни тела се определят с помощта на търговски комплект (Wako Chemicals, Richmond, VA). Други химикали се извършват от външна лаборатория (Quest Diagnostics, Madison, NJ).
Измерване на чернодробната глюкоза и енергийния метаболизъм
Плазмата се екстрахира с хлорна киселина и глюкозата се пречиства, както е описано по-рано (17, 18). Пречистената плазмена глюкоза се превръща в 1,2-изопропилиден глюкофураноза (моноацетонова глюкоза) преди 2 H и 13 C NMR анализ, както е описано по-горе (17–19). Пробите бяха анализирани на 14,1 Tesla Varian Inova спектрометър (Varian Instruments, Palo Alto, CA), оборудван с 3 mm широколентова сонда, настроена на 92 MHz за 2 H спектри или 150 MHz за 13 C спектри. Резонансните зони бяха определени с помощта на ACD/Labs 12.0 (Advanced Chemistry Development, Inc., Торонто, Онтарио, Канада).
Относителното обогатяване на деутерий в глюкоза H2, H5 и H6s беше оценено чрез 2 H-NMR и тези стойности бяха използвани за определяне на фракционния принос на глюконеогенезата и гликогенолизата към ендогенното производство на глюкоза, както е описано по-рано (17). Пътищата, пресичащи TCA цикъла, бяха оценени чрез 13 C-NMR анализ на глюкозни С2 изотопомери, образувани в резултат на метаболизма на [U-13 C] пропионат (20). Предположенията относно този модел са докладвани по-рано (21). Ендогенното производство на глюкоза се измерва чрез разреждане на [3,4-13 С] глюкоза, както е описано по-рано (22). Фракционната гликогенолиза и глюконеогенезата, измерени чрез 2 H-NMR, се нормализират с пируват карбоксилаза (PC)/фосфоенолпируват карбоксикиназа (PEPCK), циклиране на пируват и глюконеогенеза спрямо потока от TCA цикъл, измерен чрез 13 C-NMR и скорост на ендогенно производство на глюкоза/kg/min) се използва за изчисляване на абсолютните потоци през всеки от тези пътища (23).
Измерване на чернодробна и вътремиоцелуларна TG
Статистически анализ
Чернодробна TCA циклична активност с гладуване
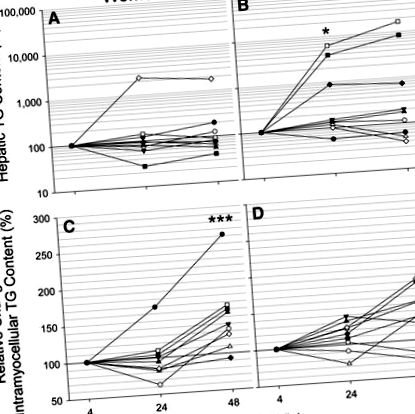
За да определим ефекта от краткосрочното гладуване върху окисляването на крайния субстрат в черния дроб, ние оценихме активността на чернодробния TCA цикъл чрез 2 H и 13 C изотопомерен анализ на глюкозата (28). За разлика от подчертаната кетоза на гладно и въпреки увеличаването на наличността на FA, оборотът на TCA цикъл намалява по време на гладуване (P = 0,021) (Фиг. 3A, D). Освен това не е имало разлика в активността на TCA цикъла между половете по всяко време по време на гладуване, дори когато са взети предвид разликите в чистата телесна маса.
ДИСКУСИЯ
Констатациите от настоящото проучване напомнят на разликите в метаболизма на гладно между мъжки мишки C57BL/6J и SJL/J, съобщени преди това от Guan et al. (6). Подобно на жените, SJL/J мишките са били устойчиви на повишено чернодробно TG на гладно. Тази устойчивост се дължи на засилено поемане и окисляване на свободен FA от скелетни мускули по време на гладуване, щадейки черния дроб от FA претоварване. В съответствие с подобреното поемане и съхранение на FA от скелетните мускули, жените демонстрират значително увеличение на вътремиоцелуларното съдържание на TG с гладуване, което не се наблюдава при мъжете (фиг. 3). Доказано е, че транспортерът на мастни киселини (FAT/CD36) и съдържанието на белтъчно-окислителни ензими е по-високо в скелетните мускули на жените (29, 30). По същия начин Mittendorfer et al. (31) са показали значително по-голямо усвояване и окисление на FA без чиста тъкан при нетренирани жени по време на липолиза, предизвикана от упражнения. Както при SJL/J мишките, липсата на увеличаване на чернодробното съдържание на TG с гладуване при жените може да се обясни отчасти с по-голям капацитет за поемане и обработка на циркулиращата FA от скелетните мускули.
Глюконеогенният поток се увеличава чрез чернодробно липидно окисление (14, 15) чрез производството на глюконеогенни кофактори (т.е. ATP, NADH) и алостерично активиране на PC от ацетил-КоА (45, 46). Въпреки това, инициирането на глюконеогенен поток чрез окислителния метаболизъм изглежда се прилага стриктно за окисляването на TCA цикъл, а не за β-окислението само по себе си (13). Въпреки повишеното β-окисление и масивна кетоза по време на гладуване, потискането на активността на TCA цикъла (фиг. 3D) е присъствано от спад в потока на PC-PEPCK (фиг. 3А и и 3С). 3С). Само едновременното намаляване на циклирането на пируват предотвратява спада в глюконеогенезата. Циклирането на пируват има принос от ябълчния ензим и/или пируват киназата (21). И двете са важни за черния дроб, но активността на ябълчния ензим не реагира на хранителното състояние (47), докато активността на пируват киназата се потиска 4 пъти по време на гладуване (48). Независимо от това, цикличното движение на субстрата осигурява важна форма на метаболитен контрол при бързо променящи се условия на околната среда (49). В този случай намаленото циклиране на чернодробния пируват при гладуващи хора може да поддържа метаболитна буферна система, за да осигури достатъчно наличност на PEP и следователно глюконеогенен потенциал, независимо от хранителното състояние.
В заключение, съдържанието на TG в чиста тъкан се е увеличило по сексуално диморфен начин с краткотрайно гладуване. Устойчивостта на жените към повишено на гладно съдържание на чернодробно TG може да бъде свързано с притъпеното индуциране на безплазмен FA по време на продължително гладуване и повишена склонност към поемане и съхранение на плазмени FA от скелетните мускули. Нашите открития могат да показват по-голяма податливост на мъжете към патологично натрупване на чернодробни TG, осигурявайки потенциално обяснение за по-голямото разпространение на чернодробната стеатоза сред мъжете (35). По същия начин тези открития могат да помогнат да се обяснят разликите в неоксидативния метаболизъм на FA (3) при жените и мъжете. За разлика от това не се наблюдават различия в пола в чернодробната и общата глюкоза или енергийния метаболизъм. Това откритие предполага, че основните разлики между половете в метаболизма на чернодробната FA са на нивото на реестерификация и/или износ на липопротеини. Краткосрочното гладуване не води до повишени нива на глюконеогенеза и общото производство на ендогенна глюкоза намалява поради намаляващата гликогенолиза по време на гладуване. Намаленият поток от TCA цикъл по време на кетоза на гладно изглежда ограничава PC-PEPCK потока, но глюконеогенезата е спестена от намалено циклиране на пируват, потенциално важна метаболитна контролна точка за глюконеогенезата.
Благодарности
Авторите благодарят на Соня Риос, Карол Парцел и Джанет Джероу от Advanced Imaging Research Center в UT Southwestern, които бяха критичен помощен персонал при провеждането на това проучване и на Джей Д. Хортън за критичен преглед на ръкописа.
- Ефектите от консумацията на тъмен шоколад върху липидния профил, кръвната захар на гладно, чернодробните ензими,
- Кетогенната диета за здраве Ефектът на кетогенната диета върху метаболизма на кортизола
- Кодът за затлъстяването Може на гладно да нулира вашия метаболизъм Джейн Лангил
- Характеристиките на нарушената глюкоза на гладно, свързана със затлъстяване и дислипидемия при a
- РЪКОВОДСТВОТО ЗА ДИАБЕТИК ЗА ПРЕКРАТЯВАНЕ НА ПОСТ Диабетни мускули; Фитнес