Ерминия Лембо
Роберта Луполи
2 Катедра по неврология, репродуктивни и одонтостоматологични науки, Университет "Федерико II", 80131 Неапол, Италия; [email protected]
Паола Сичиола
Аналиса Креанца
Евфемия Силвестри
Дженаро Салдаламакия
Брунела Капалдо
Резюме
Пост-бариатричната хипогликемия (PBH) е все по-широко признато дългосрочно усложнение на бариатричната хирургия. Хранителното лечение на PBH включва диета с високо съдържание на фибри и ограничаване на разтворимите и високогликемични индекси въглехидрати; тези мерки обаче не винаги са достатъчни за предотвратяване на хипогликемия. Оценихме ефикасността на сурово царевично нишесте, въглехидрат с нисък гликемичен индекс, характеризиращ се с бавна чревна деградация и абсорбция, в допълнение към диета с високо съдържание на фибри, за лечение на PBH. Ние съобщаваме за случаите на две млади жени, страдащи от тежка хипогликемия след хранене и на гладно след стомашен байпас на Roux-en-Y (RYGB). Пациентите са подложени на непрекъснат мониторинг на глюкозата (CGM) преди и 12–16 седмици след прилагането на сурово царевично нишесте (съответно 1,25 g/kg телесно тегло и 1,8 g/kg телесно тегло) в допълнение към диета с високо съдържание на фибри. И при двамата пациенти CGM показва по-стабилни нива на глюкоза по време на мониторинга, забележително намаляване на времето, прекарано в хипогликемия (Ключови думи: постбариатрична хипогликемия, царевично нишесте, стомашен байпас, хранене
1. Въведение
Пост-бариатричната хипогликемия (PBH) е все по-широко признато усложнение на бариатричната хирургия, характеризиращо се с ниски нива на кръвната захар, типично настъпващи 1–3 часа след хранене със свързаните с тях вегетативни и неврогликопенични симптоми, които се разрешават след поглъщане на глюкоза [1].
Реалното разпространение на PBH е неизвестно и варира от 1 до
30% според дефиницията и методите за диагностика; т.е. данни за хоспитализация или откриване на характерни симптоми чрез специфични въпросници [2,3,4,5]. Съществуват и редица недиагностицирани случаи поради непознаване на хипогликемия или неадекватност на диагностичните инструменти [1]. Интересното е, че използвайки непрекъснат мониторинг на глюкозата (CGM) в продължение на пет дни, Kefurt et al. показа, че 75% от пациентите, подложени на стомашен байпас на Roux-en-Y (RYGB), са постигнали нива на глюкоза под 3,05 mmol/L [6]. Освен риска от хипогликемия, постбариатричните пациенти имат висока вариабилност на глюкозата с постпрандиални гликемични пикове, последвани от глюкозен надир [7,8], но някои пациенти изпитват хипогликемия не само в постпрандиалния период, но и на гладно или по време на нощта [6]. В случаите, когато хипогликемията няма ясен постпрандиален модел, трябва да се изследват други потенциални причини за хипогликемия, като автономна секреция на инсулин от инсулином [9,10].
Лечението на PBH се основава на увеличената консумация на диетични фибри за забавяне на усвояването на въглехидрати (CHO) и ограничаване на разтворимите и високогликемични индекси въглехидрати. Въпреки това, тези диетични мерки често дават само умерени ползи при пациенти с тежки симптоми, като по този начин се налага добавяне на акарбоза или, в крайна сметка, лекарства, инхибиращи секрецията на инсулин [11,12].
Неварено царевично нишесте е въглехидрат с нисък гликемичен индекс, характеризиращ се с бавна деградация и абсорбция на червата. За тези характеристики той е използван при лечението на състояния, свързани с висок риск от хипогликемия, включително заболявания на съхранението на гликоген, диабет тип 1 и инсулинов автоимунен синдром (болест на Hirata) [13,14,15]. По този начин царевичното нишесте може да бъде полезно за стабилизиране на кръвната глюкоза и предотвратяване на хипогликемия също при пациенти с PBH; въпреки неговите потенциални ползи, до момента клиничната ефикасност на царевичното нишесте при пациенти с PBH все още не е оценена. Представяме двама пациенти, страдащи от тежка хипогликемия след RYGB, при които прилагането на царевично нишесте, свързано с богата на фибри диета с ниско съдържание на въглехидрати, стабилизира профила на глюкозата и намалява хипогликемичните епизоди.
2. Дело № 1
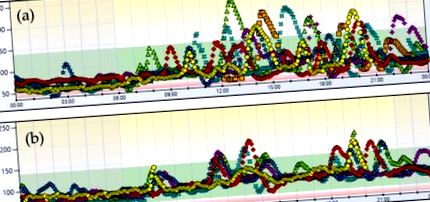
Случай 1. 7-дневен глюкозен профил преди (а) и след (б) хранителна намеса.
маса 1
Време, прекарано при различни нива на глюкоза и индекси на вариабилност на глюкозата, получени чрез непрекъснат мониторинг на глюкозата (CGM) преди и след управление на хранителните вещества.
| Среден IG 1 (mg/dL) | 81 | 92 | +13.6 | 93 | 101 | +8.6 |
| % време> 140 mg/dL | 7 | 4 | -3 | 8 | 7 | -1 |
| % време в диапазона 70–140 mg/dL | 49 | 88 | +39 | 72 | 92 | +20. |
| % време ≥ 55 и 2 (mg/dL) | 32 | 21. | -34,4 | 32 | 23. | -28,1 |
| CV 3 (%) | 39 | 23. | -16 | 34 | 22. | -12 |
| MAGE 4 (mg/dL) | 35.4 | 23.6 | -33,3 | 35.6 | 24.6 | -30,9 |
1 IG = интерстициална глюкоза, 2 SD = стандартно отклонение, 3 CV = коефициент на вариации, 4 MAGE = средна амплитуда на глюкозни екскурзии.
На пациента е предписана нормалнокалорична (1500 kcal) диета с високо съдържание на фибри (33 g), с ниско съдържание на въглехидрати (55), която е разделена на три хранения и три закуски, за да се избегнат пиковете на кръвната захар след хранене и продължителните интервали на гладно (вж. Приложение A ). Мултивитамини и минерални добавки също са предписани въз основа на биохимичен анализ, показващ дефицит на витамин D (19 ng/ml) и желязо (феритин 10 ng/ml).
3. Доклад за случая No2
Вторият пациент е 34-годишна жена с анамнеза за затлъстяване от детството. През годините пациентът често е претърпявал хипокалорични режими и/или фармакологично лечение за затлъстяване, получавайки постоянна загуба на тегло, последвана неумолимо от възстановяване на теглото. На 28-годишна възраст, поради персистирането на тежко затлъстяване (ИТМ 41,2 kg/m 2), пациентът е подложен на RYGB. Един месец след операцията е диагностицирана спонтанна бременност. По време на бременност пациентът загуби
Случай 2. 5-дневен глюкозен профил преди (а) и след (б) хранителна намеса.
4. Дискусия
Бариатричната хирургия (BS) се счита за най-ефективното лечение на затлъстяването, тъй като насърчава трайна загуба на тегло, подобряване/ремисия на свързаните със затлъстяването съпътстващи заболявания, намаляване на смъртността и подобряване на качеството на живот [16,17]. Интересното е, че подобряването на метаболитния статус настъпва много рано след операцията, което предполага, че независимите от теглото фактори могат да играят роля за постигане на метаболитно подобрение [16,18]. Освен тези клинични ползи, се съобщава, че BS има някои рискове и усложнения както рано след операцията, така и в дългосрочен план. PBH е нововъзникващо дългосрочно усложнение на BS, особено на процедури, модифициращи анатомията на GI и, следователно, усвояването на хранителните вещества. Нарастващият брой на докладваните случаи на PBH се дължи отчасти на нарастващия брой бариатрични процедури, извършвани в световен мащаб, но също така и поради въвеждането в клиничната практика на системите за мониторинг на глюкозата, които предоставят моментна информация за нивата на глюкозата над курс на дни или седмици [5]. Трябва да се отбележи, че някои проучвания показват, че CGM открива повече пациенти с клинично значима хипогликемия в сравнение с провокативни тестове [6,19], в основата на полезността на този инструмент при пациенти с PBH.
PBH най-често се свързва с RYGB, но има някои съобщения, които отбелязват, че може да се появи и след гастректомия на ръкава [4,20]. И двамата ни пациенти са имали операция на RYGB и са започнали да изпитват хипогликемични симптоми съответно две и пет години след интервенцията. Техният CGM запис свидетелства за класическия модел на бързо повишаване на концентрацията на глюкоза след хранене, последвано от резки падания под 55 mg/dL. От особено клинично значение е констатацията, че и двамата пациенти са имали хипогликемия през нощта, като по този начин обясняват чувството си на умора при събуждане.
Патофизиологията на PBH все още е предмет на дебати. Постулирани са няколко механизма, които включват: (1) повишени нива на инкретин, а именно GLP-1 и GIP, които причиняват прекомерна секреция на инсулин [21,22]; (2) възстановяване на β-клетъчната чувствителност към GLP-1 [23]; (3) устойчивост на затлъстяването, задвижвана от β-клетъчна хиперфункция, въпреки загубата на тегло [23,24]; (4) повишена чувствителност на тъканите към инсулин вследствие на загуба на тегло [1,25]; и (5) анормален отговор на контрарегулаторните хормони [21,26,27]. По отношение на последния механизъм е важно да се напомни, че GLP-1 има глюкагоностатичен ефект, който може да бъде потенциран при условия на повтарящи се повишени нива на GLP-1. По този начин е изкушаващо да се предположи, че ниските нива на глюкоза на гладно при нашите пациенти могат да бъдат резултат от неподходящо съотношение глюкагон към инсулин, което може да намали производството на ендогенна глюкоза. Друг фактор, който може да допринесе за хипогликемия на гладно, е намаляването на глюконеогенните субстрати. Тази хипотеза се подкрепя от проучване на Lafèrrere et al., Което показва, че по-ниски нива на плазмени аминокиселини са налице при пациенти, подложени на RYGB в сравнение с пациенти, лекувани с диета, въпреки еквивалентно намаляване на телесното тегло [28].
Предложени са няколко терапевтични възможности за лечение на PBH [11,12]. За да се предотврати прекомерно повишаване на кръвната захар след хранене и, следователно, на секрецията на инсулин, първата мярка е приемането на диета с високо съдържание на фибри и нисък гликемичен индекс, разделена на чести малки хранения. Ако пациентите не реагират на хранително лечение, се добавя акарбоза и в крайна сметка лекарства, инхибиращи секрецията на инсулин (верапамил, диазоксид или октреотид), които обаче не са лишени от странични ефекти.
При нашите пациенти решихме да приложим хранителни мерки чрез добавяне на сурово царевично нишесте, източник на бавно освобождаеми въглехидрати, което произвежда ниски пикови нива на глюкоза и поддържа глюкозата в кръвта стабилна по време на гладуване. Комбинирайки царевично нишесте с диета с ниско гликемичен индекс с високо съдържание на фибри, нашите пациенти показват по-стабилен глюкозен профил, по-ниски пикове след хранене и по-ниски хипогликемични епизоди както през деня, така и през нощта. Всичко това доведе до намаляване на вариабилността на глюкозата, клинично значима находка предвид връзката между високата вариабилност на глюкозата и повишения оксидативен стрес [7]. С този подход обаче относителният принос на диетата с ниско гликемичен индекс с високо съдържание на фибри и царевичното нишесте не може да бъде оценен. Всъщност намаляването на нощната хипогликемия се дължи главно на администрирането на царевично нишесте преди лягане, като се има предвид способността му да поддържа нормални нива на глюкоза до 7 часа, както е показано при пациенти със заболявания на съхранението на гликоген [13]. Получените предварителни положителни открития при тези двама пациенти ни насърчават да проверяваме по-систематично ефикасността на този подход при пациенти с PBH.
По-специално, клиничното подобрение е постигнато без никакви съответни странични ефекти. Нашите пациенти не са наблюдавали никакъв дискомфорт след поглъщане на царевично нишесте, като подуване на корема или повишено образуване на газове, вероятно поради относително малката необходима доза царевично нишесте (по-ниска от тази, която обикновено се използва за лечение на заболявания за съхранение на гликоген).
5. Заключения
В заключение, нашият доклад, в рамките на само два случая, показва, че добавянето на царевично нишесте към диетата с ниско гликемичен индекс с високо съдържание на фибри намалява гликемичните колебания и хипогликемичните епизоди при пациенти с PBH. Тази добре поносима, евтина намеса трябва да се следва като следваща стъпка в хранителното управление на PBH, преди да се обмисли фармакологична терапия.
Приложение А
Приложение А.1. Диета с високо съдържание на фибри с нисък гликемичен индекс за хранително управление на пациенти с постбариатрична хипогликемия (PBH)
Енергийното съдържание на диетата беше
1500 kcal/матрица. Диетичният състав беше следният: 48% въглехидрати, 33% липиди, 19% протеини, фибри 33 g, разтворими въглехидрати 40 g (10% общо калории). Гликемичният индекс е 55.
Приложение А.2. Примерен ден
Кафе или чай или билкови чайове или обезмаслено кисело мляко 125 g + корнфлейкс (или овесени ядки или пълнозърнести сухари) 30 g.
Паста (или кафяв ориз) 40 g + бобови растения (леща, боб, нахут) 50 g + пармезан 10 g,
Зеленчук (спанак, тиквички, цвекло, зелен фасул, домат, тиква, маруля) 150 г,
Пресни плодове (ябълка, круша, праскова, кайсия, портокал, киви) 150 g.
Зеленчуци (спанак, тиквички, цвекло, зелен фасул, домат, тиква, маруля) 150 г,
Пълномозъчен хляб 80 гр.
3 закуски (в средата на деня, в средата на следобеда, преди лягане)
Пресни плодове 150–200 g,
2 препечен хляб + петънце (или прясно сирене или риба тон) 30 g.
Подправка за деня
Екстра върджин зехтин (30 g).
Принос на автора
E.L. анализира данните и написа първия проект; R.L., P.C. и A.C. се грижи за пациентите, събира клинични данни и CGM данни и анализира резултатите; Е.С. организира управлението на диетата; G.S направи преглед на клиничното и хранително управление; Пр.н.е. замислил протокола и подготвил окончателната версия на ръкописа.
Финансиране
Не е получено финансиране за тази работа.