Джей Дже Као
1 USDA ARS Grand Forks Изследователски център за човешко хранене 2420 2nd Ave N Grand Forks, ND 58202-9034, САЩ
Резюме
Затлъстяването, дефинирано като индекс на телесна маса ≥ 30 kg/m 2, е състояние, при което излишните телесни мазнини се натрупват до степен, която неблагоприятно засяга здравето [1]. Степента на затлъстяване се е удвоила от 1980 г. насам [2] и към 2007 г. 33% от мъжете и 35% от жените в САЩ са със затлъстяване [3]. Затлъстяването е положително свързано с много хронични разстройства като хипертония, дислипидемия, захарен диабет тип 2, коронарна болест на сърцето и някои видове рак [4-6]. Изчислено е, че преките медицински разходи, свързани със затлъстяването в САЩ, са
100 милиарда долара годишно [7].
Костната маса и сила намаляват по време на зряла възраст, особено при жени след менопаузата [8]. Тези промени могат да завършат с остеопороза, заболяване, характеризиращо се с ниска костна маса и микроархитектурно влошаване, водещо до повишен риск от фрактури на костите. Смята се, че има около 10 милиона американци на възраст над 50 години, които имат остеопороза, докато други 34 милиона души са изложени на риск от развитие на болестта [9]. През 2001 г. само на остеопорозата се падат около 17 милиарда долара преки годишни разходи за здравеопазване.
Няколко доказателства сочат, че затлъстяването и костният метаболизъм са взаимосвързани. Първо, както остеобластите (клетки, образуващи кости), така и адипоцитите (клетките, съхраняващи енергия) са получени от обща мезенхимна стволова клетка [10] и агенти, инхибиращи стимулиращата адипогенезата диференциация на остеобластите [11-13] и обратно, тези, които инхибират остеобластогенезата, повишават адипогенезата [14] ]. Второ, намалената остеобластогенеза на костния мозък със стареенето обикновено се придружава от повишена адипогенеза на костния мозък [15,16]. Трето, хроничната употреба на стероиден хормон, като глюкокортикоид, води до затлъстяване, придружено от бърза костна загуба [17,18]. На четвърто място, както затлъстяването, така и остеопорозата са свързани с повишен оксидативен стрес и повишено производство на провъзпалителни цитокини [19,20]. Понастоящем механизмите за въздействие на затлъстяването върху костния метаболизъм не са добре дефинирани и ще бъдат във фокуса на този преглед.
Провъзпалителните цитокини са повишени при затлъстяване
Затлъстелите индивиди показват ненормални циркулиращи нива на TNF-α, IL-6, CRP, адипонектин и лептин. Адипонектинът и лептинът, които също медиират хроничното възпаление, са адипокини, произвеждани от мастната тъкан. Лептинът има плейотропни ефекти, които модулират енергийните разходи, апетита и невроендокринните функции. Установено е, че лептинът, който е повишен при затлъстяване, стимулира възпалителните реакции при хората [32,33]. За разлика от това адипонектинът действа като противовъзпалителен цитокин, който потиска TNF-α-индуцираната NF-кВ активация [34]. Установено е, че плазмените концентрации на адипонектин са по-ниски при лица със затлъстяване в сравнение с лица без затлъстяване [35].
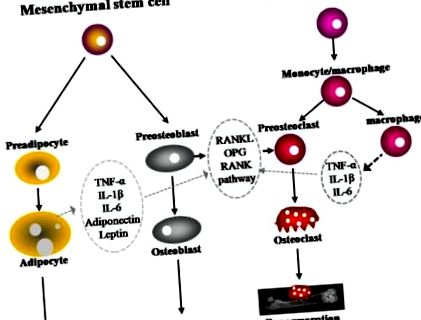
В проучване на напречно сечение на 16 573 лица в третото национално проучване за здравни и хранителни изследвания (NHANES) (1984-1994), логистичният регресионен анализ показа, че коефициентите на шанс за повишен серумен CRP сред лица с индекс на телесна маса (ИТМ) от 25- (Фигура 1). 1). RANKL се експресира върху остеобластната/стромалната клетъчна повърхност и се свързва с неговия рецептор, RANK, на повърхността на хемопоетичните прекурсорни клетки, за да стимулира диференциацията и узряването на остеокластите в присъствието на фактор за стимулиране на колонията на макрофагите (M-CSF). OPG, рецептор за примамка, секретиран от остеобласти, свързва RANKL, за да предотврати активирането на RANK и следователно да предотврати диференциацията и активирането на остеокластите [41,42]. Доказано е, че повишената остеокластична активност и повишената костна резорбция при жени в менопауза са в положителна корелация с повишаването на RANKL [39,43,44].
Костният метаболизъм се регулира от адипоцити, остеобласти и остеокласти. Натрупването на мазнини е тясно свързано с образуването и резорбцията на костите. Остеобластите и адипоцитите са получени от обща мултипотенциална мезенхимна стволова клетка. Остеокластите се диференцират от моноцитни/макрофагични предшественици с произход от хематопоетични стволови клетки. Адипоцитите секретират няколко цитокини като TNF-α, IL-1β, IL-6, адипонектин и лептин, които са способни да модулират остеокластогенезата чрез RANKL/RANK/OPG път.
IL, интерлевкин; OPG, остеопротегерин; RANK, рецепторен активатор на ядрен транскрипционен фактор кВ; RANKL, рецепторен активатор на ядрен транскрипционен фактор κB лиганд; TNF-α, фактор на туморна некроза алфа;
Провъзпалителните цитокини, включително TNF-α, IL-1 и IL-6, са ключови медиатори в процеса на диференциация на остеокластите и костна резорбция. Хроничното възпаление и повишените провъзпалителни цитокини индуцират костна резорбция и костна загуба при пациенти с пародонтоза [45], панкреатит [46], възпалително заболяване на червата [47] и ревматоиден артрит [48]. Също така е установено, че регулираните провъзпалителни цитокини са основни медиатори на остеопения или остеопороза. Ускорената костна загуба при менопаузата е свързана с повишеното производство на възпалителни цитокини, включително TNF-α, IL-1 и IL-6 [20]. Тези провъзпалителни цитокини са способни да стимулират активността на остеокластите чрез регулиране на пътя RANKL/RANK/OPG [49,50]. При мишки без липса на IL-1β и TNF гени [51] или свръхекспресия на разтворим TNF-α рецептор за примамка [52], овариектомията не е причинила костна загуба. Блокирането на действието на IL-1 с IL-1 рецепторен антагонист или сигнализирането на TNF-a с TNF-свързващ протеин, намалено образуване на остеокласти и костна резорбция при мишки с овариектомия [53]. Значителното увеличаване на развитието на остеоартрит при затлъстели хора е друго доказателство, че хроничното възпаление влияе върху метаболизма на костите [30].
Затлъстяването влияе върху костния обмен
Традиционно се смята, че затлъстяването е полезно за костите и по този начин за защита срещу остеопороза [5,54,55]. Механичното натоварване стимулира образуването на кост чрез намаляване на апоптозата и увеличаване на пролиферацията и диференциацията на остеобласти и остеоцити [56] чрез сигналния път Wnt/β-катенин [57,58]. Следователно механичното натоварване, предоставено от телесно тегло, е част от предположението, което е довело до широко разпространеното убеждение, че затлъстяването може да предотврати загубата на костна маса и остеопорозата [59-63].
Неотдавнашните доклади обаче показват, че прекомерната мастна маса може да не предпази хората от остеопороза и всъщност повишената мастна маса се свързва с ниска обща минерална плътност на костите и общо минерално съдържание на костите [64-67]. В проучване на напречно сечение на 60 жени на възраст между 10 и 19 години, процентът на телесните мазнини е свързан с неоптимално постигане на пикова костна маса [68]. Повишеното затлъстяване може също да бъде свързано с повишения риск от фрактура на костите. Например, в проучване на случай-контрол на 100 пациенти с фрактури и 100 възрастово съвпадащи контролни субекти без фрактури на възраст от 3 до 19 години, високото затлъстяване е свързано с повишен риск от фрактури на дисталната част на предмишницата [69]. В друго голямо проучване на напречно сечение на около 13 000 възрастни мъже, жени преди и след менопаузата, процентът на телесните мазнини е бил положителен, свързан с остеопения и фрактури, които не са свързани с гръбначния стълб [66].
В модел на мишки с дефицит на лептин (ob/ob) за затлъстяване мишките тежат два пъти повече от слабите мишки, но имат по-ниска минерална плътност на бедрената кост, дебелина на кората и трабекуларен костен обем [70]. Очевидно положителният ефект от механичното натоварване на увеличеното телесно тегло не може да преодолее вредния ефект на лептиновия дефицит (или евентуално затлъстяване) върху костите при тези мишки. Явните конкурентни ефекти на затлъстяването и механичното натоварване върху костния метаболизъм остават активна област на изследване. Резултатите от изследванията показват, че фактори, различни от телесното тегло, участват в крайния резултат от затлъстяването върху здравето на костите.
Докато изследванията с модел на затлъстели животни са установили негативните ефекти на затлъстяването върху костния метаболизъм, проучванията при хора продължават да бъдат противоречиви. Човешкото затлъстяване е сложен въпрос, който като цяло включва прекомерна консумация на други хранителни вещества, като протеини и минерали, за които е известно, че влияят върху костния метаболизъм [71]. Констатациите за ефектите от затлъстяването върху здравето на костите при хора се основават на статистическа корелация или моделиране, а не на контролирани проучвания. По този начин контролираните проучвания с модел на затлъстели животни са полезни за дисекция на механизмите, върху които прекомерното натрупване на мазнини влияе върху костния метаболизъм.
Използвайки индуциран от диетата модел на затлъстели мишки, ние демонстрирахме, че храненето на мишки с диета с високо съдържание на мазнини (45% енергия като мазнина) в продължение на 14 седмици намалява обема на трабекуларната кост и трабекуларния брой в проксималната част на пищяла въпреки значително увеличение на телесното тегло и формирането на костите маркери в култивиран BMSC [72]. Тези структурни промени са придружени от повишаване на нивата на серумен лептин и TRAP, съотношението на експресия на RANKL/OPG в култивирани остеобласти и броя на TRAP-положителните остеокласти [72,73]. Повишена активност на остеокластите и намалена експресия на IL-10, противовъзпалителен цитокин, от макрофаги, получени от костен мозък, при индуцирани от диета затлъстели мишки също са докладвани от други [74]. Индуцираните с наднормено тегло животни със затлъстяване показват повишено затлъстяване на костния мозък, придружено от намалена КМП в различни скелетни места, регулиране нагоре на активирания от пероксизома пролифератор рецептор γ, катепсин k, IL-6 и TNF-α [75].
Въз основа на наличната литература изглежда, че затлъстяването влияе върху костния метаболизъм чрез няколко механизма. Затлъстяването може да намали образуването на кости (остеобластогенеза), като същевременно увеличава адипогенезата, тъй като адипоцитите и остеобластите се получават от обща мултипотенциална мезенхимна стволова клетка (Фигура (Фигура 1) 1) [76]. Например, механичното натоварване насърчава диференциацията на остеобластите и инхибира адипогенезата чрез регулиране надолу на пероксизомен пролифератор, активиран рецепторен гама (PPARy) или чрез стимулиране на траен бета-катеминов сигнал [12,13]. Активирането на PPARγ от тиазолидиндиони намалява диференциацията на остеобластите, минералната плътност на костите и трабекуларната костна маса, като същевременно увеличава диференциацията на адипоцитите и обема на мастната тъкан на костния мозък [11,77,78].
Затлъстяването може да увеличи костната резорбция чрез регулиране на провъзпалителните цитокини като IL-6 и TNF-α. Тези провъзпалителни цитокини са способни да стимулират активността на остеокластите чрез регулиране на пътя RANKL/RANK/OPG [49,50]. Затлъстяването е значително свързано с дегенеративна и възпалителна мускулно-скелетна система [79]. Адипоцитите на костния мозък също могат директно да регулират остеокластните предшественици, хематопоетичните клетки [80]. Например, когато се експресират с доминираща отрицателна форма на CCAAT-енхансер-свързващи протеини (C/EBP) под адипоцитния мастно-киселинно-свързващ протеин 4 промотор, мишките не могат да образуват адипоцити [81]. Тези мишки нямат бяла мастна тъкан и имат повишена костна минерална плътност [82].
Затлъстяването може да повлияе на костния метаболизъм директно или индиректно чрез получени от адипоцити цитокини като лептин и адипонектин. Затлъстяването е свързано със значително увеличение на серумния лептин [32,33] и намаляване на адипонектина [35]. Действието на лептина върху костите изглежда сложно и са докладвани както положителни [83,84], така и отрицателни [85,86] ефекти. Изглежда, че действието му може да зависи от текущия статус на лептин и начина на действие (централни или периферни ефекти). Свръхпроизводството на лептин, както се наблюдава при модели със затлъстели животни, може да има отрицателни ефекти върху метаболизма на костите [73]. Повишено ниво на серумен лептин е установено като отрицателен регулатор на костната маса при модел на мишка [85]. Адипонектинът е друг цитокин, секретиран от адипоцитите и има противовъзпалителен ефект [34]. В животински модел се съобщава, че адипонектинът инхибира остеокластогенезата, намалява костната резорбция и увеличава костната маса [87]. Затлъстелите лица имат ниски серумни концентрации на адипонектин в сравнение с тези нормални пациенти [35]. Повишената секреция на лептин (и/или намаленото производство на адипонектин) от адипоцитите може също да допринесе за натрупване на макрофаги чрез симулиране на транспортиране на макрофаги до мастната тъкан [88] и насърчаване на адхезията на макрофагите съответно към ендотелните клетки [89].
И накрая, съобщено е, че диета с високо съдържание на мазнини, често причина за затлъстяване, пречи на абсорбцията на калций в червата. Свободните мастни киселини могат да образуват неразтворими неразтворими калциеви сапуни и следователно допринасят за ниска абсорбция на калций [90-92].
Повишеното телесно тегло, свързано със затлъстяването, може да противодейства на вредните ефекти на затлъстяването върху костния метаболизъм. Добре установено е, че телесното тегло или индексът на телесна маса (ИТМ) е в положителна корелация с костната минерална плътност или костната маса [59,93] и ниското телесно тегло или ИТМ е рисков фактор за ниска костна маса и повишена костна загуба при хората [ 60]. Проучванията обаче показват, че положителните ефекти от телесното тегло не могат напълно да компенсират вредните ефекти на затлъстяването върху костите, поне при модели със затлъстели животни.
Заключения
Натрупващите се данни показват, че затлъстяването е вредно за здравето на костите, въпреки потенциалните положителни ефекти от механичното натоварване, причинено от повишено телесно тегло със затлъстяване върху костите. Намалената костна маса при затлъстяване може да се дължи на повишена адипогенеза на костния мозък за сметка на остеобластогенезата и/или повишена остеокластогенеза поради регулирано производство на провъзпалителни цитокини и/или прекомерна секреция на лептин, или намалено производство на адипонектин, и/или намалено абсорбция на калций, свързана с висок прием на мазнини. Разбирането на връзката между затлъстяването и костния метаболизъм може да помогне за идентифицирането на нови молекулни цели, които могат да увеличат остеобластогенезата, като същевременно инхибират адипогенезата и/или намаляват остеокластогенезата. В крайна сметка това знание може да ни накара да разработим нови терапевтични интервенции за предотвратяване на затлъстяване и остеопороза.
Списък на съкращенията
CRP: С-реактивен протеин; IL: интерлевкин; OPG: остеопротегерин; РАНГ: рецепторен активатор на ядрен транскрипционен фактор кВ; RANKL: рецепторен активатор на ядрен транскрипционен фактор κB лиганд; TNF-α: фактор на туморна некроза алфа; ТРАП: устойчива на тартрат киселинна фосфатаза; ИТМ: индекс на телесна маса;
Конфликт на интереси
Авторите заявяват, че нямат конкуриращи се интереси.
Информация за автора
Д-р Као получи докторска степен по хранене от Университета на Флорида, Гейнсвил, Флорида, САЩ. Работил е като постдокторант в областта на минералното хранене в Департамента по наука за храните и човешкото хранене към Университета на Флорида и по костна биология към Медицинския департамент към Калифорнийския университет в Сан Франциско. Д-р Cao е публикувал повече от 30 статии в областта на храненето и костната биология. Той е представял своите изследвания на много национални и международни конференции. В момента той е изследовател диетолог в USDA ARS Grand Forks Human Nutrition Research Center, където провежда изследвания, фокусиращи се върху хранителната и физическата активност на костния метаболизъм, използвайки модели със затлъстели животни. Д-р Cao изследва също ефектите на диетичния протеин и киселинно-алкалния баланс върху абсорбцията, задържането на калций и маркерите на костния метаболизъм при хора.
- Упражнението помага да се противодейства на лошите ефекти от затлъстяването
- Дивергентни ефекти на затлъстяването върху тежестта върху тежестта спрямо изпитването на упражнения без тежести през
- Оформяне на затлъстяването като болест Косвени ефекти на убежденията за афект и контролируемост върху пристрастията към теглото
- FSH антитяло предотвратява затлъстяването и загубата на кост Ендокринология
- Ефекти на изолираното затлъстяване върху систолната и диастоличната функция на лявата камера Сърце