Кара Л. Кливер
отдел по алергия и имунология, Катедра по педиатрия, Медицински център за детска болница в Синсинати, Синсинати, Охайо
Карина Вентър
отдел по алергия и имунология, Катедра по педиатрия, Медицински център за детска болница в Синсинати, Синсинати, Охайо
Алисън М. Касин
отдел по алергия и имунология, Катедра по педиатрия, Медицински център за детска болница в Синсинати, Синсинати, Охайо
J. Пабло Абония
отдел по алергия и имунология, Катедра по педиатрия, Медицински център за детска болница в Синсинати, Синсинати, Охайо
Seema S. Aceves
b Катедра по алергия и имунология, Катедра по педиатрия и медицина, Калифорнийски университет, Детска болница в Сан Диего и Ради, Сан Диего, Калифорния
Питър А. Бонис
c Отдел по гастроентерология, Медицински център Tufts, Бостън, Масачузетс
Евън С. Делон
d Отдел по гастроентерология и хепатология, Медицински факултет на Университета на Северна Каролина, Chapel Hill, Северна Каролина
Гари У. Фолк
Отделение по гастроентерология, болница към Университета на Пенсилвания, Университет на Пенсилвания, Медицинско училище Perelman, Филаделфия, Пенсилвания
Глен Т. Фурута
f Катедра по педиатрия, Медицински факултет на Университета в Колорадо, Аврора, Колорадо
Nirmala Gonsalves
g Отдел по гастроентерология и хепатология, Медицински факултет на Файнберг, Северозападен университет, Чикаго, Илинойс
Сандип К. Гупта
h Секция по детска гастроентерология, хепатология и хранене, Медицинско училище в Университета в Индиана, Болница за деца в Райли, Индианаполис, Индиана
Икуо Хирано
g Отдел по гастроентерология и хепатология, Медицински факултет на Файнберг, Северозападен университет, Чикаго, Илинойс
Амир Кагавала
i Отдел по гастроентерология, хепатология и хранене, Ан и Робърт Х. Лури Детска болница в Чикаго, Чикаго, Илинойс
Джон Люнг
c Отдел по гастроентерология, Медицински център Tufts, Бостън, Масачузетс
Винсент А. Мукада
j Отдел по гастроентерология, хепатология и хранене, Катедра по педиатрия, Медицински център за детска болница в Синсинати, Синсинати, Охайо
Джонатан М. Спергел
k Отдел по алергия и имунология, Детска болница във Филаделфия, Университет на Пенсилвания, Медицинско училище Perelman, Филаделфия, Пенсилвания
Марк Е. Ротенберг
отдел по алергия и имунология, Катедра по педиатрия, Медицински център за детска болница в Синсинати, Синсинати, Охайо
Резюме
Еозинофилният езофагит (EoE), хранително антиген-медиирано заболяване, се лекува ефективно с диетично елиминиране на шест храни, често свързани с хранителни алергии (мляко, пшеница, яйца, соя, дървесни ядки/фъстъци и риба/черупчести). Тъй като пшеницата споделя хомоложни протеини (включително глутен) с ечемик и ръж и може също да бъде обработена с тези зърна, някои клиницисти предполагат, че ечемикът и ръжта също могат да предизвикат EoE в резултат на кръстосана реакция и/или кръстосано замърсяване с пшеница. В настоящото становище ние обсъждаме теоретичните рискове от кръстосана реактивност и кръстосано замърсяване между протеини от пшеница, ечемик и ръж (включително глутен), оценяваме общите практики в центровете за лечение на EoE и предоставяме препоръки за диетично лечение и бъдещи проучвания на EoE.
Еозинофилният езофагит (EoE) е имуно-медиирано клиникопатологично заболяване на хранопровода, което се проявява като повръщане, затруднения при храненето и въздействие върху храната, които варират в зависимост от възрастта на пациента. Хистологично EoE се характеризира с езофагеална еозинофилия, която не реагира на терапията с инхибитор на протонната помпа. 1 Поредица от проучвания предполагат, че в основата на EoE стои алергична сенсибилизация към храна или аероалергени. 2 Диетите за елиминиране на храна се оказаха ефективни за постигане както на клинична, така и на хистологична ремисия при EoE 3-10, като предоставят доказателства, че EoE е поне отчасти медиирана от хранителни антигени. 11 В ретроспективно проучване на деца с EoE, Kagalwalla et al. установи, че емпиричното елиминиране на шест храни, често свързани с хранителни алергии (краве мляко, пшеница, соя, яйца, ядки и риба) значително намалява езофагеалната еозинофилия при 74% от пациентите. 4 Диетичното елиминиране на едни и същи храни в последващи проспективни и ретроспективни проучвания също доведе до клинични и хистологични ремисии както при възрастни 5, 9, така и при педиатрични 6, 7 пациенти с EoE.
„Класическата“ диета за елиминиране на шест храни (6FED) 4 на Kagalwalla технически елиминира осем семейства храни/храни: мляко, пшеница, соя, яйца, дървесни ядки, фъстъци, риба и черупчести мекотели. От храните в класическия 6FED пшеницата е идентифицирана като най-честият причинител на EoE при възрастни 5 и вторият най-чест спусък при деца 12 в две американски проучвания, използващи повторно въвеждане на храна за идентифициране на хранителни антигени, свързани с EoE. От храните в “6FED-подобна” диета, пшеницата е и вторият най-често срещан антиген, свързан с EoE при възрастни в испанска кохорта. 8 Като цяло реинтродукцията на пшеницата активира отново EoE при 26 - 60% от пациентите в ремисия от диетична терапия. 5, 8, 12 По този начин елиминирането на диетичната пшеница е необходимо за ремисия при значителен брой пациенти с EoE. Все още остава неясно обаче нивата, до които пшеницата (и може би свързаните с пшеница зърна) трябва да се избягва за клинични и хистологични ремисии в EoE.
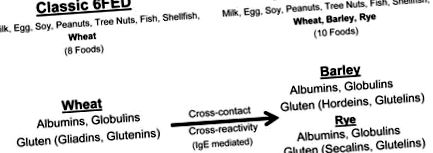
Пшеницата е зърнено зърно, съставено от четири фракции протеини - албумини, глобулини и „глутен“ (глиадини и глутенини) 13 - всяка от които може да предизвика IgE-медииран алергичен отговор. 14 Пшеницата може да се отглежда, събира, съхранява и/или обработва с други зърнени култури, като по този начин тези зърнени култури се замърсяват с фракции от пшеничен протеин. 15, 16 В повечето страни разпоредбите за етикетиране на хранителни алергени не задължават производителите на храни да разкриват рискове от кръстосано замърсяване върху етикетите на храните. 17 По този начин пациентите, посъветвани да елиминират пшеницата на класическия 6FED, могат неволно да консумират следи от замърсители на пшеницата, когато консумират други зърнени култури - особено зърнени култури с висок риск от кръстосан контакт с пшеница като ечемик, ръж и овес. 16.
При липсата на проучвания за количествено определяне на клиничната значимост на поглъщането на пшеница в EoE, някои клиницисти се застъпват за подход, който не допуска риска. Подтикнато от опасения за кръстосано замърсяване с пшеница на ечемик, ръж и овес, 16 Doerfler et al. наскоро предложи диета за елиминиране на EoE да бъде разширена от без пшеница, за да се изключат на практика пшеница, ечемик, ръж и конвенционален овес, за да се намалят „непредвидените“ рискове от замърсяване на пшеница за пациентите. 18 Тъй като пшеницата, ечемикът, ръжта и техните кръстоски са единствените храни, които по своята същност съдържат глутен, тази препоръка ефективно предлага елиминиране на всички зърна, съдържащи глутен в 6FED.
В допълнение към опасенията за кръстосаното замърсяване с пшеница, опасенията за възможна кръстосана реактивност сред сродни зърнени култури (ечемик, ръж и пшеница) също наскоро накараха други клиницисти да изключат всички храни, съдържащи глутен, в емпирични елиминационни диети. 10 Ечемикът и ръжта споделят хомоложни протеини с пшеница, включително „глутеновите“ протеини хордеин (ечемик) и секалин (ръж). 19 Няколко проучвания показват, че пшеницата, ечемикът и ръжта също споделят кръстосано реагиращи протеини 20-22, които могат да бъдат от значение при IgE-медиирано заболяване. Въпреки това, в ранно проучване на кръстосаната реактивност на зърнени антигени, само 4 от 25 пациенти с алергия към пшеница клинично реагират на ечемик или ръж. 21 За разлика от тях, Pourpak et al. открили 55% от педиатричните пациенти с IgE-медиирана свръхчувствителност към погълната пшеница, клинично реагирала на ечемик. 23 Наблюдава се също така силна корелация между специфичните за пшеницата и ечемика серум-специфични IgE, което предполага антигенни кръстосани реакции. 23 Липсват проучвания за кръстосана реактивност на хранителни антигени при пациенти с EoE. Установено е обаче, че честотата на сенсибилизация към зърнени алергени с идентифицируеми кръстосано реагиращи аероалергени е висока (63%) в проучване на възрастни с EoE 24, което предполага потенциал за кръстосана реактивност между погълнатите зърна.
Класическа диета за елиминиране на шест храни (6FED) за диетично управление на EoE, модифицирана, за да се изключат всички зърна, съдържащи глутен Несигурността относно рисковете, породени от кръстосано замърсяване и кръстосана реакция на ечемик и ръж с пшеница, накара някои да разширят класическия без пшеница 6FED, за да изключат пшеницата, ечемика и ръжта.
- Статии от PlantPlate - Диети на растителна основа и хранителни алергии Пшеница, глутен, соя и ядки
- Pacman Frog Diet - Как да храним жаба Pacman (с хранителна таблица)
- Диета за елиминиране на непроста алергия Архив - Форуми за обикновен живот
- Слайдшоу измами с храни, които могат да разрушат вашата диета
- Плюсове и минуси на диета без глутен; Оттегля се страхотно