Център за изследване на фетално програмиране, Университет на Уайоминг, Ларами, Вайоминг, САЩ
Отдел по животновъдство, Университет на Уайоминг, Ларами, Уайоминг, САЩ
Отдел по животновъдство, Университет на Уайоминг, Ларами, Уайоминг, САЩ
Отдел по животновъдство, Университет на Уайоминг, Ларами, Уайоминг, САЩ
Отдел по животновъдство, Университет на Уайоминг, Ларами, Уайоминг, САЩ
Център за изследване на фетално програмиране, Университет на Уайоминг, Ларами, Вайоминг, САЩ
Отдел по животновъдство, Университет на Уайоминг, Ларами, Уайоминг, САЩ
Център за изследване на фетално програмиране, Университет на Уайоминг, Ларами, Вайоминг, САЩ
Отдел по животновъдство, Университет на Уайоминг, Ларами, Уайоминг, САЩ
Център за сърдечно-съдови изследвания и алтернативна медицина, Университет на Уайоминг, Ларами, Вайоминг, САЩ
Център за изследване на фетално програмиране, Университет на Уайоминг, Ларами, Вайоминг, САЩ
Отдел по животновъдство, Университет на Уайоминг, Ларами, Уайоминг, САЩ
Център за сърдечно-съдови изследвания и алтернативна медицина, Университет на Уайоминг, Ларами, Вайоминг, САЩ
Кореспонденция: Университет на Уайоминг, 1000 E. University Avenue, Laramie, WY 82071, САЩ. Имейл: [email protected] Потърсете още статии от този автор
Център за изследване на фетално програмиране, Университет на Уайоминг, Ларами, Вайоминг, САЩ
Отдел по животновъдство, Университет на Уайоминг, Ларами, Уайоминг, САЩ
Отдел по животновъдство, Университет на Уайоминг, Ларами, Уайоминг, САЩ
Отдел по животновъдство, Университет на Уайоминг, Ларами, Уайоминг, САЩ
Отдел по животновъдство, Университет на Уайоминг, Ларами, Уайоминг, САЩ
Център за изследване на фетално програмиране, Университет на Уайоминг, Ларами, Вайоминг, САЩ
Отдел по животновъдство, Университет на Уайоминг, Ларами, Уайоминг, САЩ
Център за изследване на фетално програмиране, Университет на Уайоминг, Ларами, Вайоминг, САЩ
Отдел по животновъдство, Университет на Уайоминг, Ларами, Уайоминг, САЩ
Център за сърдечно-съдови изследвания и алтернативна медицина, Университет на Уайоминг, Ларами, Вайоминг, САЩ
Център за изследване на фетално програмиране, Университет на Уайоминг, Ларами, Вайоминг, САЩ
Отдел по животновъдство, Университет на Уайоминг, Ларами, Уайоминг, САЩ
Център за сърдечно-съдови изследвания и алтернативна медицина, Университет на Уайоминг, Ларами, Вайоминг, САЩ
Кореспонденция: University of Wyoming, 1000 E. University Avenue, Laramie, WY 82071, САЩ. Имейл: [email protected] Потърсете още статии от този автор
РЕЗЮМЕ
СЪКРАЩЕНИЯ
Затлъстяването е експоненциално нарастваща епидемия на общественото здраве и икономическа тежест в световен мащаб (1–3). В момента ∼18–35% от бременните жени в САЩ са със затлъстяване (4, 5). Епидемиологичните проучвания показват, че затлъстяването при майки (MO) по време на бременност проявява ефекти между поколенията чрез програмиране на потомството (F1) до повишен риск от затлъстяване и кардиометаболитни проблеми (6–9), включително инсулинова резистентност, сърдечни заболявания, хипертония и съдова дисфункция (10–14 ). Недохранването и прехранването на майката играят важна роля в програмирането на развитието и функционирането на сърцето на плода (15–18). Няколко проучвания показват, че MO увеличава риска от вродени сърдечни дефекти и уврежда Fl феталната диастолна функция (19–23). Освен това се съобщава за нарушена миокардна функция, увеличена дебелина на преградата и доплер-скорост на долната лява камера (LV) при плодове на човешки майки с MO (24). В допълнение, MO е показал, че програмира сърдечната структура F1 (25–27).
Въпреки обширната характеристика на този модел, молекулярните и клетъчните механизми, причиняващи нарушена сърдечна функция при плодовете на майките с МО, остават неясни. За да коригираме този дефицит, ние изследвахме въздействието на MO върху съкратителната функция на феталния кардиомиоцит и основните молекулни механизми. Оценихме контрактилитета и вътреклетъчното боравене с Ca 2+ в изолирани кардиомиоцити с LV от фетуси на овце с нормално тегло (контролна група) и MO овце (групи със затлъстяване). Клетъчните и молекулярните механизми, които потенциално управляват контрактилната функция, бяха изследвани с фокус върху вътреклетъчното боравене с Ca 2+ и контрактилните и регулаторни протеини в саркомера.
МАТЕРИАЛИ И МЕТОДИ
Експериментални животни
Изолиране на фетални кардиомиоцити на овце
Извънклетъчно възстановяване на Ca 2+
Изолираните кардиомиоцити се гранулират чрез центрофугиране при 500 rpm за 5 минути. Супернатантата се отстранява и пелетите се суспендират отново в разтвор на тирод без Ca 2+. Извънклетъчното ниво на Са 2+ постепенно се повишава до 3, 9, 21, 45, 93, 189, 381 и 616 цМ до крайна концентрация от 1 тМ с 10-минутен интервал между всяка концентрация. След това кардиомиоцитите бяха оставени при 1 mM при стайна температура за половин час, след което бяха готови за механична и вътреклетъчна оценка на Ca 2+.
Съкращаване/удължаване на феталните кардиомиоцити
Пръчковидни фетални кардиомиоцити на овце с ясни ръбове бяха избрани за измерване на механични свойства със система SoftEdge Myocam (IonOptix, Milton, MA, USA). Софтуерът Ion Wizard е използван за улавяне на промените в дължината на кардиомиоцитите по време на съкращаване и удължаване чрез използване на модулите за придобиване SoftEdge и SarcLen за записване на дължината на клетката и саркомера. Кардиомиоцитите бяха поставени в система за суперфузионна камера C-Stim Cell MicroControls (IonOptix) на сцената на обърнат микроскоп (Olympus, Токио, Япония) и бяха суперфузирани с контрактилен буфер, съдържащ (в mM) NaCl 131, KCl4, MgCl21, глюкоза 10, HEPES 10 и CaCl2 2 (рН 7,4). Кардиомиоцитите бяха стимулирани на място с остър полеви стимулатор на MyoPacer (Ion-Optix) за електрическо ускоряване на клетъчните контракции. Настройката на честотата на MyoPacer за измерване на контрактилитета на кардиомиоцитите е 0,5 Hz, продължителността на стимулационния импулс е 3 ms и напрежението е 40 V. Измерваният кардиомиоцит се показва на монитора на компютъра чрез цифрова камера за заснемане на MyoCam-S (IonOptix) и са записани амплитудата и скоростите на скъсяване и удължаване.
Клетъчното съкращаване и удължаване се оценяват, като се използват следните индекси: пиково скъсяване (PS), най-късата дължина на клетката/саркомера на кардиомиоцитите, контрактирани при електрическа стимулация, което е показателно за пиковата вентрикуларна контрактилитет; време до PS (TPS), продължителността на скъсяване на миоцитите, което е показателно за продължителността на контракцията; време до 90% удължаване (TR90), времето за достигане на 90% подмладяване, което представлява продължителност на релаксация на кардиомиоцитите (използвано е 90%, а не 100% подмладяване, за да се избегне шумният сигнал, наличен при свиване на изходното ниво); и максимални скорости на скъсяване (+ dl/dt) и удължаване (-dl/dt), максимален наклон (производно) на фазите на скъсяване и удължаване, които са индикатори за максимални скорости на камерно налягане нарастване и намаляване (56, 57).
Вътреклетъчно боравене с Ca 2+
Отделна кохорта от кардиомиоцити беше заредена с Fura-2/AM (0.5 цМ) в продължение на 15 минути и интензивността на флуоресценцията беше записана със система за фотоумножител с двойно възбуждане на флуоресценция (IonOptix). Кардиомиоцитите се поставят върху инвертиран микроскоп IX-70 (Olympus) и се изобразяват с обектив Fluor × 40. Кардиомиоцитите бяха изложени на светлина, излъчвана от 75-W лампа и преминаха през 360- или 380-nm филтър, като същевременно бяха стимулирани при 0,5 Hz за свиване. Флуоресцентните емисии бяха открити между 480 и 520 nm, а качествената промяна в интензивността на флуоресценцията на Fura-2 (FFI) беше изведена от съотношението FFI на интензивността на флуоресценцията при 2 дължини на вълната (360/380 nm). Времето на затихване на флуоресценцията (единична експоненциална скорост на разпадане) беше измерено като индикатор за вътреклетъчната скорост на изчистване на Ca 2+ (57, 58).
Оцветяване на аглутинин от пшеничен зародиш
LV участъци (5 µm) бяха оцветени с FITC-конюгиран аглутинин от пшеничен зародиш (WGA; MilliporeSigma, Burlington, MA, USA), а площите на напречното сечение на кардиомиоцитите бяха изчислени от произволно избрани клетки на цифров микроскоп с ImageJ (v.1.51K ) софтуер [Национални здравни институти (NIH), Bethesda, MD, САЩ; https://imagej.nih.gov/ij/] (59, 60).
Имунофлуоресцентно оцветяване
Парафиновите части на вентрикуларните тъкани (5 µm) бяха депарафинизирани и антигенът беше извлечен в цитратен буфер [90 mM натриев цитрат, 9 mM цитратна киселина и 0,5% Tween 20 (pH 6,0)]. Разрезите на тъканите бяха блокирани в 5% говежди серумен албумин в продължение на 1 час преди инкубация с антитела срещу миозиновата тежка верига (MHC) - и и - (4 µg/ml; Развитие на изследванията Hybridoma Bank в Университета на Айова, Iowa City, IA, САЩ) при 4 ° C през нощта, последвано от инкубация в козе антимише IgG1 Alexa Fluor 555 антитяло (1: 500; Thermo Fisher Scientific) при стайна температура в продължение на 90 минути. Тъканите се визуализират под конфокален микроскоп (Zeiss, Йена, Германия). Средната интензивност на флуоресценция е изчислена върху изображението с цял разрез със софтуера Imagel (NIH) (60, 61).
Western blot анализ
Статистически анализ
За статистически анализ е използван софтуер Prism (GraphPad, La Jolla, CA, USA). Резултатите са изразени като средни стойности ± sem. Статистическата значимост беше определена с несдвоена двустранна т тестов анализ на разликите между 2-те посочени групи: контролна и MO. Значимостта беше зададена на стойности от P
РЕЗУЛТАТИ
MO промени в биометрията на LV на феталното сърце в края на бременността
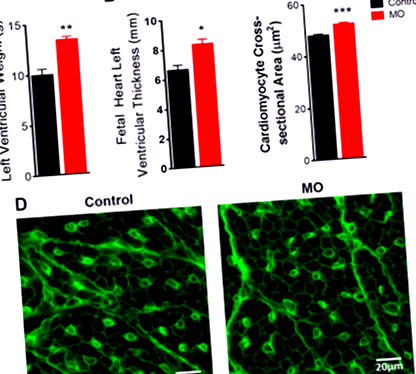
MO повишено тегло и дебелина на свободната стена на плода на плода (Фиг. 1А, Б). За да се определи хипертрофия на клетъчно ниво, беше извършено имунооцветяване на вградени в парафин участъци с WGA оцветяване. Площта на напречното сечение на кардиомиоцитите на ЛН е увеличена при плодовете на майки с МО (Фиг. 1C, D). Тези резултати разкриват, че MO води до сърдечна хипертрофия на плода в края на бременността, което предполага, че сърдечната дисфункция при F1 на затлъстели майки по-късно в живота може да произтича от промени в сърдечната геометрия по време на ранното сърдечно развитие.
MO нарушава контрактилните свойства на феталния кардиомиоцит
За да се определи естеството на промените в клетъчните контрактилни свойства, ние изолирахме феталните кардиомиоцити от контролните и MO групите. MO увеличава дължината на феталните кардиомиоцитни клетки в покой от 67,3 ± 1,3 на 72,7 ± 1,3 µm (Фиг. 2A), с малък ефект върху дължината на саркомера на кардиомиоцитите (допълнителна фигура S1A). Свиваемостта на кардиомиоцитите въз основа на измервания на дължината на клетките показва, че MO намалява PS и Vмаксимум на съкращаване и удължаване (±dL/dt), свързани с удължен TR90 (фиг. 2B – G). Контрактилната динамика, базирана на измервания на дължината на саркомера на MO фетални кардиомиоцити, показва промени, подобни на тези, получени от измерванията на дължината на клетките (допълнителна фигура S1). Тези резултати показват, че MO увеличава дължината на клетките в покой на феталните кардиомиоцити, въпреки че потиска сърдечната контрактилитет, както се вижда от намаляване с 30% на PS. Наблюдава се намален PS, заедно с по-ниска скорост на скъсяване и удължаване (±dL/dt) и удължен TR90. От друга страна, продължителността на съкращаването, указваща времето от дължината на клетката в покой до максималното съкращаване на клетките на феталните кардиомиоцити, не се влияе от MO (Фиг. 2F). Показано е, че продължителността на TPS не е засегната, както според измерванията на клетките, така и на саркомера (допълнителна фигура S1Е.).
MO нарушава вътреклетъчната хомеостаза на Ca 2+ във феталните кардиомиоцити
За да се изследват възможните механизми, отговорни за нарушените съкратителни свойства на феталния кардиомиоцит в отговор на MO, вътреклетъчните нива на Ca 2+ бяха оценени с флуоресцентната техника на Fura-2. MO повишени вътреклетъчни нива на Ca 2+ в покой от 1,31 ± 0,02 до 1,36 ± 0,01. Пиковите съотношения на Ca 2+ се увеличават от 1,34 ± 0,03 на 1,44 ± 0,01. FFI се повиши (ΔFFI) от 0,039 ± 0,002 на 0,080 ± 0,004 (Фиг. 3A-C). Въпреки това, скоростта на вътреклетъчен клирънс на Ca 2+ не се влияе от MO (фиг. 3д). Тези резултати разкриват, че MO води до повишено вътреклетъчно Ca 2+ в покой и по-голямо освобождаване на Ca 2+ в отговор на електрическа стимулация (ΔFFI) във феталните кардиомиоцити, но че скоростта на вътреклетъчно усвояване на Ca 2+ е сходна при MO в сравнение с контролните фетални кардиомиоцити . Тези открития показват, че вътреклетъчният Ca 2+ е претоварен в MO фетални кардиомиоцити, което може да бъде механизъм, водещ до нарушаване на контрактилните свойства на феталните кардиомиоцити.
Промени в протеините, управляващи Ca 2+ във феталните кардиомиоцити на затлъстели майки
Western blot анализ (Фиг. 4A) разкри подобни нива в общия RyR между MO и контролни сърца на плода. Въпреки това, фосфорилирането на RyR2 при Ser 2808 и Ser 2814 беше значително подобрено в MO феталния миокард (Фиг. 4B – F). Наблюдава се повишена експресия на RyR2 свързващ протеин FK 506 свързващ протеин 12.6 (Фиг. 4G). Serca-2 и PLN са 2 основни протеина в помпата за поглъщане на Ca 2+ и промените в тези протеини могат да влошат усвояването на Ca 2+ (63). Експресията на Serca ‐ 2 и фосфорилиран PLN (Ser 16) са непроменени (Фиг. 4H, I, K). Експресията на тиган PLN е увеличена в MO фетален миокард (Фиг. 4J). Тези резултати предполагат, че Ca 2+ изтича от канала за освобождаване на Ca 2+, но тъй като няма промяна в помпата за поемане на Ca 2+, вътреклетъчното ниво на Ca 2+ в MO феталните кардиомиоцити е повишено.
След това изследвахме горните кинази CaMKII и PKA, които фосфорилират Ser 2808 и Ser 2814 на RyR2. MO не повлиява експресията на общия PKA и CaMKII във феталния миокард, но фосфорилирането на двете кинази е повишено в MO феталните сърца (Фиг. 5), което предполага, че MO води до активиране както на PKA, така и на CaMKII, но не и до променена обща експресия на тези 2 кинази.
Промени в контрактилните и регулаторните протеини в MO феталния миокард
За да изследваме ефекта на MO върху контрактилния протеин Myosin и регулаторните протеини troponin и tropomyosin, ние извършихме имунофлуоресцентно оцветяване със специфични антитела: anti-MHC-α и -β. MO намалява интензивността на флуоресценция на MHC-α, но увеличава тази на MHC-β (Фиг. 6A-д). Освен това, резултатите от Western blot потвърждават намалената експресия на MHC-α и повишената експресия на MHC β-белтъци в сърцето на феталния МО (Фиг. 6E – H). Тези резултати предполагат, че MO намалява нивата на високо-ATP хидролиза MHC-α, свързани с бързото потрепване и увеличава нивата на ниско-ATP хидролиза MHC-β, свързани с бавно потрепване. Тези промени показват, че MO забавя сърдечната контракция на плода, в съгласие с нашите открития в единични кардиомиоцити.
След това изследвахме експресията и състоянието на фосфорилиране на регулаторните протеини, тропонинов комплекс и тропомиозин. Western blot анализ (Фиг. 7А) разкрива, че експресията на cTn-T се увеличава с ~ 60%, фосфорилирането на cTn-I се увеличава с ~ 130%, а сърдечният тропомиозин се увеличава със 110% във феталния миокард от групата на MO (Фиг. 7B – F). Не са наблюдавани промени в експресията на cTn-C във феталния миокард (Фиг. 7G). Тези резултати показват, че MO влияе върху състава на регулаторния миофиламентен тропонин-тропомиозинов комплекс.
ДИСКУСИЯ
Друга основна цел на нашето проучване беше да се установи надежден метод за оценка на сърдечно-механичната функция на плода на нивото на отделния фетален кардиомиоцит. Предизвикателството при механичната оценка на единичната фетална кардиомиоцитна функция е способността да се изолират жизнеспособни фетални кардиомиоцити и да се буферират клетките в оптимални условия за реакция на полева електрическа стимулация. Методите за изолиране на кардиомиоцити на фетални овце са установени за повече от 15 години (52) и няколко елегантни проучвания демонстрират ендокринен контрол на клетъчния цикъл и растежа в кардиомиоцитите на фетални овце (94–97). Нашите данни обаче са първите, доколкото ни е известно, за контрактилитета на отделните фетални кардиомиоцити.
ПРИЗНАВАНИЯ
Авторите благодарят на д-р John F. Odhiambo, д-р Adel Ghnenis, д-р Shuyi Wang, д-р Guorong Ruan, д-р Zhilong Chen, Christopher Pankey, Dallas Sturdevant и Ashley Smith (всички от Университета на Уайоминг) за извършване на тъкани събиране и аутопсия на овце; и Pan Chen (Университет в Уайоминг) за помощ при получаването на имунофлуоресцентни микроскопски изображения на LV секции на фетални овце. Авторите посвещават тази работа на покойния Стивън П. Форд, доктор по медицина, съосновател на Центъра за програмиране на феталния университет на Уайоминг. Тази работа беше подкрепена от Националния институт по здравеопазване (NIH), Национален институт по общи медицински науки Грант GMSP20GM103432; Американска сърдечна асоциация, Награда за безвъзмездна помощ за 16BGIA27790136 (на W.G.); американски департамент по земеделие, Национален институт по храните и земеделието, люк проект 1009266 (към РГ); NIH, Eunice Kennedy Shriver Национален институт за детско здраве и човешко развитие Грант 1R01HD07009601A1 (за S.P.F. и P.W.N.). Авторите не декларират конфликт на интереси.
ВНОСКИ НА АВТОРА
Q. Уанг и У. Гоо са проектирали експериментите; В. Уанг и У. Гуо анализираха и интерпретираха данните; Q. Уанг, Чжу, М. Сун и Р. Маймайти извършиха експериментите; S. P. Ford и J. Ren са допринесли за нови реактиви или аналитични инструменти; Р. Уанг и У. Гуо са написали ръкописа; и P. W. Nathanielsz и J. Ren преразгледаха ръкописа.
| fsb2fj201800988r-sup-0001.tifapplication/tif, 187,4 KB | Допълнителен материал 1 |
Моля, обърнете внимание: Издателят не носи отговорност за съдържанието или функционалността на която и да е поддържаща информация, предоставена от авторите. Всички заявки (различни от липсващо съдържание) трябва да бъдат насочени към съответния автор на статията.
- Затлъстяването при майките при овцете уврежда капацитета на дихателната верига на митохондриите на плода на черния дроб - Serafim
- Последици от затлъстяването в началото на бременността върху здравето на майката, плода и новороденото
- Затлъстяването при майки по време на бременността нарушава окисляването на мастните киселини и експресията на SIRT3 в митохондриите
- Затлъстяването при майките при овцете увеличава синтеза на мастни киселини, повишава транспортирането на хранителни вещества и
- Как затлъстяването на майките влияе на рутинния анатомичен ултразвук на плода