Канди Т Веласкес
Катедра по патология, микробиология и имунология, Медицински факултет, Университет на Южна Каролина, Колумбия, SC 29209, САЩ
Reilly T Enos
Катедра по патология, микробиология и имунология, Медицински факултет, Университет на Южна Каролина, Колумбия, SC 29209, САЩ
Джаки Е Бадер
Катедра по патология, микробиология и имунология, Медицински факултет, Университет на Южна Каролина, Колумбия, SC 29209, САЩ
Александър Т Сугианис
Катедра по патология, микробиология и имунология, Медицински факултет, Университет на Южна Каролина, Колумбия, SC 29209, САЩ
Мередит Карсон
Катедра по патология, микробиология и имунология, Медицински факултет, Университет на Южна Каролина, Колумбия, SC 29209, САЩ
Юлия Чацистаму
Катедра по патология, микробиология и имунология, Медицински факултет, Университет на Южна Каролина, Колумбия, SC 29209, САЩ
Джеймс Карсън
Катедра по патология, микробиология и имунология, Медицински факултет, Университет на Южна Каролина, Колумбия, SC 29209, САЩ
Колеж по здравни професии, Университет в Тенеси Център за здравни науки, Мемфис, TN 38163, САЩ
Пракаш S Nagarkatti
Катедра по патология, микробиология и имунология, Медицински факултет, Университет на Южна Каролина, Колумбия, SC 29209, САЩ
Мици Нагаркати
Катедра по патология, микробиология и имунология, Медицински факултет, Университет на Южна Каролина, Колумбия, SC 29209, САЩ
Е Анджела Мърфи
Катедра по патология, микробиология и имунология, Медицински факултет, Университет на Южна Каролина, Колумбия, SC 29209, САЩ, [email protected]
Поддържа се от Националния здравен институт, No. NCI-3R01CA121249-08S1;, NCCIH-K99AT009206 и No. NCI-1R21CA191966 .
Автор-кореспондент: д-р Е Анджела Мърфи, доцент, Катедра по патология, микробиология и имунология, Медицински факултет, Университет на Южна Каролина, 6439 Garners Ferry Rd, Колумбия, SC 29209, САЩ. [email protected]
Телефон: + 1-803-2163414 Факс: + 1-803-2163414
Резюме
ЗАДЕН ПЛАН
Безалкохолната мастна чернодробна болест (NAFLD) се превърна в епидемия, до голяма степен благодарение на нарастването на затлъстяването в световен мащаб. Докато модификациите на начина на живот и фармакотерапиите са били използвани за облекчаване на NAFLD, успешните възможности за лечение са ограничени. Една от основните пречки пред намирането на безопасни и ефективни лекарства за продължителна употреба при NAFLD е бързото започване и прогресиране на заболяването в наличните предклинични модели. Следователно, ние се нуждаем от предклинични модели, които (1) имитират човешката проява на NAFLD и (2) имат по-дълго време за прогресия, за да позволят проектирането на превъзходни лечения.
Да се характеризира модел на продължително хранене с високо съдържание на мазнини (HFD) за изследване на дългосрочната прогресия на NAFLD.
МЕТОДИ
В това проучване използвахме продължително HFD хранене, за да изследваме характеристиките на NAFLD при мишки от мъжки пол C57BL/6. Хранехме мишки с HFD (60% мазнини, 20% протеини и 20% въглехидрати) в продължение на 80 седмици, за да насърчим затлъстяването (Old-HFD група, n = 18). Диета с ниско съдържание на мазнини (LFD) (14% мазнини, 32% протеини и 54% въглехидрати) е била прилагана за същата продължителност на мишки, отговарящи на възрастта (група Old-LFD, n = 15). Допълнителна група мишки се поддържа на LFD (Young-LFD, n = 20) за по-кратка продължителност (6 седмици), за да се направи разлика между възрастово зависими и независими от въздействието ефекти. Черният дроб, дебелото черво, мастната тъкан и изпражненията са събрани за хистологични и молекулярни оценки.
РЕЗУЛТАТИ
Продължителното хранене с HFD доведе до затлъстяване и инсулинова резистентност. Хистологичният анализ в черния дроб на HFD мишки демонстрира стеатоза, клетъчно увреждане, портално и лобуларно възпаление и фиброза. В допълнение, молекулярният анализ за маркери на ендоплазмен стрес на ретикулума установява, че чернодробната тъкан на HFD мишки е увеличила фосфорилираните Jnk и CHOP. И накрая, оценихме чревния микробен състав на Old-LFD и Old-HFD. Забелязахме, че продължителното хранене с HFD при мишки увеличава относителното изобилие на Firmicutes тип. На ниво род наблюдаваме значително увеличение на изобилието на Adercreutzia, Coprococcus, Dorea и Ruminococcus и намалено относително изобилие на Turicibacter и Anaeroplasma при HFD мишки.
ЗАКЛЮЧЕНИЕ
Като цяло тези данни предполагат, че хроничната консумация на HFD при мишки може да имитира патофизиологични и някои микробни събития, наблюдавани при пациенти с NAFLD.
Основен съвет: Тази работа описва как мишките, консумиращи хронична диета с високо съдържание на мазнини, могат да имитират клиничните характеристики на безалкохолната мастна чернодробна болест. Използвахме хистопатологични, метаболитни и молекулярни подходи, за да установим, че продължителното хранене с високо съдържание на мазнини при мишки може да се използва като предклиничен модел за изследване на дългосрочни интервенции, включващи стеатоза, стеатохепатит, фиброза, нарушения на глюкозата, ендоплазмен стрес, и чревна микробна дисбиоза.
ВЪВЕДЕНИЕ
Затлъстяването е добре характеризиран рисков фактор за развитието на NAFLD. Въпреки че е добре известно, че затлъстяването може да бъде предотвратено чрез здравословни хранителни навици и физическа активност [4,5], интервенциите в клинична обстановка са до голяма степен неуспешни, особено в дългосрочен план [6,7]. По този начин, последните изследвания се фокусират върху разбирането на пътищата, движещи патологичните процеси, свързани с индуцирана от затлъстяването NAFLD, за да могат да бъдат идентифицирани терапевтични цели. Животинските модели са от решаващо значение за тази мисия и значително подобриха нашето разбиране за развитието на NAFLD. Въпреки че съществуват множество животински модели на NAFLD, администрирането с високо съдържание на мазнини (HFD) е широко използван модел [8]. Ограничението на този подход обаче е, че приложението на HFD на мишки изглежда не предизвиква значителна прогресия на NAFLD (т.е. смърт на чернодробните клетки, възпаление или фиброза) въпреки възпроизводимото затлъстяване, метаболитния синдром и чернодробната стеатоза [8]. Потенциално обяснение на това явление е, че продължителността на HFD храненията не е достатъчно дълга, за да произведе значителни NASH, дори когато диетичното лечение се прилага в продължение на шест месеца. Следователно, може да е необходима по-голяма продължителност на приложението на HFD, за да се рекапитулира патологията, наблюдавана в човешкото състояние.
Наскоро чревният микробиом се очертава като виновник за развитието на хронични заболявания, като затлъстяване [9,10], диабет [11,12], чернодробни заболявания [13,14] и рак [15]. В случая на NAFLD, местоположението на порталната вена позволява лесен достъп на бактерии и продукти, получени от микроби, за транслокация от червата в черния дроб [16]. В подкрепа на тази хипотеза, проучвания, проведени при затлъстели хора с NAFLD, разкриват чревна дисбиоза в сравнение със здрави хора [17,18]. Raman et al [17] съобщават за обогатяване на видовете Lactobacillus и различни микроби от типа Firmicutes при затлъстели хора с NAFLD. Междувременно, Wong et al [18], отбелязват, че пациентите с NASH имат по-ниско фекално изобилие на Firmicutes. Въпреки че проучванията, изследващи връзката между човешката чревна микробиота и чернодробните заболявания, са разширили нашето разбиране за тази връзка, все още липсват предклинични модели, имитиращи чревна дисбиоза при NAFLD [19].
Опитахме се да изследваме ефектите от хронично HFD хранене върху NAFLD при мишки. Използвани са мишки C57BL/6 предвид тяхната чувствителност към индуцирано от HFD затлъстяване. Използвахме диета, състояща се от 60% мазнини, 20% протеини и 20% въглехидрати, която се хранеше на мишките за период от 80 седмици - протокол, предназначен да имитира доживотна консумация на диета с високо съдържание на мазнини. Нашият анализ се фокусира главно върху чернодробната патология, фиброзата, възпалението и стреса на ендоплазмения ретикулум (ER). Също така измерихме метаболитните резултати и охарактеризирахме фекалната микробиота, използвайки 16S rRNA последователност. Нашите данни показват, че хроничната консумация на HFD води до значителна NAFLD и чревно-бактериална дисбиоза. По-конкретно, ние съобщаваме за значително увеличение на стеатоза, възпаление, увреждане на клетките, фиброза и ER стрес, което е свързано с увеличаване на типовете Actinobacteria и Firmicutes и намаляването на Bacteriodetes и Tenericutes.
МАТЕРИАЛИ И МЕТОДИ
Животни и диета
Метаболитни измервания и анализи
Ден преди евтаназията, десет мишки от всяка група са гладували в продължение на пет часа (светлинен цикъл). Вземането на кръв се извършва при животни в съзнание, върхът на опашката се изрязва с ножици и се използват хепаринизирани капилярни тръби (0,12 см диаметър, 7,5 см дължина) за събиране на 70 μL кръв от вената на опашката за измерване на глюкоза и инсулин . Кръвната глюкоза се оценява с помощта на глюкомер (Bayer Counter, Ню Джърси, САЩ) и плазменият инсулин се определя с помощта на миши ELISA анализ от Mercodia (Упсала, Швеция). Инсулиновата резистентност се изчислява чрез HOMA индекс, като се използва следното уравнение IR = (инсулин uU/ml) (глюкоза mmol/L)/22,5.
Оцветяване
Черният дроб, дебелото черво и мастната тъкан са фиксирани в 4% параформалдехид, вградени в парафин, разделени и след това оцветени с хематоксилин еозин (HE). Комплект за червено оцветяване Picro-sirius (Cat ab150681, abcam, Кеймбридж, Масачузетс, САЩ) се използва съгласно инструкциите на производителя за оцветяване на черния дроб за хистологична оценка на фиброза. За оцветяване с маслено червено O замразените чернодробни тъкани бяха нарязани (10 μm) с помощта на криостат (Leica Biosystems, Nussloch, Германия) и оцветяването беше извършено, както е описано по-рано [20].
Хистопатология
Хистологичната система за точкуване за NAFLD е постигната въз основа на HE и пикро-сириус червено оцветяване в черния дроб на Young-LFD (n = 6), Old-LFD (n = 10) и Old-HFD (n = 12) мишки, както по-рано описани [21]. Сертифициран патолог (I.C.) оценява сляпо хистологичните находки на стеатоза (0-3), портално и лобуларно възпаление (0-3), клетъчно увреждане (0-2) и фиброза (0-4) в чернодробните секции. Резултатът за активност на NAFLD (NAS) се изчислява чрез добавяне на непретеглените резултати за стеатоза, лобуларно възпаление, клетъчно увреждане (0-8).
Уестърн блотинг
Накратко, черният дроб беше хомогенизиран в буфер Mueller, съдържащ коктейл с протеазен инхибитор (Sigma Aldrich, Сейнт Луис, МО, САЩ). Общите протеинови концентрации се определят по метода на Брадфорд. Равни количества сурови протеинови хомогенати (20 μg) бяха фракционирани върху ръчно отлити SDS-полиакриламидни гелове и електрофоретично прехвърлени в PVDF мембрана с помощта на Royal Genie Blotter (IDEA Scientific, Минеаполис, MN, САЩ). Мембраните се оцветяват с разтвор на Ponceau S, за да се провери еднакво натоварване на протеини и ефективност на трансфер. Western blots бяха извършени с използване на първични антитела от Cell Signaling (Danvers, MA, САЩ) (фосфорилиран-IRE1α, IRE1α, XBP1, фосфорилиран-EIF2α, EIF2α, фосфорилиран-Jnk, Jnk, CHOP, β-актин, фосфорилиран-NFκB, NFκ, NFκ, NFκ ), AbD Serotec Raleigh, NC (F4/80) и Novus Biologicals Littleton, CO (фосфорилиран-IRE1α).
Количествена PCR в реално време
Експресията на гена в тъканите на черния дроб и дебелото черво се извършва в два екземпляра след изолиране на РНК с тризолен реагент. Използвани са следните анализи на генна експресия на Taqman от Applied Biosystems: моноцитен хемоаттрактант протеин-1 (MCP-1), интерлевкин 10 (IL-10), интерлевкин 17-алфа (IL-17α), интерлевкин 6 (IL-6), вилица кутия P3 (Foxp3), или тумор некротизиращ фактор алфа (TNF-α). Всички праймери бяха нормализирани до 18s рРНК.
Микробиомен анализ
Статистически анализ
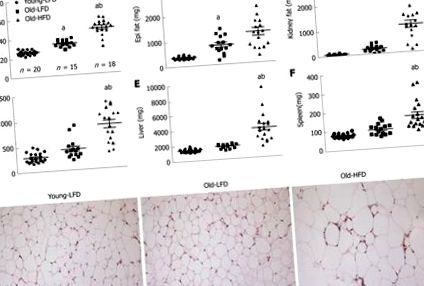
Метаболитна характеристика на мишки, подложени на продължително хранене с високо съдържание на мазнини. О: Пет часа кръвна захар на гладно; Б: Пет часа плазмен инсулин на гладно; C: Модел на хомеостаза за оценка - индекс на инсулинова резистентност. Данните са изразени като средна стойност ± SE. n = 10 мишки на група. a Значително различен от Young-LFD (P b Значително различен от Old-LFD (P (Фигура 3A 3A - -C). C). Анализът на пробите показа, че черният дроб на мишките Young-LFD има минимално фокално възпаление, минимална перисинусоидална фиброза и без признаци на стеатоза (NAS резултат 0-1) (Фигура (Фигура 3D 3D - -J). J). Старите LFD мишки показват леко фокално възпаление с фокална стеатоза и перисинусоидална фиброза (NAS резултат 1 В случая на старите HFD мишки наблюдавахме обширна стеатоза, портално и лобуларно възпаление с увреждане на клетките (балонна дегенерация на хепатоцитите) и очевидна фиброза (NAS резултат 5-6). След това потвърдихме натрупването на мазнини в черния дроб с оцветяване с маслено червено О (Фигура (Фигура 3С). 3С). Като цяло оцветяването с маслено червено О дава доказателства за макровезикуларно натрупване на триглицериди в хепатоцитите на мишки от стар HFD в сравнение с групите Young-LFD и Old-LFD.
Хистологична оценка на чернодробната тъкан при мишки, подложени на продължително хранене с високо съдържание на мазнини. A: хематоксилин и еозин; B: Picrossirious червено; C: Маслено червено O изображения на чернодробна тъкан (200 X); D: Хистологичен резултат на микровезикуларна стеатоза; Е: Микровезикуларна стеатоза; F: Балонираща дегенерация на хепатоцити; G: Ацидофилни тела; Н: Лобуларно възпаление; I: Фиброза; J: Резултат за безалкохолен стеатохепатит. Данните са изразени като медиана с интерквартилен обхват. n = 6-11 мишки на група. a Значително различен от Young-LFD (P b Значително различен от Old-LFD (P (Фигура 4A 4A - -E). E). MCP-1 е значително повишен при мишки от Old-HFD и Old-LFD в сравнение с Young -LFD мишки (P a Значително различен от Young-LFD (P b Значително различен от Old-LFD (P (Фигура5А). 5А). И двете от възрастните групи показват значително намаляване на фосфорилирания IRE1α (Фигура (Фигура5В ) 5B) и XBP1s (Фигура (Фигура5C) 5C) в сравнение с Young-LFD мишки (P (Фигура5D) 5D) (P (Фигура5E) 5E) (P (Фигура5F) 5F) (P a Значително различни от Young-LFD (P b Значително различен от Old-LFD (P (Фигура 6C) 6C) (P (Фигура 6C 6C и andE). E). Въпреки това не открихме промени в MCP-1, IL-10, или IL-17α (Фигура 6AB и andD) D) между която и да е от групите. Представителни хистологични изображения на тъканите на дебелото черво на Фигура Фигура 6F 6F показва подобна морфология на дебелото черво между групите.
Възпалително сигнализиране в тъканите на дебелото черво на мишки, подложени на продължително хранене с високо съдържание на мазнини. Представителни хистологични изображения на тъкан на дебелото черво (200 X) от диета с ниско съдържание на мазнини (LFD), Old-LFD и Old-HFD мишки. A: Генна експресия на моноцитен хемоаттрактант протеин-1 (MCP-1); В: Интерлевкин 10 (IL-10); С: Интерлевкин 6 (IL-6); D: Интерлевкин 17 (IL-17); E: Вилична кутия P3 (FoxP3). Данните са изразени като средна стойност ± SE. n = 10 мишки на група. a Значително различен от Young-LFD (P b Значително различен от Old-LFD (P Фигура7, 7, наблюдавахме подобно богатство на видове на таксономично ниво (Фигура (Фигура7А). 7А). Анализ на главните координати (PC) на базата на OTU показа различен състав на чревната микробиота между мишки Old-LFD и Old-HFD (Фигура (Фигура 7B). 7B). Firmicutes и Bacteriodetes бяха най-преобладаващата фила и в двете групи, включваща 61% и 32% от чревната микробиота в Стари LFD мишки и 73% и 21% при мишки Old HFD, съответно (Фигура (Фигура 8A 8A и andB). B). Последователно съотношението Firmicutes към Bacteriodetes при мишки от Old HFD е променено, за да благоприятства Firmicutes, когато в сравнение със Old-LFD (Фигура (Фигура 8C, 8C, P (Фигура9), 9), наблюдавахме значително увеличение на изобилието на Adercreutzia (Phylum-Actinobacteria), Coprococcus (Phylum-Firmicutes), Dorea (Phylum-Firmicutes ) и Ruminococcus (Phylum-Firmicutes) при стари HFD мишки в сравнение със стари LFD мишки (P b Significa напълно различен от Old-LFD (P b P ob/ob и C57BL6 мишки [41]. Независимо от това, не всички мишки C57BL/6 развиват NASH, когато мишките са били на диета AMLN в продължение на 30 седмици [39]. По този начин удължаването на продължителността на консумацията на HFD, както в настоящото проучване, може да е достатъчно, за да се насърчи по-хомогенна патология на NAFLD.
Също така се опитахме да изследваме възпалителните цитокини на дебелото черво, участващи в патологията на колита, поради съжителството на NAFLD с възпалително заболяване на червата (IBD) [57-61]. Наблюдавахме увеличение на IL-6 и FoxP3 в тъканите на дебелото черво на мишки Old-HFD, но не бяха наблюдавани промени в MCP-1, IL-10 и IL-17α между групите. Нашите открития за увеличаване на IL-6 са в съответствие с Jiang et al [62], които съобщават за увеличаване на експресията на IL-6 иРНК в чревната лигавица на пациенти с NAFLD в сравнение със здрави индивиди. Тъй като системното възпаление, включително IL-6 и TNF-α, е участвало както в NAFLD, така и в IBS при хора [57-61], не можем да отхвърлим, че системното възпаление и/или пропускливостта на червата може да играе важна роля в развитието на тези нарушения. Ние обаче не измервахме системни цитокини, нито чревна пропускливост в нашето проучване. По този начин, дали продължителната консумация на HFD за 80 седмици, както в настоящото проучване, показва тези характеристики, остава да се определи. Увеличението на експресията на FoxP3 вероятно е следствие от хроничното нискостепенно възпаление в дебелото черво и може да обясни отчасти липсата на разлика в хистологията на дебелото черво.
маса 1
Свързани с чревната микробиота промени при безалкохолни мастни чернодробни заболявания и безалкохолни стеатохепатити
- Ролята на храненето в патогенезата и профилактиката на безалкохолни мастни чернодробни заболявания
- Педиатричното затлъстяване на черния дроб и затлъстяването не винаги е само въпрос на безалкохолна мастна чернодробна болест
- Ролята на храненето в патогенезата и профилактиката на безалкохолни мастни чернодробни заболявания
- Нови възможности за диагностика на безалкохолна мастна чернодробна болест
- Безалкохолна мастна чернодробна болест (стационарни грижи) - Какво трябва да знаете