Ерик Химелман
1 Катедра по клетъчна биология и молекулярна медицина,
Маурисио А. Лило
2 Катедра по фармакология, физиология и неврология и
Джули Нуе
1 Катедра по клетъчна биология и молекулярна медицина,
J. Patrick Gonzalez
1 Катедра по клетъчна биология и молекулярна медицина,
Цинши Джао
1 Катедра по клетъчна биология и молекулярна медицина,
Лай-Хуа Сие
1 Катедра по клетъчна биология и молекулярна медицина,
Хонг Ли
3 Център за напреднали изследвания на протеомиката, Медицинско училище в Ню Джърси, Биомедицински и здравни науки на Rutgers, Нюарк, Ню Джърси, САЩ.
Тонг Лиу
3 Център за напреднали изследвания на протеомиката, Медицинско училище в Ню Джърси, Биомедицински и здравни науки на Rutgers, Нюарк, Ню Джърси, САЩ.
Xander H.T. Уеренс
4 Катедра по молекулярна физиология и биофизика, медицина, неврология и педиатрия, Институт за сърдечно-съдови изследвания, Медицински колеж Бейлор, Хюстън, Тексас, САЩ.
Пол Д. Лампе
5 Фред Хътчинсън Център за изследване на рака, Програма за транслационни изследвания, Отдел за науките за общественото здраве, Сиатъл, Вашингтон, САЩ.
Глен И. Фишман
6 Леон Х. Чарни, отдел по кардиология, Нюйоркски университет Langone Health, Ню Йорк, Ню Йорк, САЩ.
Наталия Широкова
2 Катедра по фармакология, физиология и неврология и
Хорхе Е. Контрерас
2 Катедра по фармакология, физиология и неврология и
Диего Фрайденрайх
1 Катедра по клетъчна биология и молекулярна медицина,
Свързани данни
Резюме
Резюме
Въведение
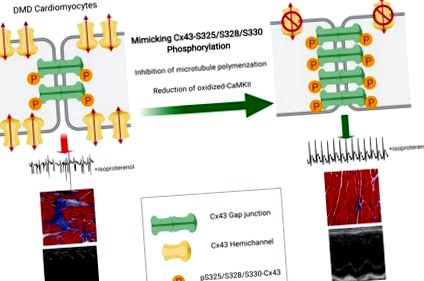
В последните проучвания наблюдавахме регулиране и латерализация на протеини Cx43 в сърдечните тъкани на DMD при хора и мишки (mdx) (24-26). Сърдечните лизати на DMD демонстрират повишени нива на по-бързо мигриращи, нефосфорилирани изоформи на Cx43 на SDS-PAGE, което показва промяна в регулирането на кръстовището (27). β адренергичната стимулация чрез прилагане на изопротеренол (Iso) причинява тежки сърдечни аритмии и преждевременна смърт при mdx мишки, докато WT мишките не са засегнати. Използването на пептидни миметици, които селективно се свързват и инхибират функцията на Cx43 хемиканали (16), защитават мишките, предизвикани от Iso mdx, от аритмогенеза и свързана смъртност (24). Освен това, генетично намаляване на Cx43 при дистрофични мишки нормализира сърдечните нива на Cx43 протеини до тези на WT, намали ремоделирането на Cx43 и спаси сърдечния фенотип (26).
Резултати
Хипофосфорилиране на S325/S328/S330-Cx43 в DMD сърца.
(A) Представително Western blot и количествено определяне на WT и mdx камерни лизати, изследвани за pan-Cx43 (отгоре), pS-Cx43 (средата) и винкулин (контрол на зареждането, отдолу). n = 7 и в двете групи. *** P Фигура 1D). Освен това наблюдавахме ремоделиране на Cx43 в човешки DMD секции (Фигура 1Е), (24), докато pS-Cx43 беше ограничен до идентификационните номера (Фигура 1F). Заедно тези резултати предполагат, че намаляването на фосфорилирането на S325/S328/S330, ключов механизъм за ремоделиране на Cx43 при други сърдечни патологии, може също да играе важна роля при ремоделирането на DMD Cx43.
За да се изследва ролята на pS-Cx43 in vivo, ние прекосихме установена линия от генетично инженерни мишки, при които сериновият триплет е мутирал или към нефосфорилируеми аланини (S3A), или към фосфомиметични глутаминови киселини (S3E) с WT (20) и mdx мишки . Хомозиготните Cx43-S3A (Cx43 S3A/S3A), Cx43-S3E (Cx43 S3E/S3E) и Cx43-WT (Cx43 WT/WT) се поддържат както в WT, така и в mdx фонове. Мутантните мишки Cx43-S3E са резистентни на индуцирано от исхемия реконструкция на пролуки (20). Протеиновите екстракти, приготвени от сърдечни тъкани на фосфо-мутантни мишки, показват промени в миграцията на протеин Cx43 на SDS-PAGE (допълнителна фигура 1В). Както WT: Cx43-S3E (WTS3E), така и mdx: Cx43-S3E (mdxS3E) лизатите показват видни по-бавно мигриращи фосфоизоформи P2 и P3 Cx43 с липсваща P0 лента. Различните фосфо-изоформи представляват Cx43, открит главно в междинните връзки, които участват в клетъчната комуникация (30, 32). Обратно, Cx43 в WTS3A и mdxS3A лизати проявяват по-бърза електрофоретична миграция и са ограничени до фосфо-изоформите P1 и P0. Дистрофин не е открит в контролните и фосфо-мутантните mdx сърца (допълнителна фигура 1В).
MdxS3E мишките са защитени от Cx43 ремоделиране.
MdxS3E мишките са защитени от тежки аритмии след β-адренергично предизвикателство.
Пациентите с DMD често показват тежки камерни аритмии, които могат да допринесат за внезапна сърдечна смърт (34). Възрастните mdx мишки също са податливи на аритмии и леталност след остро сърдечно предизвикателство с β-адренергичен агонист Iso (24, 26, 35). По-рано демонстрирахме, че Iso подобрява латерализацията на Cx43 in vivo, предполагайки, че фосфорилирането (или липсата му) също може да бъде замесено в процеса на ремоделиране при стрес (24). По този начин, ние записахме ЕКГ на цели животни преди и след Iso предизвикателство при 4- до 6-месечни WT, mdx, mdxS3A и mdxS3E мишки, за да оценим промените в параметрите на ЕКГ и да наблюдаваме аритмогенезата.
Изходният сърдечен ритъм (HR), даден от RR интервала, е бил повишен при mdx мишки (RR = 126.9ms) в сравнение с WT (147.5 ms, P = 0.0004, допълнителна фигура 3А), в съгласие с други проучвания (36). MdxS3A показва най-бързия изходен HR (RR = 122,1 ms, P Фигура 3A). След прилагане на Iso (5 mg/kg), мишките mdx и mdxS3A развиват тежки аритмии, състоящи се от преждевременни вентрикуларни контракции (PVC), камерна тахикардия (VT) и атриовентрикуларен (AV) блок. За разлика от това, мишките WT и mdxS3E демонстрираха или единични, редки PVCs, или изобщо не аномалии през целия час на наблюдение (Фигура 3А). В резултат на това мишките mdxS3E са имали значително намален резултат за аритмия (24) (среден резултат = 0,5 ± 0,17) в сравнение с mdx (среден резултат = 2,78 ± 0,43, Р Фигура 3В). Заедно тези резултати допълнително подкрепят значението на преработения Cx43 като аритмогенен субстрат в DMD животински модел.
Кардиомиоцитите на MdxS3E показват подобрена калциева хомеостаза и намалено производство на ROS.
Окисленият CaMKII допринася за Cx43 хипофосфорилиране.
Възрастните mdxS3E мишки показват подобрена сърдечна функция и морфология.
45%) мишки, следващи Iso.
За да се изключи, че ползата за оцеляването, приписвана на мишките mdxS3E, се дължи на непряко подобрение на дихателната функция, извършихме ултрасонография на диафрагмата (55). Амплитудата на движението на диафрагмата по време на вдъхновение намаля значително при всички mdx (mdx = 0,33 mm, mdxS3A = 0,33 mm, mdxS3E = 0,35 mm) генотипове в сравнение с WT (всички P 2+ неправилно боравене (59–62). Насочването към MT мрежата защитава mdx мишки срещу аритмии, предизвикани от стрес (35). Важно е, че вътреклетъчният трафик на Cx43 до голяма степен зависи от MTs (63). МТ-зависимият трафик на Cx43 към ID се нарушава в стресирани кардиомиоцити, което води до по-малко свързваща Cx43 и нарушена функция на свързване на празнината ( Предполага се също така, че ремоделирането на Cx43 в болни сърца може да се обясни с пренасочване на МТ към страничната мембрана в кардиомиоцитите (65).
Следователно, за да изследваме потенциална причинно-следствена връзка между MTs и Cx43 ремоделиране при mdx мишки, ние имплантирахме 3-месечни mdx мишки с миниосмотични помпи, прилагащи или физиологичен разтвор, или сок, известен MT деполимеризатор със защитни ефекти при mdx мишки (66, 67) (0,4 mg/kg/ден), в продължение на 4 седмици. В края на лечението се събира вентрикуларна тъкан. Намаляването на плътността на МТ с лечение на кохи се потвърждава чрез намаляване на β-тубулина както на нивото на тъканния протеин, така и на флуоресцентен сигнал в изолирани кардиомиоцити (допълнителна фигура 5, А и В). Нивата на NOX2/gp91 фокс протеин значително намаляват с 65% в mdx вентрикули, третирани с колх (P Фигура 7А). Освен това, имуноблотингът разкрива 31% намаление на относителните нива на вол-CaMKII в сърца, третирани с хрема (Р Фигура 7В). След това направихме оценка за промени в Cx43, където открихме двукратно увеличение на относителните нива на pS-Cx43 в mdx-лизати, третирани с колх, в сравнение с физиологичен разтвор (P Фигура 7C). След това изследвахме клетъчното разпределение на Cx43 в анализ за разтворимост на Triton. Измерихме почти 6-кратно увеличение на неразтворимия Cx43 в обработени с колх mdx сърца (P Фигура 7D). Водени от тези открития, ние проведохме имунохистохимия Cx43 при камерни криосекции. Конфокалното изобразяване на имунофлуоресценция разкрива намаляване на ремоделирането на Cx43 в сърца, третирани с колх (Фигура 7Е), наподобяващи това, което преди е било виждано в сърцата на mdxS3E (Фигура 2) Количественото определяне на относителния сигнал Cx43, открит при идентификаторите, потвърди значително по-висока локализация на Cx43 към идентификаторите в лекувани с колх mdx сърца (P Фигура 7Е).
Имитирането на фосфорилиране на Cx43 е достатъчно, за да коригира няколко аномалии, изразени в дистрофичните кардиомиоцити. Нашите резултати са в съответствие с предишни проучвания, при които или имитиране, или усилване на pS-Cx43 дава кардиопротекция в миши модели на хипертрофия и напречно аортно свиване (TAC), съответно (18, 20). pS-Cx43 също така запазва връзката на връзката между пролуките в кардиомиоцитите, които не реагират на FGF, важен медиатор на кардиопротекцията (68). Wang et al. наскоро съобщи, че инжектирането на AAV9, носещо Cx43-S3E, в сърцата след миокарден инфаркт подобрява сърдечната функция и насърчава редиференциацията на кардиомиоцитите при възрастни на мястото на инфаркта (69). Това откритие може да осигури липсваща връзка между Cx43 фосфорилирането и защитата срещу смърт на кардиомиоцитни клетки и фиброза, отличителни черти на DMD кардиомиопатията, които бяха смекчени при мишки mdxS3E.
Важно е да се отбележи, че въпреки че фокусът на това проучване е върху ремоделирането на Cx43, кардиозащитата, наблюдавана при мишки mdxS3E, може също да се отдаде на засилена междуклетъчна комуникация между кръстовища (GJIC). В повечето модели на сърдечни заболявания, при които се наблюдава реконструкция на кръстовища, Cx43 не само се преразпределя странично, но нивата на експресия са значително намалени при ID (22). Това намаляване причинява разкъсване на кръстовището, което води до забавена проводимост и непрекъснато разпространение, 2 ключови аритмични субстрата в множество животински модели (11). Всъщност повечето терапевтични стратегии, насочени към Cx43, се фокусират върху запазването на Cx43 в ID за насърчаване на GJIC, а не върху предотвратяването на ремоделиране (77–79). Нашите данни, показващи подобрен Cx43 в неразтворимите в тритон фракции на протеинови междини на сърца на mdxS3E (допълнителна фигура 2А), както и увеличен относителен сигнал Cx43, открит в ID регионите в криосекции на сърца на mdxS3E (фигура 2), предполагат подобрена локализация на Cx43 на личната карта. Въпреки това, корекция на сърдечно заболяване при дистрофични мишки може да бъде постигната без пълно възстановяване на свързания с ID Cx43 (26). Това подкрепя схващането, че ремоделирането, но не и намаляване на ID-Cx43 е ключовото патологично събитие в дистрофичните сърца.
Въпреки глобалния генетичен удар, дистрофичният фенотип се спасява само в сърцето (Фигура 6), а не и в околните скелетни мускули, както се вижда от отслабената и видимо фиброзна диафрагма при възрастни мишки mdxS3E (Допълнителни Фигури 4, В и С). Сърдечни и дихателни дисфункции съществуват едновременно при пациенти с DMD в късен стадий, като едната влияе негативно върху другата (80). За разлика от сърдечния мускул, скелетните мускули на възрастни не се нуждаят от междинни връзки, за да координират мускулната контракция (81). Въпреки това, de novo експресията на Cx43 хемиканали допринася за мускулна дегенерация в денервирани дистрофични бързи скелетни мускулни влакна, като диафрагмата (82–84). По този начин се предполага, че хемиканалите Cx43 са жизнеспособна терапевтична цел за дистрофични мускули. Независимо от това, нашите резултати подкрепят схващането, че корекцията на дистрофичната кардиомиопатия чрез потискане на Cx43 ремоделирането може да продължи независимо от наличието на дистрофични дихателни мускули.
Като цяло, настоящото проучване предоставя доказателства, че посттранслационното фосфорилиране на S325/S328/S330 в Cx43 е ключово събитие, което предпазва от реконструкция на кръстовища и развитие на кардиомиопатия в условията на DMD. Това проучване дава представа за това как дистрофичните патомеханизми се пресичат с фосфорилирането, локализацията и функцията на сърцето на Cx43. Нашите резултати, съчетани с обширните знания и потенциал, приписван на терапията с Cx43, допълнително засилва потенциала за базирани на Cx43 стратегии за борба с DMD-кардиомиопатията.
Методи
Подробни описания на експерименталните методи са дадени в допълнителните методи.
Проучвания на мишки.
Човешки проби.
Три проби от мъжки сърца на мъже без DMD и 3 DMD са получени от Университета на Мериленд Brain and Tissue Bank, член на мрежата на NIH NeuroBioBank. Всички проби бяха разрязани след смъртта. Смъртта на DMD1 се дължи на сърдечна недостатъчност на 15-годишна възраст, смъртта на DMD2 се дължи на белодробна тромбоемболия на 17-годишна възраст, а причината за смъртта на DMD3 е неизвестна.
Уестърн блотинг.
Замразени на мишка и човешки вентрикуларни тъкани се хомогенизират в RIPA буфер и се обработват, както е описано (26). Използвани са следните антитела: Cx43 (MilliporeSigma, C6219; 1: 10000, заек), pS325/S328/S330-Cx43 (направени по поръчка в домашни условия, 1: 1000, мишка), pS365-Cx43 (направени по поръчка, 1: 1000, заек), винкулин (MilliporeSigma, V9131; 1: 2000, мишка), N-кадхерин (Invitrogen, 33-3900; 1: 2000, мишка), α-тубулин (Abcam, ab7291; 1: 2000, мишка ), β-тубулин (Sigma T8328, 1: 1000, мишка), gp91-phox (Santa Cruz Biotechnology Inc., sc-130543; 1: 1000, мишка), CaMKIIδ (GeneTex, GTX111401; 1: 1000, заек), и окислен-CaMKII (Met281/282, MilliporeSigma, 07-1387; 1: 1000, заек). За подробности вижте Допълнителни методи.
Анализ за разтворимост на Тритон.
Методът е адаптиран от предишно описание (71) с модификации. За подробности вижте Допълнителни методи.
Изолация на камерни кардиомиоцити.
Единични камерни кардиомиоцити бяха ензимно изолирани с колагеназа тип II (Worthington, LS004176) и протеаза XIV (MilliporeSigma, P5147) от 3 до 4-месечни сърца на мишки, използвайки система за перфузия на Langendorff, описана преди това (26, 44).
Вътреклетъчни Ca 2+ отговори на хипо-осмотичен шок.
Интактните кардиомиоцити бяха заредени с флуо-4AM (5 μM, Invitrogen), деестерифицирани и изобразени, както е описано по-горе (26). За подробности вижте Допълнителни методи.
Измерване на производството на цитозолна ROS.
Интактните кардиомиоцити се зареждат с 5 μM 2 ', 7'-дихлорфлуоресцен-диацетат (H2-DCFA) и се изобразяват за 120 секунди, както е описано по-горе (26).
Тъканна имунофлуоресценция.
Мишката и човешката вентрикуларна тъкан се изрязват, обработват и инкубират, както е описано по-горе (24). След това секциите бяха инкубирани или с Cx43 (MilliporeSigma, C6219, 1: 2000, заек) или pS325/S328/S330-Cx43 (вж. По-горе, 1: 1000) и N-кадхерин (Invitrogen 33-3900, 1: 300, мишка) антитела в блокиращ буфер за една нощ при 4 ° C. Вижте Допълнителни методи за повече подробности.
Количествено определяне на локализация на Cx43 на интеркалирания диск.
Методът е адаптиран от предишно описание (71) с модификации. Вижте Допълнителни методи за повече подробности.
Оцветяване и количествено определяне на фиброза.
Оцветяването на Masson Trichrome се извършва, както е описано по-горе (25).
Ехокардиография.
Трансторакална ехокардиография на мишки на възраст (от 14 до 18 месеца) беше извършена и анализирана, както е описано по-горе (25). Ултразвуково изследване на диафрагмата се извършва на обезболени мишки и се измерват амплитудите на диафрагмата, както е описано по-горе (55).
Електрокардиография.
Електрокардиограмите на цели животни бяха записани в конформация на олово II и анализирани, както е описано по-горе.
Изолирана сърдечна етидий-бромидна перфузия и количествено определяне на усвояването на багрилото.
Изолирана сърдечна биотин перфузия.
Мини имплантация на осмотична помпа.
Млади възрастни (приблизително на 3 месеца) mdx мишки, избрани за имплантиране на осмотична помпа, бяха претеглени и упоени. Осмотичните помпи (модел Alzet 1004) бяха вкарани през малък разрез между лопатките и след това разрезът беше затворен с щипки за рани. Осмотичните помпи съдържат или физиологичен разтвор (носител), или колх (MilliporeSigma, C9754, разтворен във физиологичен разтвор, 0,4 mg/kg/d) и остават в мишките в продължение на 28 дни. В края на проучването мишките бяха евтаназирани и сърдечната тъкан беше събрана за имуноблотинг и имунофлуоресцентни анализи.
Статистика.
Данните са изразени като средна стойност ± SEM. Статистическите анализи бяха извършени с помощта на параметричен анализ в софтуера GraphPad Prism. Статистическата значимост между множество групи беше анализирана чрез еднопосочно ANOVA параметрично тестване, последвано от тест за множество сравнения на Tukey. Статистическата значимост сред мишки, които са инжектирани с Iso или контрола, е анализирана чрез двупосочен ANOVA, последван от тест за множество сравнения на Tukey. В случай на 2 групи, направихме сдвоени t тестове. Стойностите на Р по-малко от 0,05 се считат за значими за всички статистически тестове. Представителните стойности на P и символите са описани в легендите на фигурите. Повечето експерименти и анализи на отчитане на крайни точки (имунохистохимия, хистопатология, имуноблотинг) бяха проведени по заслепен начин.
Одобрение на проучването.
Всички експерименти с животни са одобрени от IACUC на Медицинското училище в Рутгерс Ню Джърси и са извършени в съответствие с насоките на NIH. Всички експерименти с хора са одобрени от IRB на университета Рутгерс и са извършени в съответствие със съответните насоки и разпоредби. Получено е информирано съгласие за всички субекти, от които са анализирани тъканите.
Авторски приноси
EH, MAL, DF, JEC, NS и LHX проектираха експерименти. EH и MAL извършиха повечето експерименти. EH, MAL, DF, JEC и NS анализираха данните. QZ, JPG, JN, HL, TL и PDL извършиха някои от експериментите. XHTW предоставя mdx: CaMKII (MM-VV) сърдечни тъкани, а PDL предоставя персонализирано pS325/S328/S330 антитяло. GIF предостави трансгенните S3A и S3E чукащи мишки. EH е написал ръкописа. Всички автори прегледаха и одобриха окончателния проект.
- Планът от 12 стъпки за зареждане с въглехидрати, за да изглежда по-мускулеста мускулатура; Фитнес
- Преодоляване на превенцията за отслабване
- 3-те типа тяло - и как те влияят на профилактиката ви за отслабване
- Пролетно почистване на вашия план за отслабване Превенция
- 20-те най-мързеливи начина за отслабване - Отслабване - Профилактика Австралия