Резюме
Въведение
Ракът на главата и шията (HNC) е събирателен термин за рак, произхождащ от устната, устната и носната кухина, параназалните синуси, фаринкса, ларинкса и трахеята. Приблизително 90% от HNC са плоскоклетъчен карцином на главата и шията (HNSCC), произхождащ от лигавицата на лигавицата (епител) на тези региони.
Подобно на повечето агресивни тумори, HNC показват висока честота и зависимост от гликолизата, за да отговорят на техните метаболитни нужди8, 9. Поради това се обосновава, че диетите, ограничени във въглехидрати (CHOs), могат да се насочат към променения метаболизъм на такива гликолитични тумори10, 11. Всъщност, има някои доказателства, че кетогенна диета (KD), диета с ниско съдържание на СНО с високо съдържание на мазнини, която води до повишаване на циркулиращите кетонни тела в mM диапазон, може не само да наруши метаболизма и растежа на туморните клетки, но също така да се бори с кахексията и терапията -индуцирани нежелани реакции12 - 14.
В този преглед ще представя три основни основания за прилагането на CHO ограничени и KD при пациенти с HNC. Накратко, това са (1) насочени към променения метаболизъм на туморните клетки; (2) повишаване на радио- и хемочувствителността на злокачествените клетки, като същевременно защитава нормалните клетки; (3) отчитане на променения метаболизъм на носещия тумор гостоприемник. Поради различните проблеми по отношение на приема на храна, остава въпросът дали ограничението на СНО е възможно при пациенти с HNC. Затова във финалната част на тази статия разглеждам специфични аспекти и практически въпроси на такава диетична интервенция.
Сладкият зъб на HNCs
Отличителна черта на HNC, както и повечето ракови заболявания като цяло, е тяхната висока авидиция за усвояване на глюкоза. Ото Варбург и неговите колеги от бившия Институт по биология на Кайзер Вилхелм в Берлин са първите, които количествено определят усвояването на глюкоза и генерирането на енергия при голямо разнообразие от животински и човешки тумори15 - 19. Използвайки измервания in vivo и in vitro, Warburg показа, че в сравнение с нормалните тъкани, туморите биха поели няколко пъти повече глюкоза от околната среда и ферментираха по-голямата част от нея до лактат дори в присъствието на достатъчно кислород, който обикновено потискаше производството на лактат. Следователно този метаболитен фенотип на повишено усвояване на глюкоза и производство на лактат е известен като ефект на Варбург или аеробна гликолиза, тъй като се случва и при нормоксични условия.
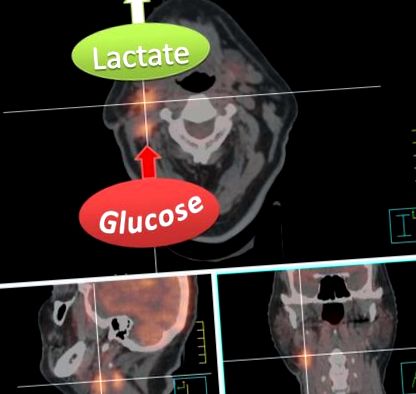
Сливно изображение на радиотерапевтично планиране на CT и FDG-PET сканиране на пациент с първичен десностранен cT1 cN2b тонзиларен плоскоклетъчен карцином след тонзилектомия. Високото поглъщане на FDG от десните конгломерати на лимфните възли е показателно за силно гликолитични метастази. Имайте предвид обаче, че FDG-PET измерва само усвояването и превръщането на глюкоза в глюкозо-6-фосфат и следователно не може да прави разлика между производството на лактат или подаването на междинни продукти за гликолиза и крайни продукти в пътя на пентозата фосфат или цикъла на лимонената киселина. Високото освобождаване на лактат, което може да бъде измерено с други техники като магнитно-резонансна спектроскопия, обаче е посочено с илюстративна цел, тъй като е характерно за агресивни метастази.
Генетичните и епигенетични промени насърчават аеробната гликолиза
маса 1
| Загуба на функционални мутации/изтривания | ||
| TP53 | 50-80 | Загубата на p53 води до ядрена и митохондриална ДНК нестабилност, повишен оксидативен стрес, намаляване на OXPHOS и повишаване на гликолизата (прегледано в 46, 47) |
| NOTCH1 | 14-15 | Hypoactive Notch намалява нивата на p53 и отслабва митохондриалната функция, причинявайки преминаване към гликолиза и зависимост от глюкоза48 |
| PTEN | 7 | PTEN противодейства на гликолизата чрез обръщане на PI3K-медиираното превръщане на фосфатидилинозитол1,4-бифосфат (PIP2) във фосфатидилинозитол1,4,5-трифосфат (PIP3), което е необходимо за активиране на Akt − mTOR сигнализиране. Следователно загубата на PTEN увеличава Akt активирането. PTEN също противодейства на глутаминолизата чрез намаляване на нивата на глутаминаза чрез независим от PI3K път49 |
| Печалба от функционални мутации/усилвания | ||
| PIK3CA | 6-20 | PIK3CA кодира p110α, изоформа на 110-kDa каталитична субединица от клас 1А фосфатидилинозитол-3-киназа (PI3K). Пътят PI3K-Akt-mTOR е един от най-често хиперактивираните сигнални каскади в туморните клетки. Подобрената Akt сигнализация индуцира фенотип на Warburg и увеличава свързването на гликолизата с цикъла на митохондриалната лимонена киселина, което води до междинни продукти за биосинтетични пътища и NADH като основен донор на електрони за OXPHOS (прегледан през 50 г.) |
| HRAS | 4-5 | HRAS кодира малката GTPase H-Ras, член на Ras семейството на ензими, които стават активни, когато са свързани с GTP. Освен други пътища, важни за клетъчното оцеляване и пролиферация, Ras-GTP директно ацилира PI3K p110. Онкогенното активиране на H-Ras намалява митохондриалното дишане, превръщайки трансформираните клетки в зависимост от глюкозата, за да подхрани гликолизата51 |
Уязвимост на HNC клетките към CHO ограничение
Таблица 2
| Високи нива на глюкоза в кръвта (Регулиране на гликолитичните ензими) | Кръвна глюкоза ↓, мастни киселини ↑ (Мастните киселини инхибират ключовите гликолитични ензими) |
| Хипоксия | Кръвна глюкоза ↓, кетони ↑ (Лошо снабдяване с хипоксични клетки с хранителни вещества; хипоксични клетки, които не могат ефективно да окисляват кетоните) |
| Онкогенно сигнализиране (инсулин/IGF-1-PI3K-Akt-mTOR) | Кръвна глюкоза ↓, инсулин ↓ (Противодейства на PI3K пътя; също активира AMPK, инхибирайки mTOR) |
| Кетони ↑ (Клас I и II HDAC инхибитори) | |
| Възпаление (Високите нива на глюкоза в кръвта и ROS стимулират освобождаването на възпалителни цитокини) | Кръвна глюкоза ↓ (Намалява ROS и възпалението) |
Ограничението на СНО регулира гликолизата надолу
Ограничаването на СНО е особено проблематично за хипоксичните клетки
Ролята на хипоксията в регулирането на гликолитичните ензими и навлизането на глюкоза в клетките е добре установена. Вече Варбург беше наясно с лошата капилярна мрежа от туморни тъкани и предположи, че туморите са по-уязвими към едновременно лишаване от глюкоза и кислород поради техните по-лоши „канали за доставка“ 19. По принцип понижаването на нивата на кръвната глюкоза може напълно да намали някои от хронично хипоксичните клетки, разположени далеч от кръвоносните съдове, от доставките им. Ако CHOs са ограничени достатъчно строго, черният дроб също започва да произвежда по-големи количества кетонни тела, които служат като висококачествено гориво за нормалните тъкани, по-специално мозъка и мускулите92. Въпреки че измерванията при пациенти с HNSCC показват, че техните тумори поемат кетонни тела, абсолютните количества са малки и тяхната метаболитна съдба не е определена8. Дори HNSCC да разполага с необходимите ензими за оползотворяване на кетонни тела - което изглежда не е така за много други туморни клетки93 - 96 - използването на кетони изисква кислород и следователно е нарушено в големи части от тумора40. По този начин, понижаването на нивата на кръвната глюкоза ще има много по-трудно въздействие върху хипоксичните туморни клетки, отколкото върху нормалните клетки, които са метаболитно гъвкави и притежават непокътната хранителна мрежа.
CHO ограничението инхибира онкогенната сигнализация
Ограничението на СНО има способността да противодейства на сигнализирането чрез пътя на фосфатидилинозитол-3 киназа-Akt-бозайник на рапамицин (PI3K-Akt-mTOR). Този път се активира от инсулин и растежни фактори като инсулиноподобен растежен фактор-1 (IGF-1) и неговият ефект е, наред с други, регулиране на гликолизата 50, 97. Сложността на сигналната мрежа на IGF, тирозин киназа рецепторните кръстосани връзки, както и автокринното активиране на нецелеви рецептори, осигуряват механизми на резистентност срещу твърде специфични инхибитори на тирозин киназа, които освен това често предизвикват системни странични ефекти98, 99. За разлика от тях, ограничаването на СНО е нетоксична стратегия за едновременно насочване към същите молекулярни пътища които са индивидуално насочени с фармацевтични лекарства.
Съобщава се за противоречиви и често отрицателни резултати по отношение на връзката между IGF-1 и рака за различни видове рак, включително HNC98. Това оставя инсулина, хипергликемията и възпалението като по-правдоподобни медиатори на добре установената връзка метаболитен синдром-рак100. Неотдавнашно проучване разшири тази връзка с HNC, като показа, че затлъстяването е независим рисков фактор за специфична за заболяването смъртност от ранен стадий на перорален SCC, когато се отчита влиянието на свързаната с рака загуба на тегло101. По този начин, в ранен етап инхибирането на HNSCC инсулин чрез ограничаване на СНО може да бъде от полза срещу туморната гликолиза и прогресия. Ограничението на СНО също увеличава активността на AMP киназата (AMPK), вътреклетъчен енергиен сензор. Въпреки че активирането на AMPK може остро да регулира гликолизата в някои клетки, в дългосрочен план той действа като „анти-Варбург“ туморен супресор и инхибира mTOR сигнализирането102. Следователно AMPK се очертава като привлекателна противоракова цел, която се опитва да се активира с помощта на антидиабетни лекарства като метформин99, 103.
В обобщение CHO ограничението и по-специално KD оказват системни ефекти върху онкогенните сигнални пътища, които противодействат на туморната гликолиза, но - поради сложността на участващите сигнални мрежи и голямата генетична хетерогенност на HNC туморите - трябва да бъдат допълнително проучени.
Ограничението на СНО е насочено към възпаление
Връзката между възпалението и HNSCC става очевидна от унгарско проучване, показващо повишено разпространение на орални възпалителни, премалигнени и ракови лезии сред диабетиците в сравнение със здравите контроли111. Тези автори също така установяват, че при съответно 14,6% и 9,7% разпространението на диабет и повишените нива на глюкоза в кръвта (> 6,1 mmol/L) е значително по-високо при 610 пациенти с орален карцином, отколкото в контролна група без тумор. Високите нива на глюкоза в кръвта насърчават освобождаването на възпалителни цитокини и ROS от моноцити и макрофаги по дозозависим начин112, 113; както възпалителните цитокини, така и ROS са активатори на HIF-1α и следователно гликолиза. Връзката между възпалението и високите нива на глюкоза в кръвта се наблюдава и при синдрома на кахексия на рака12. Всъщност още през 1885 г. Ернст Фройнд описва признаци на хипергликемия при 70 от 70 пациенти с рак, което го кара да заключи, че необичайно високото съдържание на кръвна захар би било необходимо за съществуването на карцином114. В този смисъл хипергликемията вече е утвърден предиктор за лошо оцеляване при различни видове рак115 - 122.
Путативни ефекти на ограничаването на СНО върху нормалната и туморната тъкан. По време на лъчетерапията ограничението на СНО може да предизвика диференциална реакция на стрес между нормалните и туморните клетки, така че първите да имат защита от, а вторите сенсибилизация към йонизиращо лъчение. Освен това, чрез повишаване на кетонните тела и мастните киселини, ограничаването на СНО помага да се запази мускулната тъкан.
С малки изключения, нормалните тъкани лесно окисляват кетонните тела, като по този начин намаляват митохондриалното съотношение NADP +/NADPH. Това от своя страна увеличава количеството намален GSH, наличен за почистване на ROS130. Това антиоксидантно свойство на кетонните тела не би било от полза за туморните клетки, които не са в състояние да ги метаболизират поради липса на необходимите ензими93 - 96 или хипоксия40. За разлика от това, HDAC инхибиращата активност на кетоните може да бъде полезна срещу HNSCC стволови клетки, които обикновено проявяват най-висока радиорезистентност109.
Ограничаването на СНО може също да наруши повторния растеж на тумора по време на фракции на лъчетерапия и да забави ускорената пролиферация, за която е известно, че започва в HNSCC в някакъв момент по време на лъчелечението. Преди това прегледахме богатството от предклинични данни, показващи, че ограничаването на СНО само забавя растежа на тумора при различни туморни модели12. Повечето от тези проучвания тестваха KD, а данните in vitro показват, че самите кетонни тела могат да имат антипролиферативен ефект върху някои туморни клетки134, 135. За съжаление повечето проучвания при хора, оценяващи инхибиране на растежа чрез KD, са фокусирани специално върху пациенти с астроцитом в напреднал стадий, които имат особено лоша прогноза88, 89, 136. В допълнение, броят на темите в проучванията към днешна дата е малък, което намалява статистическата надеждност на резултатите. Въпреки това в малки пилотни проучвания са намерени някои намеци за намаляване на пролиферацията на туморни клетки с ограничение на СНО при екстракраниални тумори90, 137.
Някои предклинични проучвания допълнително показват, че ограничението на СНО под формата на цялостно ограничение на калориите138 - 140 или неограничен KD141 може да се насочи към пътя на съдовия ендотелен растежен фактор, който също е насочен от лекарството бевацизумаб (Avastin), за което са показани клинични ползи, когато комбинирана с радио- и/или химиотерапия при HNSCC142. Инхибирането на VEGF се използва с цел нормализиране на туморната васкулатура и радиосенсибилизиране на туморната тъкан чрез улесняване на доставката на кислород и химиотерапевтични лекарства. По този начин се използва хипербарна кислородна терапия (HBOT), за да се повиши ефикасността на лъчетерапията. Прегледът на Cochrane заключава, че HBOT по време на лъчетерапия значително намалява риска от рецидив на тумора на една и пет години при HNSCC, но за сметка на увеличеното увреждане на нормалната тъкан и токсичността на кислорода за централната нервна система. В този контекст е интересно да се отбележи, че две предклинични проучвания предоставят доказателства, че кетонните тела могат да имат синергични ефекти с HBOT143 и значително да забавят появата на HBOT-индуцирани гърчове144.
В обобщение, има доказателства, че ограничаването на СНО действа като цитотоксичен сенсибилизатор в туморната тъкан, като същевременно защитава нормалната тъкан, което подпомага нейното прилагане по време на стандартното лечение на HNC. Основните ефекти са обобщени в Фигура 2, и наскоро беше публикуван по-задълбочен преглед на основните механизми14.
Ограничението на СНО за положително влияние върху състава на тялото
При пациенти с HNC дори „достатъчен“ прием на енергия и протеини се оказва недостатъчен за предотвратяване на значителна загуба на тегло и чиста тъкан по време на лечението169. Съответно в неотдавнашен документ за позицията на Работната група на Европейското училище по онкология се казва, че „трябва да се положат всички усилия за предотвратяване на загуба на мускули, вместо да се разчита на опити за възстановяване на загубеното“ 170. След това твърдение използването на кетонови естери или KD може да бъде изпробвано като част от такова усилие.
Дискусия: реалистично ли е ограничението на СНО при пациенти с HNC?
Диаграма, показваща предложеното прилагане на диета с ниско ниво на СНО за пациента с HNC. Снимките показват храни, съвместими с кетогенна диета, които имат кремообразна текстура и по този начин са лесни за преглъщане.
В заключение, ограничението на СНО при пациент с HNC изглежда осъществимо и следователно реалистично, но изисква допълнително време и усилия, тъй като трябва да бъде съобразено с индивидуалния пациент. Това обаче е общ проблем при пациентите с HNC и усилията за консултации по хранене като цяло изглеждат плодотворни. Ясно е, че поносимостта и отговорът на диети с ограничена СНО също е индивидуална и някои пациенти достигат кетоза по-лесно от други. Надяваме се бъдещите проучвания да покажат кои пациенти се възползват най-много от ограничението на СНО. Понастоящем фаза I клинично изпитване (> NCT01975766) в университета в Айова набира пациенти с HNSCC, за да се изследва безопасността на KD плюс едновременно химиолучиране, като вторичен резултат е оцеляването без прогресия. Докато резултатите не бъдат публикувани, този документ се надява да насърчи лекарите да направят собствен опит с предлагането на ограничение на СНО за своите пациенти като нетоксичен подход за борба с HNC.
Благодарности
Тази статия се основава на лекция със същото заглавие, която бях поканена да изнеса на мултидисциплинарния симпозиум за рак на главата и шията ASTRO 2014 в Скотсдейл, Аризона. Бих искал да благодаря на д-р Дейвид Рабен за тази любезна покана. Също така бих искал да благодаря на проф. Xi-Shan Hao, че ме покани и мотивира да напиша тази статия за Биология и медицина на рака.
Бележки под линия
Не се разкриват потенциални конфликти на интереси.
- Поставете реалистични цели за отслабване с този безплатен работен лист
- Нови проучвания разкриват, че ябълките помагат за отслабване и се борят с рака, ако го направите; t обелете!
- Богати на протеини, отлични за отслабване, включете това зърно във вашата диета точно сега!
- Първото нещо, което трябва да ядете, за да отслабнете, за да ядете добре това не това
- Разумът №1; не губи мазнини на корема яжте това не това