Виктория Л. Кинг
1 Отдел по сърдечно-съдова медицина, Университет на Кентъки, Лексингтън, KY
2 Завършил център за хранителни науки, Университет на Кентъки, Лексингтън, KY
Никълъс Хач
2 Завършил център за хранителни науки, Университет на Кентъки, Лексингтън, KY
Хуей-Уей Чан
1 Отдел по сърдечно-съдова медицина, Университет на Кентъки, Лексингтън, KY
Марсиел К. дьо Бир
2 Завършил център за хранителни науки, Университет на Кентъки, Лексингтън, KY
3 Катедра по физиология, Университет в Кентъки, Лексингтън, KY
Фредерик К. дьо Бир
2 Завършил център за хранителни науки, Университет на Кентъки, Лексингтън, KY
4 Отдел по ендокринология и молекулярна медицина, Университет в Кентъки, Лексингтън, Кентъки
5 Министерство на ветераните, Лексингтън, Кентъки
Лиза Р. Танок
2 Завършил център за хранителни науки, Университет на Кентъки, Лексингтън, KY
4 Отдел по ендокринология и молекулярна медицина, Университет в Кентъки, Лексингтън, Кентъки
5 Департамент по въпросите на ветераните, Лексингтън, Кентъки
Свързани данни
Резюме
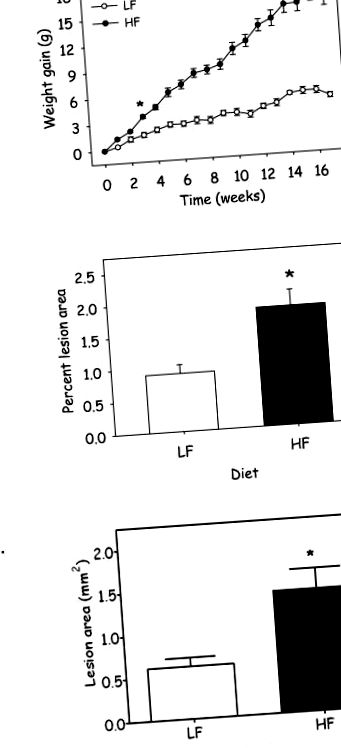
Епидемията от затлъстяване, обхващаща развитите страни, е придружена от увеличаване на атеросклеротичните сърдечно-съдови заболявания. Дислипидемията, диабетът, хипертонията и затлъстяването са рискови фактори за сърдечно-съдови заболявания. Обаче очертаването на механизма на ускорена затлъстяване атеросклероза е затруднено от оскъдността на животински модели. Подобно на хората, мишките с дефицит на аполипопротеин Е (апоЕ -/-) спонтанно развиват атеросклероза през целия си живот. За да определим дали апоЕ -/- мишките ще развият затлъстяване с ускорена атеросклероза, хранехме мишки с диети, съдържащи 10 (LF) или 60 (HF) kcal% от мазнини в продължение на 17 седмици. Мишките, хранени с HF диета, имат значително увеличение на телесното тегло и образуването на атеросклеротични лезии в сравнение с мишките, хранени с LF диета. Няма значителни разлики между групите в серумни концентрации на общ холестерол, триглицериди или лептин. Плазмените концентрации на серумния амилоид А (SAA) в реактор с остра фаза са повишени както при затлъстяване, така и при сърдечно-съдови заболявания. Съответно, плазмените концентрации на SAA се повишават 4,0 пъти (P Фигура 1A). Нещо повече, телесното тегло нараства линейно при мишки, хранени с високочестотна диета, през целия период на проучването. Въпреки това, мишките, хранени с LF диета, консумират повече храна ежедневно, отколкото тези, хранени с HF диета; консумацията на калории е увеличена при HF хранени мишки в сравнение с тези на LF диета (Таблица 1). Разпределението на затлъстяването е измерено в чернодробната, епидидималната и ретроперитонеалната мастна тъкан. Мишките, хранени с високочестотна диета, имат значително увеличение на процента телесно тегло както на епидидимални, така и на ретроперитонеални депа на мастна тъкан; храненето с високочестотна диета обаче не променя процента телесно тегло на черния дроб (Таблица 1). За да се определи дали затлъстелите мишки са имали повишена атеросклероза, площта на атеросклеротичната лезия е количествено определена в низходящата аорта и аортния синус. Атеросклерозата беше значително увеличена и в двете места при мишки, хранени с HF диета (Фигура 1В, Р = 0,02; Фигура 1С, Р = 0,016; Допълнителна Фигура IA). Освен това, увеличеното наддаване на тегло корелира с увеличеното образуване на атеросклеротични лезии (допълнителна фигура IB; R 2 = 0,287; P = 0,001.
Храненето с високочестотна диета увеличава (A) наддаване на тегло и образуване на атеросклеротични лезии в (B) низходяща аорта и (C) аортен синус при апоЕ -/- мишки. Данните представляват средна стойност ± SEM (n = 22 - 26 мишки/група; *, означава P ≤ 0,001; P = 0,02; P = 0,016, съответно).
маса 1
Тегло на тялото и тъканите
| Тегло на тялото (начало, g) | 24,5 ± 0,5 | 23,8 ± 0,4 | NS |
| Тегло на тялото (завършващо, g) | 29,5 ± 0,7 | 40,1 ± 1,0 | P Фигура 2А). Консумацията на HF диета за 17 седмици не променя общите плазмени концентрации на триглицериди в сравнение с консумацията на LF диета (LF: 96 ± 31 срещу HF: 101 ± 25 mg/dl, p = NS); въпреки това, разпределението на триглицеридите сред липопротеините беше умерено увеличено във VLDL фракция от мишки, хранени с HF диета (Фигура 2В). Нещо повече, чернодробното съдържание на триглицеридите е повишено при мишки, хранени с HF диета (допълнителна фигура IIA). Въпреки това, чернодробната експресия на редица възпалителни гени не се променя в отговор на хранене с високочестотна диета в продължение на 17 седмици (допълнителна фигура IIB). Предишни проучвания показват, че нито западните, нито диабетогенните диети променят серумните концентрации на глюкоза при апоЕ -/- мишки (15). В подчертан контраст, концентрациите на глюкоза на гладно бяха значително повишени при мъжки апоЕ -/- мишки, хранени с HF диета в продължение на 17 седмици (LF: 103 ± 11 срещу HF: 147 ± 7 mg/dl; P Фигура 3А). Наблюдава се значително увеличение на площта под кривата (AUC) при мишки, хранени с HF диета, в сравнение с LF диета, показваща нарушен глюкозен толеранс при мишки, хранени с HF диета (Фигура 3В, P = 0,003). Тези данни предполагат, че затлъстяването поради консумация на високочестотна диета предизвиква непоносимост към глюкоза при мъжки апоЕ -/- мишки. |
Храненето с HF диета не променя разпределението на (A) холестерол липопротеини, но (B) увеличава разпределението на триглицеридите във VLDL при апоЕ -/- мишки. Данните представляват средна стойност ± SEM (n = 10 мишки/група).
Глюкозният толеранс се променя при апоЕ -/- мишки, хранени с високочестотна диета. А) Мишките се инжектират с 20% глюкозен разтвор (2 g глюкоза/kg телесно тегло) и нивата на глюкоза в плазмата се измерват с глюкомер на всеки 30 минути за период от 120 минути. B) AUC е измерена при отделни мишки. Данните представляват средна стойност ± SEM (п = 13 мишки/група). *, означава P = 0,003.
Систоличното кръвно налягане беше измерено през последната седмица на диетите и не се различаваше между двете групи мишки (LF: 118 ± 3 срещу HF: 113 ± 1 mm Hg, P = NS). Както се очакваше, концентрациите на лептин бяха увеличени при затлъстели HF-хранени мишки в сравнение с постни мишки (Таблица 2), въпреки че това не достигна статистическа значимост (P = 0,068). Въпреки това, както се очаква увеличението на телесното тегло е силно корелирано (R 2 = 0,9132; P Таблица 2). Въпреки това, серумните концентрации на SAA са значително повишени при мишки, хранени с HF диета в сравнение с LF диета (Фигура 4А). Изоелектричното фокусиране демонстрира, че и двете SAA с остра фаза (SAA1.1 и SAA2.1) са увеличени в серума от мишки, хранени с HF диета в сравнение с LF диета (Фигура 4В). Въпреки че SAA се извършва основно върху HDL, предишни проучвания предполагат, че диетите с високо съдържание на мазнини могат да насърчат преразпределение на SAA към проатерогенните липопротеини VLDL и LDL (9, 21, 22). В съгласие с тези констатации, анализът на Western blot демонстрира значително увеличение на съдържанието на SAA във VLDL и LDL фракции при мишки, хранени с HF диета (Фигура 4C).
Високочестотната диета увеличава (A) плазмените концентрации на SAA. Данните представляват средната стойност ± SEM (n = 22 - 26 мишки/група). *, означава P = 0,01. (B) IEF показва, че експресията на SAA 1.1 и 2.1 се увеличава в плазмата от мишки, хранени с високочестотна диета. Показани са представителни петна, като всяка лента представлява по една мишка от всяка група. (C) Имуноблот анализът показва, че SAA е силно свързан с VLDL и LDL в плазмата при мишки, хранени с високочестотна диета. Показани са представителни петна от една мишка от всяка група. Линиите бяха натоварени с еднакви аликвотни части (B) плазма и (C) FPLC фракции. (D) Имуноцитохимията показва, че SAA се локализира съвместно с biglycan и apoB. Показани са представителни съседни участъци от атеросклеротична лезия от апоЕ -/- мишки, хранени с високочестотна диета. (Увеличение 200 ×).
Таблица 2
Концентрации на серумен адипокин
| Лептин (ng/ml) | 5,1 ± 1,4 | 17,4 ± 3,4 | Р = 0,068 |
| Адипонектин (mg/ml) | 1,0 ± 0,5 | 1,1 ± 0,5 | Р = 0,181 |
| MCP-1 (pg/ml) | 27,4 ± 5,0 | 18,3 ± 4,6 | Р = 0,179 |
| IL-6 (pg/ml) | 26,3 ± 7,0 | 13,5 ± 2,0 | Р = 0,249 |
| TNF-α (pg/ml) | 5,5 ± 0,6 | 5,5 ± 0,5 | Р = 0,949 |
Наскоро демонстрирахме, че SAA стимулира синтеза на съдови протеогликани, повишава афинитета им на свързване с LDL и по-точно регулира бигликана (11). Предложихме, че това ще бъде про-атерогенно, тъй като се очаква повишеното съдържание на съдови протеогликани (бигликан) да доведе до повишено задържане на липопротеини (23–26). Съответно, имунохистохимичните анализи на атеросклеротични лезии показват съвместна локализация на SAA с бигликан и апоВ в рамките на атеросклеротични лезии от мишки, хранени с високочестотна диета (Фигура 4D).
Дискусия
Взети заедно, тези данни показват, че консумацията на високочестотна диета насърчава атеросклерозата, ускорена при затлъстяване при апоЕ -/- мишки, придружена от развитие на фенотип на метаболитен синдром. Подобно на хората, затлъстелите мишки развиват затлъстяване, нарушена глюкоза на гладно, нарушен глюкозен толеранс, умерена дислипидемия и повишени нива на възпалителния маркер SAA. Единствената основна характеристика на метаболитния синдром, липсващ в този модел, е тази на хипертонията. Плазмените концентрации на лептин се повишават при мишки, които са затлъстели, както се очаква, макар че това увеличение не достига статистическа значимост. По този начин, апоЕ -/- мишките, хранени с високочестотни диети, са животински модел на затлъстяване с ускорена атеросклероза.
Клиничните проучвания показват връзка между повишените нива на острата фаза SAA и CRP с повишен риск от сърдечно-съдови инциденти (32–34). CRP не е протеин с остра фаза при мишки, но SAA протеинът и mRNA са открити както при атеросклеротични лезии при хора, така и при мишки (35). Освен това, експресията на SAA тРНК е локализирана в гладкомускулни клетки, ендотелни клетки и макрофаги, получени от атеросклеротични плаки (35). Предишни проучвания демонстрират, че плазмените концентрации на SAA корелират с размера на атеросклеротичните лезии при мишки с хиперлипидемия (9, 21) и тази корелация не зависи от плазмените концентрации на холестерол. Въпреки че тези проучвания не доказват причинно-следствена роля на SAA в развитието и прогресията на атеросклерозата, те предполагат, че SAA може да играе основна роля.
По време на реакция на остра фаза черният дроб е основният източник на производство на SAA. Отговорът на острата фаза при хората води до асоциация на SAA предимно с HDL. Интересното е, че нашите данни показват, че голяма концентрация на SAA се свързва с проатерогенните липопротеини VLDL и LDL при апоЕ -/- мишки с индуцирано от диетата затлъстяване. Асоциацията на SAA с VLDL и LDL също се увеличава значително при мишки с дефицит на LDL рецептори, хранени с диети, обогатени с наситени мазнини (9, 22). Предлагаме, че повишеното преразпределение на SAA и SAA липопротеините, наблюдавано при HF-хранени мишки, може да допринесе за повишената атеросклероза, наблюдавана.
В обобщение, храненето на апоЕ -/- мишки с високочестотна диета, обогатена със свинска мас, предизвиква метаболитен фенотип, който се характеризира със затлъстяване, умерена дислипидемия, нарушен глюкозен толеранс и ускорена атеросклероза. Подобно на хората, увеличаването на затлъстяването и повишеното сърдечно-съдово заболяване е свързано с повишаване на плазмените концентрации на SAA. Спекулираме, че увеличаването на SAA и асоциирането на SAA с про-атерогенни липопротеини при затлъстели мишки допринася за увеличаване на наблюдаваното образуване на атеросклеротични лезии.
- Миши модел на вертикална втулка гастректомия
- Предсказващ модел за незавършване на интензивна специализирана услуга за затлъстяване в обществото
- Нова стратегия за предотвратяване на напреднала атеросклероза и по-ниска кръвна глюкоза в миши модел
- Преглед на миша с високо съдържание на мазнини като модел за захарен диабет тип 2
- Всичко от мен, документален филм за затлъстяването на PBS - The New York Times