Свързани термини:
- Пептид
- Триптофан
- Сулфат
- Бета-глюкозидаза
- Серотонин
- Метаболит
- Абсорбция на червата
- Бактериален свръхрастеж
- Абсорбция на бъбречни тубули
Изтеглете като PDF
За тази страница
Уремична токсичност
Михал Хмилевски,. Бенгт Линдхолм, в Хранително управление на бъбречната болест, 2013
Индол
До голяма степен в резултат на бактериално действие в червата, триптофанът се дезаминира и декарбоксилира, пораждайки редица метаболити (триптамин, индолицетна киселина, скатол, скатоксил, индол, индоксил, индикан и други). Открити са различни индоли в повишени концентрации в плазмата или в диализати на уремични пациенти [231] .
Индоксил сулфатът, най-разпространеното индолично съединение при уремични пациенти, е свързан с повишен оксидативен стрес [232], както и с инхибиране на ендотелната регенерация и възстановяване [233]. Също така изглежда, че стимулира прогресията на експерименталната гломерулосклероза [234] и се предлага да допринесе за сърдечно-съдови заболявания в хода на ХБН чрез увеличаване на експресията на междуклетъчна адхезионна молекула-1 (ICAM-1) и моноцитен хемотактичен протеин- 1 (MCP-1) в ендотел [235] .
Индоксил сулфатът, който е силно свързан с албумин, може да бъде отстранен чрез перорален адсорбент на базата на въглерод, както е показано при експериментални уремични плъхове [231 236], както и при пациенти с ХБН [237]. До известна степен се премахва и от CAPD [238]. Засега обаче няма доказателства, че намаляването на концентрацията на индоксил сулфат засяга бъбречната и/или преживяемостта на пациента [237 239 240] .
Установено е, че концентрацията на други индоли е повишена при ХБН [193]. Подобно на индоксил сулфата, се смята, че те допринасят за ендотелната дисфункция и за прогресирането на атеросклерозата в хода на ХБН [241,242] .
Хронична бъбречна болест: Патофизиология и влияние на диетичния протеин
Ароматни амини
Ароматните амини могат да допринесат за уремичната енцефалопатия, като служат като фалшиви невротрансмитери (538, 699). Инфузията на фенол или р-крезол при кучета води до различни неврологични симптоми, а конюгираните феноли могат да инхибират АТФази и йонни транспортни системи, което води до промени в вътреклетъчния йонен състав и ненормален клетъчен метаболизъм (710). Известно е, че р-крезолът може да инактивира β-хидроксилазата, ключов ензим в трансформацията на допамин в норепинефрин (236). P-крезолът също се свързва с намалено бактерицидно образуване на свободни радикали от активирани макрофаги (683) и намалява съдовата ендотелна функция (160, 161).
Натуропатична хидротерапия при лечение на фибромиалгия
Натуропатични перспективи
Конституционната система за хидротерапия е уникален натуропатичен подход към клиничните физиотерапевтични лечения. Основната цел на лечението е детоксикация на системата, имунно подобрение и подобрена храносмилателна функция. Съществуват и фокусирани лечения за справяне с местните патологични състояния.
Индиканните нива в урината са мярка за чревно гниене. Страничните продукти от чревното гниене, които се екскретират през бъбреците, вероятно се абсорбират чрез чревна циркулация. Цялата чревна циркулация влиза в порталната циркулация преди влизането в белодробната и след това системната циркулация. Вероятно са необходими пътища за детоксикация на черния дроб за окисляване/редукция и конюгиране на някои странични продукти от гниенето.
Повишеното специфично тегло на урината е показател за повишен капацитет на бъбреците да концентрира урината. Наблюдението на подобрени нива на индикатор в урината и повишени способности за концентриране на бъбреците сочат към адаптационните ползи от лечението и общите глобални ползи за организма.
Първичен хиперпаратиреоидизъм и други причини за хиперкалциемия при деца и юноши
ЕМИЛИ Л. ЖЕРМЕН-ЛИ, МАЙКЪЛ А. ЛЕВИН, в Паращитовидната жлеза (Второ издание), 2001
ВРЕДЕНИ ГРЕШКИ НА МЕТАБОЛИЗЪМ, КОИТО ПРИЧИНЯВАТ ХИПЕРКАЛЦЕМИЯ
Много вродени нарушения на метаболизма са свързани с хиперкалциемия. Синдромът на синята пелена се причинява от дефект в метаболизма на триптофана (70). Блокът в метаболизма на триптофана води до отделяне с урината на прекомерни количества производни на индол, включително производно, наречено „индикан“, което придава напоената с урина пелена син оттенък. Механизмът на хиперкалциемия при това разстройство е неизвестен.
Вроденият дефицит на лактаза може да причини хиперкалциемия през първите няколко месеца от живота. Седем от десет кърмачета, оценени с това състояние, са имали хиперкалциемия, а пет от седемте са с медуларна нефрокалциноза. Хиперкалциемията отзвучава след започване на диета без лактоза, но по-късно в детството (на възраст от 2 до 10 години) един от пациентите все още е имал хиперкалциурия, а трима от пациентите са имали нефрокалциноза (71). Етиологията на хиперкалциемията е неясна, но се смята, че е свързана с метаболитна ацидоза и/или увеличаване на абсорбцията на калций в червата вследствие на повишена чревна лактоза (71).
Синдромът на Бартър, дължащ се на хомозиготна инактивация в гена или за чувствителния към фуроземид Na/K/2C1 котранспортер NKCC2 (SLC12A1), или вътрешно коригиращия се калиев канал ROMK (KCNJ1) (72, 73), е рядка причина за неонатална хиперкалциемия, но по-често се свързва с хиперкалциурия (74, 75). Новороденото обикновено се проявява с повръщане, диария, треска и в резултат на това неуспех да процъфтява. Често се установява, че майките на тези бебета имат вътрематочна полихидрамнион, която се смята за вторична за феталната полиурия и ражда преждевременно.
Хипофосфатазията, наследствено състояние, което е резултат от недостатъчна активност на костната алкална фосфатаза, също може да причини хиперкалциемия (76–80). Хипофосфатазията се класифицира в четири форми: перинаталната хипофосфатазия е най-тежката форма и може да бъде летална вътреутробно или малко след раждането поради неадекватно образуване на гръден кош и череп. Кърмачетата живеят най-много няколко дни. Детската хипофосфатазия се проявява преди 6-месечна възраст и може да причини изразена хиперкалциемия. Калцият се отлага неадекватно в костите, което води до хиперкалциемия с хиперкалциурия и нефрокалциноза. Следва тежък рахит. Диагнозата може да бъде потвърдена чрез откриване на много високо ниво на фосфетаноламин в урината, както и рентгенографски доказателства за тежка деминерализация на костите и дефекти на ендохондралната осификация. Въпреки че няма известно лечение за това състояние, един пациент се е подобрил след серумни трансфузии, вероятно вторичен спрямо циркулиращ фактор, който активира алкалната фосфатаза на посттранскрипционно ниво (80).
IMAGe синдромът се състои от вътрематочно забавяне на растежа, метафизарна дисплазия и надбъбречна хипоплазия конгенита (81). Тримата пациенти, докладвани с този синдром, също са имали хиперкалциемия и/или хиперкалциурия, което е довело до нефрокалциноза при един пациент и пренатални калцификации на черния дроб и далака при друг. Генни мутации DAX1, които са свързани с вродена надбъбречна хипоплазия, обаче не са открити при тези трима пациенти. Нито молекулният дефект, нито основата за хиперкалциемия при този новоразпознат синдром не са идентифицирани.
Има няколко съобщения за хиперкалциемия, хиперкалциурия и нефрокалциноза при кърмачета и малки деца със синдром на Даун (81a-d). Първоначално се смяташе, че етиологията на хиперкалциемията е вторична по отношение на прекомерното преглъщане на краве мляко. Това обаче не е установено във всички случаи. Сега се смята, че хиперкалциемията е специфично свързана с генетичния дефект (и) на синдрома на Даун, въпреки че механизмът остава неясен.
Патофизиологията на Уремия
Индоли и други метаболити на триптофан
Индолите са съединения, съдържащи бензенов пръстен, кондензиран с петчленен азотсъдържащ пиролов пръстен (виж Фигура 18-1). Много прилики се срещат при разглеждането на индолите и фенолите в уремията. Както при фенолите, някои индоли се получават от растителни храни, а други се произвеждат ендогенно, но ендогенните индоли се получават най-вече от триптофан, докато фенолите се получават от фенилаланин и тирозин. Както при фенолите, незначителните химически модификации в различни комбинации дават забележително разнообразие от структури, с повече от 600 индола, получени от триптофан. 83 Тези с известна физиологична функция включват невротрансмитер 5-хидрокситриптамин (серотонин) и мелатонин. Други индоли се считат за отпадъчни продукти и често се конюгират преди отделянето на урина. Тези уремични индоли се натрупват в извънклетъчната течност, когато бъбречната функция е намалена.
Най-широко проучваният от уремичните индоли е индоксил сулфат или индикан. Indican се произвежда от триптофан по начин, напомнящ на производството на p-крезол сулфат от тирозин и фенилаланин. Чревните бактерии превръщат триптофана в индол, който след това се окислява до индоксил и се конюгира със сулфат в черния дроб. Има доказателства, че индиканът е токсичен in vitro, но ранните проучвания на индийската инфузия не успяват да възпроизведат уремичните симптоми. 7, 84 Подобно на р-крезол сулфат, индикан се свързва в голяма степен със серумния албумин и последните проучвания го използват като маркер за отстраняване на протеиновите разтворени вещества чрез бъбречно заместващи терапии. 74
Само малка част от хранителния триптофан се екскретира като индоли. Повечето от тях се метаболизират от кинурениновия път, който позволява на триптофана да се превърне в глутарат и да се окисли или, когато е необходимо, да се използва в синтеза на никотинамид. Бъбречната недостатъчност кара членовете на кинурениновия път, включително l-кинуренин и хинолинова киселина, да се натрупват в плазмата. 94, 95 Знанието, че тези вещества играят физиологична роля в модулацията на функцията на ЦНС, стимулира интереса към техния възможен принос за уремичната токсичност. Както обикновено обаче, не са получени доказателства, че те са токсични при нивата, срещани при уремични пациенти.
Нарушения на витамините и кофакторите
16.3 Ниацин (витамин В3)
Функционалните форми на ниацин включват никотинова киселина, никотинамид и всяко производно, което може да се превърне в никотинамид аденин динуклеотид (NAD) или никотинамид аденин динуклеотид фосфат (NADP). Следователно, ниацинът е от съществено значение за функционирането на всички клетки, тъй като NAD и NADP участват в безброй биохимични реакции, вариращи от гликолиза до биосинтеза на стероли. Дефицитът на ниацин води до пелегра (диария, дерматит, деменция и смърт), заболяване, което най-често се свързва с хранителни маргинални диети на основата на царевица, 49 поради ниската концентрация на свободен ниацин и триптофан в царевицата. In vivo триптофанът се превръща в ниацин и следователно неговият дефицит може също да доведе до развитие на пелегра. Пиридоксинът е кофактор, необходим за синтеза на ниацин от триптофан, така че дефицитът на пиридоксин също може да доведе до дефицит на ниацин.
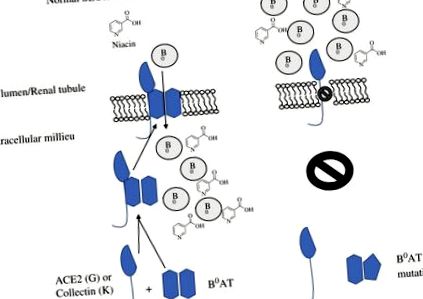
Въпреки че няма конкретно идентифицирани наследствени нарушения на биосинтеза на ниацин, дефицитът на ниацин може да бъде резултат от дефекти в SLC6A19, неутрален аминокиселинен транспортер, присъстващ в червата и бъбреците, който е отговорен за болестта на Hartnup. 50–52 При това разстройство натриево-зависимият транспортер не успява да абсорбира или реабсорбира неутрални аминокиселини, включително триптофан, което води до аминоацидурия и загуба на аминокиселини във фекалиите. 53 Неутралният аминокиселинен транспортер, B 0 AT1, изисква или колекрин (TMEM27) в бъбреците, или ангиотензин-конвертиращ ензим 2 (ACE2) в чревния тракт за стабилизиране на третичната структура и експресията на клетъчната повърхност. 54,55 Фиг. 16.3 показва абсорбцията и метаболизма на ниацин.
Фигура 16.3. Абсорбция и метаболизъм на ниацин. B 0 = неутрална аминокиселина. B 0 AT = неутрален аминокиселинен транспортер.
16.3.1 Диагностични тестове
Ако има клинични подозрения, диагнозата на болестта на Hartnup може да бъде направена чрез сравняване на профилите на аминокиселини в урината и плазмата. Урината трябва да има излишък от неутрални аминокиселини (Gln, Val, Phe, Leu, Asn, Ile, Thr, Ala, Ser, His, Tyr, Trp), цитрулин и индикан с ниски до нормални плазмени концентрации. Пролинът в урината, хидроксипролинът и аргининът не трябва да бъдат повишени, което разграничава болестта на Hartnup от другите форми на аминоацидурия. Докато натоварването с триптофан води до увеличаване на екскрецията на индол с урината, има генетични тестове за това автозомно-рецесивно разстройство. Нивата на ниацин в плазмата също могат да бъдат измерени чрез хроматографски техники.
16.3.2 Лечение
Лечението включва осигуряване на високо протеинова диета и добавки с ниацин.
16.3.3 Объркващи условия
Условия, които водят до лошо усвояване на триптофан и/или ниацин, могат да се проявят с подобни на пелегра симптоми. По този начин възпалителните заболявания на червата, алкохолизмът и продължителното лечение с изониазид също могат да се проявят по подобен начин. При децата възпалителното заболяване на червата с лоша абсорбция би било най-вероятната объркваща диагноза, въпреки че идентифицирането на неутрална аминоацидурия предполага, че болестта на Hartnup.
Нарушения на бъбречните тубули и бъбречнокаменна болест
Разстройство на Hartnup
Втори пример за аминокиселина, дължаща се на истински дефект в бъбречната тубулна функция, а не на ефект на „преливане“, се намира при разстройство на Hartnup. Това е кръстено на семейството, в което е описано за първи път и отново е дефект както на бъбречния, така и на чревния аминокиселинен транспорт. Постоянната характеристика е неуспехът да реабсорбира неутралните аминокиселини (каре 9.1) в бъбречните тубули, с последващото им появяване в урината. Неуспехът на реабсорбцията не е абсолютен, тъй като бъбречният клирънс на засегнатите аминокиселини обикновено е по-нисък от креатининовия клирънс. Повечето засегнати индивиди също имат повишени количества индоли (напр. Индикан) в урината, които произхождат от бактериалното разграждане на неабсорбирания триптофан в червата. Рядко бъбречните или чревните лезии могат да се появят самостоятелно.
Оригиналното описание на болестта на Hartnup включва пелагра-подобен кожен обрив, преходна церебеларна атаксия и постоянна бъбречна аминокиселина. Някои засегнати лица също са показали психотично поведение, докато други имат обучителни затруднения. Подобен на пелагра обрив и отговорът му към никотинамид предполагат, че клиничните характеристики на заболяването може да се дължат на неспособност да се абсорбира триптофан в червата и да се реабсорбира в бъбречните тубули, което води до дефицит на никотинамид. Въпреки това, изследването на братя и сестри на лица с болест на Hartnup и резултатите от скрининговите програми за урина на новородени урина предполагат, че типичната аминокиселина (разстройство на Hartnup) може да съществува без характеристиките на болестта на Hartnup. Изглежда, че разстройството на Hartnup е автозомно рецесивно наследствено състояние, но това не се изразява клинично без наличието на някои други генетични или екологични влияния, като лошо хранене. Причинителният ген, SLC6A19, е разположен на хромозома 5р15.33 и кодира за натриев зависим неутрален аминокиселинен транспортер.
Бъбречна функция
3 Уремични токсини като причина за аномалии при бъбречна недостатъчност
В обобщение, търсенето на „уремични токсини“ продължава без затихване; понастоящем въпросът е в състояние на относителна загадка.
МИКРОФЛОРА НА ЧРЕВА | Пробиотици
Доказателство за влияние на погълнатите бактерии
Максималният ефект от погълнатите пробиотични бактерии се получава, когато защитната местна флора е променена чрез диета, антибиотична терапия, болест или някои други фактори, както илюстрират следните примери.
Показано е, че нарушен баланс на чревната флора при 28 пациенти с левкемия се подобрява чрез поглъщане на 2 × 10 9 бифидобактерии и 2 × 10 9 L. acidophilus в 200 ml мляко дневно в продължение на 3 месеца. Брой на Klebsiella spp., Proteus spp., Candida spp. И Pseudomonas spp. в изпражненията намалява и нивата на индикан в урината и ендотоксин в кръвта намаляват в сравнение с пациентите, които не получават добавки.
Петнадесет пациенти (средно 2,5 години) са получавали антибиотици, като цефема, пеницилини и аминогликозиди, за лечение на септицемия и инфекции на дихателните пътища. По време на лечението се появи диария, която продължи 1-10 седмици. Броят на бифидобактериите намалява във фекалиите, а на Candida и Enterococcus се увеличава. Поглъщането на бифидобактерии и L. acidophilus подобрява честотата на изпражненията в рамките на 3-7 дни, заедно с възстановяването на чревната флора.
Полезните ефекти на пробиотиците могат да бъдат засилени чрез включване на специални съставки (пребиотици) и по този начин да се подобри здравето на гостоприемника.
Пробиотичните бактерии могат да повлияят на състава на чревната флора и/или нейната метаболитна активност през периода на поглъщане и известно време след това. Например:
Млякото, ферментирало с L. acidophilus, хранено при доброволци, намалява броя на Е. coli и увеличава броя на лактобацилите, но когато добавката спре, броят на бактериите се нормализира след 9 дни.
Пет здрави доброволци поглъщаха 3 × 10 9 B. longum дневно в продължение на 5 седмици; по време на хранене броят на бифидобактериите се е увеличил и този на клостридиите е намалял; в допълнение, нивата на амоняк и активността на бета-глюкуронидазата намаляват във фекалиите и серума.
Както вече споменахме, храненето с L. acidophilus на хора намалява активността на бета-глюкоронидаза, азоредуктаза и нитроредуктаза, но когато добавката спре, нивата на ензимите се нормализират след 4 седмици.
Трудно е да се постигне постоянна колонизация на погълнатите пробиотични бактерии. Въпреки това, поглъщането им непрекъснато или на редовни интервали може да осигури желаните ползи.