Липидният метаболизъм е от основно значение за функцията на бялата мастна тъкан, като тъканта има централна роля в съхраняването на триацилглицериди след хранене и освобождаване на свободни мастни киселини и моноацилглицериди по време на периоди на гладно.
Свързани термини:
- Инсулинова резистентност
- Липиди
- Мастна киселина
- Ензим
- Протеин
- Инсулин
- Холестерол
- Затлъстяване
Изтеглете като PDF
За тази страница
Концептуална основа и биоенергийни/митохондриални аспекти на онкометаболизма
Джулиет Голдсмит,. Джаянта Дебнат, в Методи в ензимологията, 2014
5.1.4 Липиди
Липидният метаболизъм се променя при рак - туморните клетки реактивират de novo липидния синтез, ATP-цитратната лиаза е необходима за трансформация in vitro, синтезът на холестерол при рак на простатата се увеличава и окисляването на мастните киселини е важен източник на енергия за раковите клетки на простатата (Santos & Schulze, 2012). Автофагията в специфичната форма на липофагия е важна за разграждането на липидните капчици в мастната тъкан (Singh & Cuervo, 2012), а автофагията регулира липидния метаболизъм в хепатоцитите, тъй като хидролизата на триглицеридите е нарушена в клетките Atg5 -/- (Singh et al., 2009). Дали тези процеси засягат туморния липиден метаболизъм изискват допълнително проучване.
Освен това автофагията влияе върху липидния метаболизъм, като променя митохондриалния номер. Atg7 изтрити, р53 мутантни клетки в модел, управляван от KRAS, имат вътреклетъчно натрупване на липиди поради повишена дисфункционална митохондрия, която компрометира окисляването на мастните киселини, което предполага, че автофагията е от решаващо значение за поддържане на липидния метаболизъм в KRAS и р53 мутантни клетки. Това предотвратява ефективния растеж на туморни клетки и ги превръща в липидни кисти вместо в тумори (Guo et al., 2013).
Болести на кръвоносната система
Анастасия П. Нестерова,. Антон Юриев, в „Пътища на заболяванията“, 2020 г.
Входящи сигнали
Липидният метаболизъм и преминаването на липопротеини с ниска плътност (LDL) извън артериалния лумен и в артериалната стена са основата за развитието на атеросклероза. LDL частиците се натрупват в съдовата стена и инициират образуването на атеросклеротична плака. Макрофагите интернализират LDL, стават разширени и пълни с липиди и след това се трансформират в пенообразни клетки. Части от пянестата клетка и умиращите макрофаги се натрупват в стените на съдовете, като по този начин участват в образуването на атеросклеротична плака.
Намалените нива на липопротеините с висока плътност (HDL) и холестерола са известни рискови фактори заедно с високите нива на LDL. HDL участва в транспорта на излишния холестерол от макрофагите и други клетки, така че е жизненоважен за намаляване на натрупването на пенести клетки при атеросклероза.
Метаболомика в сърдечно-съдовите изследвания
Липидомика
Липидният метаболизъм играе ключова роля за развитието на сърдечно-съдови заболявания. В продължение на десетилетия оценката на сърдечно-съдовия риск се основава на сравнително груби измервания на общия и HDL холестерол и триглицериди, допълнени с изчисления или директно измерен LDL холестерол. Както методите за метаболомика, базирани на NMR и MS, могат да осигурят много по-подробно липидно профилиране от методите, които се използват в момента. ЯМР се фокусира основно върху измерването на размера на липопротеиновите частици и техните липидни концентрации, докато MS измерва молекулярни липидни видове с голяма чувствителност (Soininen et al., 2015; Hinterwirth et al., 2014). Публикувани са някои обещаващи констатации (Alshehry et al., 2016; Stegemann et al., 2014), но в момента клиничната полза от по-прецизно профилиране на липидомиката все още трябва да бъде доказана.
Биохимия и метаболизъм на Toxoplasma gondii
Изабел Копънс,. Станислас Томаво, в Toxoplasma Gondii (Второ издание), 2014
Липиден метаболизъм 269
Мастни киселини 270 8.5.1.1
Биосинтетични пътища на мастни киселини - общи положения
Синтез на мастни киселини в токсоплазма 270
Спасяване на мастни киселини от токсоплазма 273
Глицерофосфолипиди 274 8.5.2.1
Биосинтетични пътища на фосфолипидите - общи положения 274
Състав на фосфолипидите и физиологично значение при токсоплазма 274
Синтез на фосфолипиди в токсоплазма 276
Повреда на фосфолипиди от токсоплазма 276
Глицеролипиди 277 8.5.3.1
Глицеролипидни биосинтетични пътища - общи положения 277
Синтез на глицеролипиди в токсоплазма 278
Стерили и стерилни естери 278 8.5.4.1
Биосинтетични пътища на стерол липиди - общи положения 278
Спасяване на стероли и транспорт в токсоплазма 279
Съхранение на стерол в токсоплазма 279
Сфинголипиди 280 8.5.5.1
Биосинтетични пътища на сфинголипиди - общи положения 280
Синтез на сфинголипиди в токсоплазма 280
Спасяване на сфинголипид от токсоплазма 281
Изопреноидни производни 282 8.5.6.1
Изопреноидни биосинтетични пътища - общи положения 282
Изопреноиден синтез в токсоплазма 282
Изопреноидно спасяване от токсоплазма 282
Модифициране на липидния метаболизъм (статини, холестерол)
Резюме
Лекарствата, модифициращи липидния метаболизъм, само през последните 20–30 години се превърнаха в едни от най-продаваните фармацевтични продукти за всички времена. Lipitor, лекарство за статини, остава наркотик номер едно за всички времена в началото на 2013 г. с продажби от над 100 милиарда долара. Въпреки че статините са най-разпространеното лекарство, модифициращо липидите, през последните години пазарите са спечелили други видове, включително ниацин, блокери на абсорбцията на мастни киселини и холестерол, фитостероли, инхибитори на протеиновия трансфер на холестерилестер и секвестранти на жлъчните киселини. Употребата на тези лекарства обикновено е за намаляване на нивата на липопротеини с ниска плътност, с вторични цели за намаляване или елиминиране на сърдечно-съдови заболявания. Токсикологичните профили на тези лекарства, особено на статините, са относително леки, независимо от широкото им използване, въпреки че появата на странични ефекти (като миопатия и загуба на паметта и други странични ефекти на централната нервна система) се увеличава, тъй като популацията използва клас се е увеличил.
Методи за биология на мастните тъкани, част Б
Лий Д. Робъртс,. Джулиан Л. Грифин, в Методи в ензимологията, 2014
Резюме
Регулиране на холестерола от лептин при алкохолна чернодробна болест
Balasubramaniyan Vairappan PhD, в „Молекулярни аспекти на алкохола и храненето“, 2016 г.
Основно участие на лептина за регулиране на липидния метаболизъм
Таблица 15.1. Ефекти на лептина върху различни ключови ензими на липогенезата, липолизата и FA окисляването и метаболизма на холестерола
| НАМАЛЕНА ЛИПОГЕНЕЗА | ||
| Инхибиране на ацетил-КоА карбоксилазата | Мускул | [106] |
| ИРНК на ацетил-КоА карбоксилаза ↓ | Преадипоцити, ендотелни клетки на аортата | [119] |
| MRNA на FA киселина синтаза ↓ | Адипоцити, черен дроб | [104 120 121] |
| ИРНК на глицерол-3-фосфат ацилтрансфераза (GPAT) ↓ | Островчета на панкреаса | [122 123] |
| УВЕЛИЧЕНА ЛИПОЛИЗА | ||
| МРНК, чувствителна към хормон липаза ↑ | Адипоцити | [121] |
| УВЕЛИЧЕНО ФА ОКИСЛЕНИЕ | ||
| ИРНК на ацил-КоА оксидаза ↑ | Адипоцити, панкреатични островчета | [104,122,123] |
| Карнитин палмитоил трансфераза-1 иРНК ↑ | Адипоцити, панкреатични островчета, аортни ендотелни клетки | [104,106,119–121] |
| Непряко дезинхибиране на карнитин палмитоилтрансфераза (неговият инхибитор малонил-КоА намалява в резултат на инхибиране на ацетил-КоА карбоксилазата) | Мускул | [104,106,119–121] |
| ЛИПОПРОТЕИН, ХОЛЕСТЕРОЛ И СИНТЕЗ НА ЖЛЪЧНИ КИСЕЛИНИ | ||
| Лецитин холестерол ацил трансфераза ↑ Липопротеинова липаза ↑ HMG-CoA редуктаза ↓ Естер синтаза на холестерол ↓ Хидролаза на холестеролов естер Холестерол 7а хидроксилаза | Плазма Сърце, черен дроб Сърце, черен дроб Сърце, черен дроб | [17–19,60] |
Таблица 15.2. Ефект на лептина и етанола върху чернодробния ген или ензимите, участващи в синтеза на холестерол и жлъчни киселини
| 3-хидрокси-3-метилглутарил-коензим А редуктаза | HMG-CoA редуктаза | Увеличен | Намалено | [60] |
| Естер синтаза на холестерол | CES | Увеличен | Намалено | [60] |
| Хидролаза на холестеролов естер | CEH | Намалено | Увеличен | [60] |
| Ацил-КоА холестерол О-ацил трансфераза | КОТКА | Повишено регулиране | Непроменен | [74 113] |
| Стерол регулаторен елемент, свързващ протеин | SREBP-2 | Увеличен | Намалено | [60] |
| Холестерол 7α хидроксилаза | CYP7A1 | Повишено/намалено | Повишено регулиране | [96,97,124] |
| Стерол 27-хидроксилаза | CYP27A1 | Непроменен | Повишено регулиране | [88,93,114,124] |
Захарен диабет при животни
Кетоацидотичен, хиперосмоларен или усложнен захарен диабет: патофизиология и клинични признаци
Най-честите исторически находки при котки и кучета с DKA са анорексия (61%), слабост, депресия и повръщане. 2 Резултатите от физикалния преглед могат да включват шок, депресия, тахипнея, дехидратация, слабост, повръщане и от време на време силна миризма на ацетон върху дъха. Котките могат да са в легнало или коматозно състояние; това може да е проява на смесен кетотичен хиперосмоларен синдром. При котки 33% проявяват клиничен иктер при представяне. 2
Дерегулация на клетъчната енергетика на раковите клетки
Метаболизъм на мастните киселини
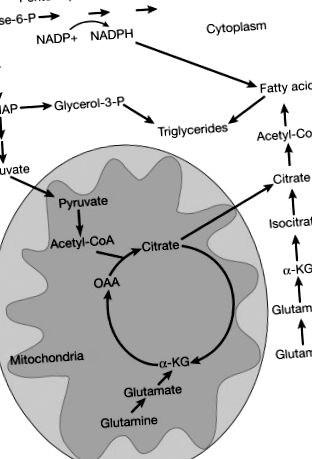
Липидният метаболизъм осигурява важни градивни елементи за клетъчната пролиферация, включително фосфолипиди и холестерол за образуването на клетъчна мембрана. Много ракови клетки проявяват високи нива на ново ново синтезиране на липиди, други видове рак катаболизират мастните киселини чрез бета-окисляване (т.е. някои видове рак на гърдата и рак на простатата), а подгрупи от видове рак могат да внасят мастни киселини от околната среда. И метаболизмът на глюкозата и глутаминът допринасят за синтеза на мастни киселини при рак чрез производството на цитрат чрез пируват и редуктивно карбоксилиране ( Фигура 4 ). Различни повтарящи се мутации при рак могат да препрограмират метаболизма на липидите ( Фигура 5 ).
Фигура 4. Глюкозата и глутаминът допринасят за липогенезата. Глюкозата допринася за синтеза на липиди чрез производството на цитрат, получен от пируват. Глутаминът може да произвежда цитрат чрез редуктивно карбоксилиране назад през TCA цикъла след превръщането на глутамин в глутамат и след това α-кетоглутарат (α-KG) или чрез производството на оксалоацетат (OAA), който може да кондензира с ацетил-КоА, за да образува цитрат. Глюкозата допринася за синтеза на мастни киселини чрез зависимото от PPP производство NADPH, което осигурява необходимата редуцираща мощност. Глюкозата допринася за производството на триглицериди от глицерол-3-фосфат, който се получава от гликолитичния междинен дихидроксиацетон фосфат (DHAP).
Фигура 5. mTORC1 (бозайник/механистична цел на рапамицин комплекс 1) се активира при много видове рак чрез повтарящи се мутации. Повтарящи се активиращи мутации в KRAS (V-Ki-ras2 Кирстен сарком на плъх вирусен онкогенен хомолог) и PI3K (фосфоинозитид-3-киназа), които активират AKT и mTORC1, често се срещат при много видове рак. Мутациите на загуба на функция в PTEN (фосфатаза и тензин хомолог), LKB1 (чернодробна киназа B1), AMP киназа и туберкулозен склерозен комплекс (TSC1/2) водят до активиране на mTORC1. Червените протеини периодично се инактивират при ракови заболявания. Зелените протеини се повтарят периодично при ракови заболявания. AKT подобрява гликолизата и липогенезата. mTORC1 увеличава индуцируемия от хипоксия фактор-1 алфа (HIF-1α) транслация, за да активира аеробна гликолиза, липогенеза и инхибира автофагията.
Много ракови клетки са способни да синтезират холестерол, който може да играе важна роля в синтеза на клетъчните мембрани и сигналните пътища, които изискват производни на холестерола. Синтезът на холестерол също е свързан с лекарствената резистентност на някои видове рак, като резистентност на някои видове рак на простатата към химическа или хирургична кастрация. Ацетил-КоА е важен предшественик за синтеза на холестерол. Ацетил-КоА може да се превърне в ацетоацетил-КоА чрез ACAT (ацетил-КоА ацетилтрансфераза), първата стъпка на синтез на холестерола. След това ацетоацетил-CoA се превръща в HMG-CoA (3-хидрокси-3-метилглутарил-CoA) и мевалонат чрез HMGCS (HMG-CoA синтаза) и HMGCR (HMG-CoA редуктаза), съответно. След това Mevalonate преминава през над 20 стъпки за образуване на холестерол, осигурявайки важен градивен елемент за бързо делящи се клетки.
Много видове рак, включително рак на простатата, разчитат на катаболизма на липидите, за да получат енергия. В процес, наречен липолиза, триглицеридите се разграждат до свободни мастни киселини от липази и след това до ацил-КоА от ензима ацил-КоА синтетаза. След това Acyl-CoA се транспортира в митохондриите с помощта на ензимите карнитин палмитоилтрансфераза (CPT) и след това се разгражда до ацетил-CoA чрез бета-окисление. Бета-окислението също произвежда NADH и FADH2, които могат да допринесат за производството на АТФ, като даряват електрони на електронната транспортна верига.
Експресията на гени за биосинтез на мастни киселини и холестерол се контролира от транскрипционния фактор стерол-свързващи протеини/фактори (SREBP/SREBF), кодирани от гените SREBP1 и SREBP2. SREBP1 кодира две изоформи, SREBP1a, която контролира синтеза на мастни киселини и холестерол и SREBP1c, която контролира гените за синтез на мастни киселини. Транскрипционният фактор SREBP2 контролира синтеза и усвояването на холестерола. SREBP1 и SREBP2 могат да бъдат активирани чрез mTORC1 сигнализиране, което води до повишена експресия на гени за липиден синтез при ракови заболявания с конститутивно активна mTORC1 сигнализация. Ролята на SREBP1 в растежа на раковите клетки едва започва да се разбира.