Международен изследователски екип е идентифицирал сигнални протеини, които действат в мозъчния хипоталамус, за да насочат развитието на невроналните вериги, които участват в контрола на теглото. Изследвания, ръководени от д-р Садаф Фаруки, FRCP, FMedSci, професор от университета в Кеймбридж, Великобритания, и д-р Себастиен Бурет, изследовател по ендокринология, диабет и метаболизъм в Детската болница в Лос Анджелис (CHLA), установиха редки мутации в гените за семафорини от клас 3 (SEMA3) при хора със силно затлъстяване. Последващите експерименти в култивирани клетки и проучвания върху генетично инженерни зебрафи и мишки показват, че медиираната от SEMA3 сигнализация задвижва развитието на меланокортинови вериги в хипоталамуса, които участват в енергийната хомеостаза.
„Сега открихме гените, които установяват точните невронни връзки, които формират тези вериги“, коментира д-р Агата ван дер Клаау, която ръководи проучването в лабораторията на Farooqi и която е съавтор на публикувания доклад на изследователите в Cell. „Тази работа дава нова представа за развитието на хипоталамусните вериги, които регулират апетита и метаболизма.“ Екипът описва своите изследвания и открития в статия, озаглавена „Вариантите на човешкия семафорин 3 свързват развитието на веригата на меланокортин и енергийния баланс“.
Невронните вериги в хипоталамуса играят решаваща роля в регулирането на енергийната хомеостаза, а меланокортиновите неврони играят „ключова“ роля в регулирането на теглото, пишат авторите. „Знаем, че мозъкът, по-специално област, наречена хипоталамус, има много важна роля в регулирането на приема на храна и кръвната захар“, обясни Бурет, който е и доцент по педиатрия в Медицинското училище в Кек в Университет на Южна Калифорния. Учените от години изучават ролята на хипоталамуса при затлъстяването, състояние, което сега засяга почти 14 милиона деца и юноши само в САЩ. Това, което учените все още не разбират, отбеляза Буре, е как се организират тези вериги в хипоталамуса. „Искаме да знаем как мозъкът се събира и какво точно управлява този процес.“ Разбирането как мозъчните клетки в хипоталамуса образуват силно специфични и сложни връзки и как този процес може да бъде нарушен, би могло осъществимо да даде представа за развитието на детското затлъстяване и хипоталамусните нарушения.
Семафорините от клас 3 участват в развитието на специфични подгрупи на невроните в хипоталамуса и вече е известно, че редки варианти на гени SEMA3, които нарушават сигнализирането, са свързани с хипогонадотропен хипогонадизъм при хората, състояние, при което тестисите и яйчниците произвеждат много малко, или няма полови хормони. Екипът предположи, че ако гените, кодиращи SEMA3s и техните рецептори допринасят за развитието на неврони, участващи в регулирането на телесното тегло при хората, тогава някои хора с тежко ранно затлъстяване могат да носят функционални варианти на тези гени.
Когато анализираха данните за секвениране от първоначален набор от 573 индивида с тежко затлъстяване в началото, те откриха 40 редки варианта в 13 гена, участващи в сигнализирането на семафорина. Установено е също, че тези много редки функционални варианти са обогатени в по-голяма кохорта от 982 тежко затлъстели индивида (които включват първоначалните 573 души) в сравнение с 4449 здрави контроли. Вариантите на сигнализиращия ген на SEMA3 действат, за да нарушат нормалната сигнализация чрез множество молекулярни механизми. „Много от вариантите на SEMA3 намаляват секрецията и/или медиираната от рецептора сигнализация“, отбелязват учените. Те признаха, че предвид рядкостта на вариантите, асоциациите не достигат статистическа значимост на единично генно ниво, така че ще са необходими сравнения в по-голям мащаб.
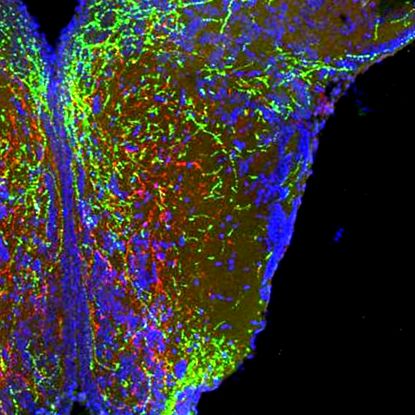
Семафорините действат като комуникационна система между мозъчните клетки, която може да се разглежда като нещо като пътна карта, която насочва клетките към или далеч от други клетки. За да види какво ще се случи, когато тази карта бъде инактивирана, д-р Софи Кройзиер, която ръководи работата в лабораторията на Буре, блокира сигнализирането на семафорин в лабораторно отгледани хипоталамусни клетки и установява, че мозъчните клетки вече не растат по начина, по който се предполага, и че връзките между клетките не успяват да се установят.
След това екипът използва технологията CRISPR, за да разруши някои от идентифицираните по-рано семафоринови сигнали, свързани с гени в много ранни ембриони от риба зебра. Тестовете показаха, че заличаването на седем от гените е свързано с животните, развиващи повишено телесно тегло и/или мазнини. По-нататъшни експерименти, използващи инженерни мишки, показват по подобен начин, че нарушаването на гените, свързани със сигнализирането на SEMA3, също води до увеличаване на теглото. „Това, което виждаме, е, че семафорините ръководят и оформят развитието на хипоталамусните вериги, които в крайна сметка регулират приема на калории“, обясни Бурет.
„В това проучване идентифицирахме редки хетерозиготни варианти на SEMA3s, техните рецептори и ко-рецептори при лица с тежко затлъстяване в началото“, заключават авторите. „При рибите зебра показахме, че заличаването на няколко гена по този път увеличава свързаните с теглото фенотипове, установявайки ролята на тези молекули в енергийната хомеостаза. Тези гени могат да модулират телесното тегло и/или мастната маса чрез няколко потенциални механизма ... Кумулативно, тези проучвания показват, че SEMA3-медиираната сигнализация задвижва развитието на хипоталамусните меланокортинови вериги, участващи в енергийната хомеостаза. "
- Нова проба използва ЯМР за изследване на затлъстяването и мозъчната сигнализация при деца на пулс
- Път за сигнализация при затлъстяване - креативна диагностика
- Метастатични мозъчни тумори; Информационни бюлетини; Йейлска медицина
- Подхранвайте мозъка си
- Родителите поставиха бебето на веганска диета, която беше толкова екстремна, че тя претърпя мозъчно увреждане - World News -