Герт Хьоке
1 Катедра по медицина, Отдел по ендокринология, Медицински център на Университета в Лайден, Post Zone C7Q, P.O. Box 9600, 2300 RC Leiden, Холандия; [email protected] (G.H.); [email protected] (P.P.S.J.K.); moc.liamg@nevednavttirb (B.v.d.V.); [email protected] (N.V.); [email protected] (I.M.); [email protected] (P.C.N.R.)
2 Лаборатория за експериментална съдова медицина в Айнтховен, П.О. Box 9600, 2300 RC Leiden, Холандия
П. Падмини С. Дж. Khedoe
1 Катедра по медицина, Отдел по ендокринология, Медицински център на Университета в Лайден, Post Zone C7Q, P.O. Box 9600, 2300 RC Leiden, Холандия; [email protected] (G.H.); [email protected] (P.P.S.J.K.); moc.liamg@nevednavttirb (B.v.d.V.); [email protected] (N.V.); [email protected] (I.M.); [email protected] (P.C.N.R.)
2 Лаборатория за експериментална съдова медицина в Айнтховен, П.О. Box 9600, 2300 RC Leiden, Холандия
3 Катедра по пулмология, Медицински център на Университета в Лайден, Лайден П.О. Box 9600, 2300 RC Leiden, Холандия; [email protected]
Janna A. van Diepen
4 Катедра по обща вътрешна медицина и Център за инфекциозни болести Radboud, Университет Radboud Nijmegen Medical Center, 6525 HP Nijmegen, Холандия; [email protected] (J.A.v.D.); [email protected] (R.S.); [email protected] (M.G.N.); moc.loa@333eranidc (C.A.D.)
Карин Пайк-Овързет
5 Катедра по имунохематология и кръвопреливане, Медицински център на Университета в Лайден, P.O. Box 9600, 2300 RC Leiden, Холандия; [email protected] (K.P.-O.); [email protected] (F.J.T.S.)
Брит ван де Вен
1 Катедра по медицина, Отдел по ендокринология, Медицински център на Университета в Лайден, Post Zone C7Q, P.O. Box 9600, 2300 RC Leiden, Холандия; [email protected] (G.H.); [email protected] (P.P.S.J.K.); moc.liamg@nevednavttirb (B.v.d.V.); [email protected] (N.V.); [email protected] (I.M.); [email protected] (P.C.N.R.)
Надя Вазирпанах
1 Катедра по медицина, Отдел по ендокринология, Медицински център на Университета в Лайден, Post Zone C7Q, P.O. Box 9600, 2300 RC Leiden, Холандия; [email protected] (G.H.); [email protected] (P.P.S.J.K.); moc.liamg@nevednavttirb (B.v.d.V.); [email protected] (N.V.); [email protected] (I.M.); [email protected] (P.C.N.R.)
Изабел Мол
1 Катедра по медицина, Отдел по ендокринология, Медицински център на Университета в Лайден, Post Zone C7Q, P.O. Box 9600, 2300 RC Leiden, Холандия; [email protected] (G.H.); [email protected] (P.P.S.J.K.); moc.liamg@nevednavttirb (B.v.d.V.); [email protected] (N.V.); [email protected] (I.M.); [email protected] (P.C.N.R.)
2 Лаборатория за експериментална съдова медицина в Айнтховен, П.О. Box 9600, 2300 RC Leiden, Холандия
Питер С. Хиемстра
3 Катедра по пулмология, Медицински център на Университета в Лайден, Лайден П.О. Box 9600, 2300 RC Leiden, Холандия; [email protected]
Франк Дж. Staal
5 Катедра по имунохематология и кръвопреливане, Медицински център на Университета в Лайден, P.O. Box 9600, 2300 RC Leiden, Холандия; [email protected] (K.P.-O.); [email protected] (F.J.T.S.)
Ринке Стиенстра
4 Катедра по обща вътрешна медицина и Център за инфекциозни болести Radboud, Университет Radboud Nijmegen Medical Center, 6525 HP Nijmegen, Холандия; [email protected] (J.A.v.D.); [email protected] (R.S.); [email protected] (M.G.N.); moc.loa@333eranidc (C.A.D.)
6 Отдел за човешко хранене, Университет Вагенинген, 6708 PB Вагенинген, Холандия
Михай Г. Нетеа
4 Катедра по обща вътрешна медицина и Център за инфекциозни болести Radboud, Университет Radboud Nijmegen Medical Center, 6525 HP Nijmegen, Холандия; [email protected] (J.A.v.D.); [email protected] (R.S.); [email protected] (M.G.N.); moc.loa@333eranidc (C.A.D.)
7 Катедра за геномика и имунорегулация, Институт за живота и медицинските науки (LIMES), Университет в Бон, 53113 Бон, Германия
Чарлз А. Динарело
4 Катедра по обща вътрешна медицина и Център за инфекциозни болести Radboud, Университет Radboud Nijmegen Medical Center, 6525 HP Nijmegen, Холандия; [email protected] (J.A.v.D.); [email protected] (R.S.); [email protected] (M.G.N.); moc.loa@333eranidc (C.A.D.)
8 Катедра по медицина, Университет в Колорадо, Аврора, CO 80045, САЩ
Патрик С.Н. Ренсен
1 Катедра по медицина, Отдел по ендокринология, Медицински център на Университета в Лайден, Post Zone C7Q, P.O. Box 9600, 2300 RC Leiden, Холандия; [email protected] (G.H.); [email protected] (P.P.S.J.K.); moc.liamg@nevednavttirb (B.v.d.V.); [email protected] (N.V.); [email protected] (I.M.); [email protected] (P.C.N.R.)
2 Лаборатория за експериментална съдова медицина в Айнтховен, П.О. Box 9600, 2300 RC Leiden, Холандия
Джими Ф.П. Берби
1 Катедра по медицина, Отдел по ендокринология, Медицински център на Университета в Лайден, Post Zone C7Q, P.O. Box 9600, 2300 RC Leiden, Холандия; [email protected] (G.H.); [email protected] (P.P.S.J.K.); moc.liamg@nevednavttirb (B.v.d.V.); [email protected] (N.V.); [email protected] (I.M.); [email protected] (P.C.N.R.)
2 Лаборатория за експериментална съдова медицина в Айнтховен, П.О. Box 9600, 2300 RC Leiden, Холандия
Резюме
1. Въведение
Атеросклерозата е хронично възпалително състояние, характеризиращо се с прогресивно натрупване на различни имунни клетки в артериалната стена [1]. Макрофагите са много важни играчи в развитието на атеросклерозата. В допълнение към натрупването на липиди, те са известни и с голяма пластичност във функция, варираща от противовъзпалителни до възпалителни фенотипове в зависимост от специфични стимули в атеросклеротичната плака [2]. Обширни изследвания са фокусирани върху характеризирането на про-атерогенни цитокини и рецептори, които задвижват прогресията на атеросклеротичните лезии (прегледани в [1]). Въпреки това, само ограничен брой проучвания са изследвали атеропротективния ефект на противовъзпалителните цитокини и техния терапевтичен потенциал като имуносупресивни медиатори по време на развитието на атеросклероза [3]. Досега противовъзпалителните медиатори интерлевкин (IL) -10 [4], трансформиращ растежен фактор (TFG) -β [5], IL-33 [6] и IL-1 рецепторен антагонист (IL-1ra) [7] са показали, че упражняват изразени анти-атеросклеротични и атеропротективни дейности при мишки.
Противовъзпалителният цитокин IL-37, известен преди като член на семейството IL-1 7 (IL-1F7), се появява като ендогенен супресор на вродените възпалителни и имунни отговори [8]. IL-37 принадлежи към семейството IL-1, което включва също, например, IL-1α IL-1β, IL-1ra, IL-18 и IL-33. При хората различни тъкани и клетъчни типове, включително кръвни моноцити [9], ендотелни клетки [10], адипоцити [11] и епителни клетки [12], експресират IL-37. Обаче миши хомолог все още не е открит. Транскриптът на IL-37 mRNA съдържа компонент на нестабилност, който се стабилизира при излагане на клетките на възпалителни стимули [13], стимулиращи повишени нива на експресия на протеини на IL-37 в отговор на напр. α [8]. Ефективността на IL-37 за потискане на възпалението е очевидна от експерименти in vitro, при които индуцирането на IL-37 значително намалява експресията на провъзпалителни цитокини и хемокини в моноцитни и макрофаги клетъчни линии [8,14].
IL-37 се състои от пет изоформи (т.е. IL-37a-e), от които IL-37b е най-разпространен [9]. Мишки с трансгенна експресия на човешки IL-37b (IL-37tg) бяха защитени от индуциран от липополизахарид (LPS) септичен шок и показаха намалени тъканни и системни нива на възпалителни цитокини в отговор на LPS [8] и индуциран от конканавалин А хепатит [15] ]. В допълнение, IL-37tg мишките са защитени от индуциран от декстран натриев сулфат (DSS) колит, както е показано чрез силно намалено възпаление и инфилтрация на дебелото черво на левкоцити, включително макрофаги. Интересното е, че мишки от див тип (WT), възстановени с костен мозък от мишки IL-37tg, също са защитени от DSS-индуциран колит, което показва, че хематопоетичната експресия на IL-37 е достатъчна за този защитен ефект [16].
Тези данни предполагат, че експресията на IL-37 в хематопоетичните клетки може да намали местния приток на клетки и секрецията на провъзпалителни цитокини при възпалителни заболявания, включително атеросклероза. Това се подкрепя допълнително от скорошно проучване, при което системното лечение с IL-37 е защитено от атеросклероза чрез модулиране на отговорите на имунните клетки [17]. Следователно целта на настоящото проучване е да се оцени дали трансгенната експресия на IL-37 в хематопоетични клетки инхибира натрупването на макрофаги в плаката и е достатъчна за защита срещу прогресирането на атеросклерозата. Трансплантирахме костен мозък от мишки WT или IL-37tg в мишки с дефицит на LDL рецептор (Ldlr⁻/⁻) и оценихме метаболитните и възпалителни параметри, както и размера и състава на атеросклеротичните лезии. Мишките са хранени с диета от западен тип (WTD), съдържаща 1% холестерол, за да предизвикат хиперлипидемия и нискостепенно системно възпаление. Ние демонстрираме, че хематопоетичната експресия на IL-37 умерено намалява възпалителния статус на хиперлипидемични мишки Ldlr⁻ /, но размерът на атеросклеротичната лезия или съдържанието на макрофаги в плаката остава непроменен.
2. Резултати
2.1. Експресията на хематопоетичен IL-37 не засяга метаболитните параметри
Човешки IL-37 се експресира селективно в хематопоетичните клетки, включително макрофаги, на мишки, склонни към атеросклероза Ldlr⁻/by чрез трансплантация на клетки от костен мозък от мишки IL-37tg. Като контрола, Ldlrd/⁻ мишките бяха трансплантирани с костен мозък от WT мишки. След период на възстановяване от девет седмици при редовна чау диета, хиперлипидемията се предизвиква чрез хранене на мишките с обогатена диета с висок холестерол от западен тип (WTD) (съдържаща 1% холестерол) в продължение на осем седмици. Костният мозък на Ldlrl/⁻ мишки, трансплантирани с IL-37tg клетки от костен мозък, експресира човешки IL-37 mRNA в края на проучването, докато не е откриваем при трансплантирани с WT мишки (данните не са показани), потвърждавайки успешното възстановяване на хематопоезата.
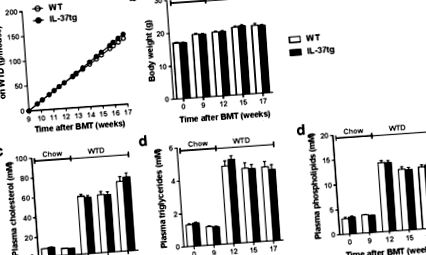
По време на проучването оценихме ефекта на експресията на хематопоетичен IL-37 върху метаболитните параметри. Експресията на хематопоетичен IL-37 не повлиява кумулативния прием на храна по време на периода на възстановяване (не е показан) или по време на WTD хранене (Фигура 1 а). Телесното тегло също не се различава между групите (Фигура 1 b). Освен това експресията на хемопоетичен IL-37 не повлиява плазмените концентрации на общия холестерол (Фигура 1 c), плазмените триглицериди (Фигура 1 d) или плазмените концентрации на фосфолипиди (Фигура 1 д) по време на проучването.
Успешната експресия на човешки IL-37 в хемопоетични клетки не влияе на метаболитните параметри. Ldlr⁻/⁻ мишките бяха трансплантирани с костен мозък от IL-37tg или контролни мишки от див тип (WT). След девет седмици възстановяване при редовна чау диета, мишките бяха хранени със западен тип диета (WTD) в продължение на осем седмици. Кумулативен прием на храна (а) телесно тегло (б) и 4-часови плазмени нива на холестерол на гладно (° С) триглицериди (д) и фосфолипиди (д) са били наблюдавани по време на проучването. Данните са изразени като средни стойности ± стандартна грешка на средната стойност (SEM); n = 14–15 на група. BMT, трансплантация на костен мозък.
2.2. Експресията на хематопоетичен IL-37 умерено намалява възпалителното състояние
След това оценихме ефекта на експресията на хематопоетичен IL-37 върху възпалителните параметри. Храненето с WTD увеличава плазмения sE-селектин в сравнение с храненето с чау, като по този начин потвърждава индуцирането на нискостепенно възпаление от WTD, но експресията на хематопоетичен IL-37 не намалява плазмения sE-селектин (Фигура 2 а). Проточната цитометрия на кръвните клетки обаче показва, че експресията на хемопоетичен IL-37 намалява броя на циркулиращите имунни клетки, както е видно от намалените циркулиращи гранулоцити (Фигура 2 b), неутрофилите (Фигура 2 c) и еозинофилите (Фигура 2 d) по време на WTD- хранене. В допълнение, общите Т-лимфоцити бяха намалени по време на хранене с чау и WTD (Фигура 2 д) и цитотоксичните Т-клетки бяха значително намалени по време на хранене с чау (Фигура 2 е). За разлика от това, експресията на IL-37 не повлиява помощните Т-клетки (Фигура 2 g) и регулаторните Т-клетки (Фигура 2 h). Въпреки че хематопоетичната експресия на IL-37 не повлиява процента на общите циркулиращи моноцити (Фигура 2 i) или Ly6C lo моноцити (Фигура 2 j), експресията на IL-37 намалява броя на новонабраните Ly6C hi моноцити (Фигура 2 k). Съотношението на Ly6C lo спрямо Ly6C hi моноцити не се увеличава значително (Фигура 2 I). Взети заедно, тези данни показват намалено възпалително състояние чрез хематопоетична експресия на IL-37.
2.3. Експресията на хематопоетичен IL-37 не засяга развитието на атеросклероза
Накрая оценихме дали намаленото възпалително състояние на експресията на хематопоетичен IL-37 ще отслаби развитието на атеросклероза. За тази цел определихме зоната на атеросклеротична лезия в областта на клапата на аортния корен на сърцето, както и състава на атеросклеротичните лезии след осем седмици на WTD хранене. Въпреки че зоната на атеросклеротичните лезии не е била засегната в аортния корен на сърцето (Фигура 4 а – с), експресията на IL-37 намалява съдържанието на гладките мускулни клетки в атеросклеротичните лезии (Фигура 4 d, g). Съдържанието на колаген (Фигура 4 e, h) и съдържанието на макрофаги (Фигура 4 f, i) остават непроменени между двете групи. Взети заедно, тези открития показват, че хематопоетичната експресия на IL-37 незначително влияе върху състава на лезията, без силен ефект върху размера на атеросклеротичната лезия.
Въпреки намаляването на възпалителното състояние на мишките, експресията на хемопоетичен IL-37 нито намалява размера на атеросклеротичните лезии, нито съдържанието на макрофаги в лезиите в настоящото проучване. Това е в привиден контраст с други скорошни проучвания, при които лечението с рекомбинантен IL-37 намалява развитието на атеросклероза при индуцирани от стрептозотоцин диабетни аполипопротеинови Е-дефицитни мишки (Apoe -/-) [25] и защитава WT мишки от индуцирана от ендотоксемия сърдечна дисфункция [ 26] и причинена от увреждане миокардна исхемия/реперфузионно увреждане чрез намаляване на възпалителното състояние [27]. Две причини могат да обяснят липсата на ефект на хематопоетичния IL-37 върху развитието на атеросклероза.
4. Материали и методи
4.1. Животни
4.2. Оценка на успешното възстановяване на костния мозък
В края на проучването костният мозък се изолира от пищяла и се определя хематологичен химеризъм, като се използва геномна ДНК чрез полимеразна верижна реакция (PCR) на 17 седмици след BMT, която се изолира с помощта на Gentra Pure Blood Kit (Qiagen, Venlo, The Холандия). Относителното присъствие на IL-37 в костния мозък беше оценено с помощта на праймери за човешки IL-37 (напред: 5′-CGATTCTCCTGGGGGTCTCTA-3 ′; обратен: 5′-CGGCGTGCTGATTCCTTTTG-3 ′).
4.3. Анализ на плазмен липид и системно възпаление
Кръв беше взета от опашната вена на 4 часа гладни мишки в посочените часови точки. След осем седмици WTD, проби от глад на кръв се събират чрез орбитално обезкръвяване в епруветки, покрити с етилендиаминтетраоцетна киселина (EDTA). Плазма от всички проби се изолира чрез центрофугиране и се анализира за общ холестерол, триглицериди (Roche Diagnostics, Манхайм, Германия) и фосфолипиди (Instruchemie, Delfzijl, Холандия), като се използват ензимни колориметрични комплекти. Плазмените нива на разтворим Е-селектин (sE-селектин) бяха определени с помощта на миши E-селектин ELISA комплект (R&D, Минеаполис, MN, САЩ). Всички анализи бяха направени съгласно протоколите на производителите.
4.4. Поточна цитометрия
Кръв се събира преди началото („чау“) и по време на храненето с WTD („WTD“) в епруветки, покрити с EDTA. След лизирането на общите еритроцити, подгрупите на Т-лимфоцитите, моноцитите и гранулоцитите бяха оценени чрез стандартен анализ на активирано флуоресцентно клетъчно сортиране (FACS). Клетките бяха оцветени, използвайки конюгирани с флуорохром моноклонални антитела за CD4 (eBioscience, Сан Диего, Калифорния, САЩ), CD8 (Biolegend, Сан Диего, Калифорния, САЩ), CD11b, CD25, Ly6G клон 1A8 и Ly6C (всички BD Pharmingen, Сан Диего, Калифорния, САЩ). Вътреклетъчното оцветяване с FoxP3 се извършва с помощта на комплект за оцветяване FoxP3 (eBioscience). Данните бяха получени на FACSAria или FACSCanto II (BD Biosciences, Сан Диего, Калифорния, САЩ) и анализирани с помощта на софтуера FlowJo (Treestar, Ashland, OR, USA). Данните са представени като процент от живите клетки.
4.5. Ex Vivo стимулация на перитонеални макрофаги
В края на проучването перитонеалните макрофаги бяха изолирани и стимулирани ex vivo с 10 ng · ml -1 липополизахарид на Escherichia coli (E. coli LPS; серотип O55: B5, Sigma Aldrich, Сейнт Луис, МО, САЩ), който беше допълнително пречиства се, както е описано в [30], или се държи във физиологичен разтвор като контрола за 24 часа. Концентрациите на хемоаттрактант на кератиноцити (KC) и IL-6 се определят в средата чрез търговски комплекти ELISA (Biosource, Camarillo, CA, USA) съгласно инструкциите на производителя.
4.6. Анализ на генната експресия
РНК се извлича от бързо замразени проби от черен дроб на мишка (приблизително 30 mg), като се използва реактив за изолиране на трипусна РНК (Roche) съгласно протокола на производителя. Общата РНК (1 μg) се транскрибира обратно, като се използва обратна транскриптаза на вируса на миша левкемия на Moloney (M-MLV) (Promega) за qRT-PCR, съгласно инструкциите на производителя за получаване на cDNA. експресията на тРНК се нормализира до експресия на р2-микроглобулин иРНК и се експресира спрямо WT мишки, използвайки метода ΔΔCt. Използваните последователности на грундовете са изброени в Таблица 1 по-долу.
- Какви са ефектите от веганска диета с ниско съдържание на мазнини върху функцията на панкреаса при наднормено тегло, без диабет
- Какви са ефектите от диета с ниско съдържание на протеини за възрастни без диабет с хронично бъбречно заболяване
- Оцеляване на киселите млечни бактерии в човешките черва
- Ефектът на централното затлъстяване върху възпалението, хепцидина и метаболизма на желязото при млади жени
- Оцелелият от нацистки експерименти с близнаци разговаря с лекари за изследване на хора - ScienceDaily