Шао-Жи Ху
Катедра по физиология, Медицински колеж, Университет Нанчанг, Нанчанг 330006, провинция Дзянси, Китай
Ша-Ша Джианг
Катедра по физиология, Медицински колеж, Университет Нанчанг, Нанчан 330006, провинция Дзянси, Китай
Джин Джанг
Катедра по физиология, Медицински колеж, Университет Нанчанг, Нанчанг 330006, провинция Дзянси, Китай
Дан Луо
Катедра по физиология, Медицински колеж, Университет Нанчанг, Нанчанг 330006, провинция Дзянси, Китай
Бо Ю.
Катедра по физиология, Медицински колеж, Университет Нанчанг, Нанчан 330006, провинция Дзянси, Китай
Лянг-Ян Ян
Катедра по физиология, Медицински колеж, Университет Нанчанг, Нанчанг 330006, провинция Дзянси, Китай
Хуа-Хуа Джун
Катедра по физиология, Медицински колеж, Университет Нанчанг, Нанчан 330006, провинция Дзянси, Китай
Мей-Уен Ян
Отделение за медицински сестри, Университетска болница в Нанчан, Нанчан 330006, провинция Дзянси, Китай
Ли-Ю Лиу
Отделение за медицински сестри, Университетска болница в Нанчан, Нанчан 330006, провинция Дзянси, Китай
Фен-Фанг Хонг
Експериментален учебен център, Университет Нанчанг, Нанчан 330031, провинция Дзянси, Китай
Шу-Лонг Ян
Катедра по физиология, Медицински колеж, Университет Нанчанг, Нанчанг 330006, провинция Дзянси, Китай. nc.ude.ucn@gnayls
Подкрепено от Националната фондация за естествени науки на Китай, № 81660151;, № 81660751; и № 81260504; Фондация „Наука“ към Научната комисия на провинция Дзянси в Китай, № 20161BBG70067; и Фондация за естествени науки на Китай провинция Дзянси, № 20171BAB205085 .
Автор-кореспондент: Shu-long Yang, професор, Катедра по физиология, Медицински колеж, Университет Nanchang, Nanchang 330006, провинция Jiangxi, Китай; nc.ude.ucn@gnayls
Резюме
Като необратим и многогодишен процес стареенето е придружено от функционални и морфологични спадове в органите. Като цяло, застаряващият черен дроб показва спад в обема и чернодробния кръвен поток. Дори и с изключителен регенеративен капацитет да възстанови функциите си след загуба на чернодробни клетки, способностите му за биосинтез и метаболизъм намаляват и те трудно могат да бъдат възстановени до предишните стандарти. Апоптозата е програмиран процес на смърт чрез вътрешни и външни пътища, в които участват протеини от семейство Bcl-2 и гени, свързани с апоптозата, като p21 и p53. Апоптозата оказва както благоприятно, така и неблагоприятно влияние върху стареенето на черния дроб. Апоптозата елиминира трансформирани анормални клетки, но насърчава свързаните с възрастта чернодробни заболявания, като неалкохолна мастна чернодробна болест, чернодробна фиброза, цироза и рак на черния дроб. Обобщаваме ролята на апоптозата при стареенето на черния дроб и свързаните с възрастта чернодробни заболявания.
Основен съвет: Стареещият черен дроб показва функционални и морфологични промени. Апоптозата елиминира трансформирани анормални клетки, но насърчава свързаните с възрастта чернодробни заболявания, като неалкохолна мастна чернодробна болест, чернодробна фиброза, цироза и рак на черния дроб. Апоптозата, включително вътрешни и външни пътища, има защитни и вредни ефекти върху стареенето на черния дроб. Появата, развитието и лечението на свързаните с възрастта чернодробни заболявания корелират силно със стареенето на черния дроб и апоптозата. Тази статия разглежда ефектите на апоптозата върху стареенето на черния дроб.
ВЪВЕДЕНИЕ
ПЪТОВЕ ЗА СИГНАЛИЗИРАНЕ НА КЛЕТКОВА АПОПТОЗА
Клетъчната апоптоза се медиира от извънклетъчни или вътреклетъчни каскадни сигнални пътища поотделно. Извънклетъчният път включва предимно специални лиганди, активиращи своите рецептори чрез вътрешни сигнални пътища. За разлика от това, вътреклетъчният път на апоптоза разчита на вътреклетъчни органели, като митохондрията и ER [17].
ИЗКЛЮЧИТЕЛЕН СИГНАЛЕН ПЪТ
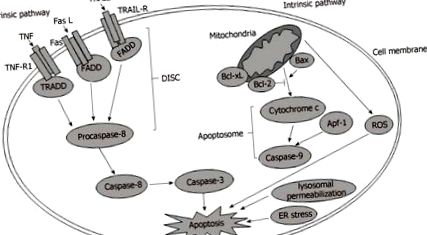
Свързването на извънклетъчните лиганди и съответните им рецептори върху плазмената мембрана е първата стъпка, чрез която се инициира клетъчна апоптоза в рамките на външния сигнален път. Тези рецептори са известни като рецептори на смъртта, включително рецептор на тумор некрозис фактор 1 (TNF-R1), свързан с TNF апоптоза индуциращ лиганд рецептор (TRAIL-R) и Fas [18]. Съответните извънклетъчни лиганди включват TNF-алфа (TNF-a), TRAIL и Fas лиганд. Когато смъртните рецептори се активират от техните лиганди, настъпват конформационни промени на рецепторите на смъртта и се образува триполимер. Освен това активираните рецептори набират молекули на цитоплазмен адаптер, включително свързан с Fas протеин, съдържащ домен на смърт, и домен на смърт, свързан с TNFR [19]. Освен това се набират и сигнални молекули за апоптоза. След това адаптерните молекули се свързват с молекули, сигнализиращи апоптоза, за да образуват комплекс, наречен смъртоносен сигнален комплекс (DISC) [20]. В крайна сметка DISC води до активиране на каспаза-8, а каспаза-8 активира палачи каспази, като каспаза-3, за да предизвика апоптоза [21].
ВЪТРЕШЕН СИГНАЛЕН ПЪТ
В рамките на вътрешния път, дисфункцията на органелите предизвиква апоптоза от различни гледни точки. Например лизозомната пермеабилизация, ER стресът, митохондриалната дисфункция и смущението на други органели участват в апоптозата [22]. Сред тези органели митохондрията е главният герой в инициирането и прогресирането на апоптозата [23]. Митохондриалната дисфункция индуцира отварянето на митохондриална пропусклива пора за пропускливост (mtPTP), което позволява освобождаването на про-апоптотични протеини, като цитохром с, от митохондриалното междумембранно пространство в цитоплазмата. Впоследствие с участието на цитохром с, фактор за активиране на апоптотичен протеин-1 и каспаза-9 се образува комплекс, известен като апоптозома, който активира ефектор каспаза-3 надолу по веригата, за да индуцира апоптоза (Фигура (Фигура 1 1) [24, 25].
Вътрешни и вътрешни пътища при чернодробна апоптоза. ROS: Реактивни кислородни видове; ER: ендоплазмен ретикулум; TNF-R1: Рецептор на тумор некрозис фактор 1; TRAIL-R: Тумор некротичен фактор, свързан с апоптоза индуциращ лиганд рецептор; DISC: Сигнализиращ комплекс, предизвикващ смъртта.
Митохондрията се регулира пряко или наклонено от протеини от семейство Bcl-2, които могат да бъдат разделени на три групи: проапоптотичните многодоменни протеини, състоящи се от Bax, Bak и Bok; проапоптотичните само BH3 протеини, като Bad; и антиапоптотичните мултидоменни протеини, включително Bcl-2, Bcl-XL и Bcl-W [26,27]. С допълнителни проапоптотични протеини, съотношението на апо-апоптотични протеини към анти-апоптотични протеини, като Bax/Bcl-2, се увеличава значително, което причинява клетъчна апоптоза [28]. Митохондриалната дисфункция води до генериране на ROS, които се пораждат предимно от разгърнатата електронно-транспортна верига и прекомерния стрес в митохондрията [29]. Като се има предвид, че по-голямата част от кислорода се консумира в ми-тохондрия, митохондрията определя генерирането на повечето свободни радикали кислород и хидропероксиди. Като се има предвид, че митохондриалната дисфункция допринася за претоварването на ROS, прекомерното количество на ROS е вредно и води до липотоксичност, ДНК лезии и увреждане на протеините [30,31].
ЗАЩИТНИ ЕФЕКТИ НА АПОПТОЗАТА ВЪЗСТОЯВАНЕ НА ЧЕРНИЯ ЧЕРЕН ЧЕРЕН
Елиминиране на трансформирани клетки
При физиологични условия вътрешната чернодробна апоптоза се увеличава с възрастта [32]. Когато са изложени на генотоксини от ежедневната диета и свободните радикали, наранените хепатоцити могат да образуват неоплазия без достатъчно самоочистване поради увреждане на ДНК [33]. За щастие, апоптозата своевременно елиминира анормалните клетки, за да се избегне злокачествена промяна и да се запази хомеостазата. За разлика от анормалните клетки, нормалните чернодробни клетки се размножават и се обновяват, като по този начин поддържат своята основна физиологична функция [34]. Giorgadze et al [35] оценяват ефектите на възрастта върху апоптозата на хепатоцитите и пролиферацията при мъжки плъхове при физиологични условия. Резултатите от тях предполагат, че при възрастните плъхове количеството полиплоидни ядра в чернодробните клетки е драстично високо в сравнение с това при млади плъхове. Полиплоидните клетки обаче показват по-малко възможности за оцеляване в сравнение с чернодробните клетки. Ако са налице прекомерни полиплоидни клетки и липсват обновяващи се клетки, може да възникне неуспех по време на увреждане на черния дроб. Като се има предвид, че полиплоидните клетки се елиминират чрез апоптоза, за да се избегне чернодробна недостатъчност, се счита, че апоптозата защитава стареенето на черния дроб.
Спад на оксидативен стрес
Теорията за стареенето на свободните радикали е предложена за първи път от Харман през 1956 г., в която се смята, че оксидативният стрес е свързан със стареенето в непосредствена близост [36]. По време на стареенето на черния дроб прекомерният оксидативен стрес генерира ROS, които нарушават баланса между окислителните и антиоксидантните процеси и предизвикват увреждане на черния дроб. Умерената апоптоза може да поддържа чернодробна хомеостаза чрез прочистване на трансформирани клетки. Въпреки това, прекомерният оксидативен стрес предизвиква прекомерна апоптоза, нарушава чернодробната функция и ускорява стареенето на черния дроб [37]. Следователно, разрешаването на оксидативния стрес може да бъде валидна стратегия за намаляване на апоптозата и за защита на черния дроб от ROS претоварване.
Калорично ограничение
ДЕЛЕТЕРИЙНИ ЕФЕКТИ НА АПОПТОЗАТА ОТ СТАРЕНЕТО НА ЧЕРНИЯ ЧЕРЕН ЧЕРЕН
Митохондриална дисфункция
Натрупване на желязо и сфинголипиди
По време на стареенето натрупването на различни вредни промени уврежда чернодробните функции на запазване на хомеостазата [62]. Почистващата способност на черния дроб намалява с остаряването, което предизвиква натрупването на различни вредни материали, като желязо и сфинголипиди. Отлагането на желязо, резултат от процеса на стареене, води до излишък на желязо, като по този начин увеличава концентрацията на реактивни кислородни и азотни форми и причинява токсичността на супероксида и нарушаване на антиоксидантния капацитет на NO [63,64]. В стареещите чернодробни митохондрии натрупването на не-хем желязо подобрява отварянето на mtPTP, което променя мембранната пропускливост и дори причинява освобождаването на разнообразни сигнални трансдукционни молекули, които в крайна сметка индуцират митохондриална дисфункция и окислително увреждане [65].
Дефект на апоптозата
Дефект в апоптозата нарушава антиапоптотичната и проапоптотичната хомеостаза и постепенно причинява тежка органна дисфункция. Като част от семейството на цистеин протеаза, каспаза-2 участва в апоптозата и може да се активира чрез сигнали, свързани с оксидативен стрес. При стареенето на черния дроб на бозайници черният дроб с дефицит на каспаза-2 притежава повишено съдържание на окислени протеини в сравнение с дивия тип черен дроб, което предполага, че дейността по елиминиране на увредените клетки е нарушена. В допълнение, дефицитът на каспаза-2 може да предизвика апоптоза чрез въздействие върху палача каспаза-3 и след това да предизвика нарушение на апоптозата [76]. Тук обобщаваме систематично ефектите на апоптозата върху стареенето на черния дроб на Фигура Фигура2 2 .
Ефекти от процеса на апоптоза върху стареенето на черния дроб. ER: ендоплазмен ретикулум; DISC: Сигнализиращ комплекс, предизвикващ смърт; ROS: Реактивни кислородни видове; CR: Ограничение на калориите; NAFLD: Безалкохолна мастна чернодробна болест; HSC: Чернодробни звездни клетки.
ЕФЕКТИ НА АПОПТОЗАТА НА ВЪЗРАСТНИ ЧЕРННИ БОЛЕСТИ
NAFLD
Излишните липиди могат да се прехвърлят от наситена бяла мастна тъкан в не-мастни тъкани, като черния дроб, и да навлязат в неоксидативни пътища, където се произвеждат токсичните реактивни липидни видове. Липотоксичността, индуцирана от реактивни липиди, в крайна сметка може да доведе до апоптоза в черния дроб [77]. NAFLD, което се характеризира със значително натрупване на липиди, като триглицериди, свободни мастни киселини, холестерол и фосфолипиди, се счита за най-често срещаното хронично чернодробно разстройство [78,79] (Фигура (Фигура 3). 3). NAFLD се състои от широк спектър от чернодробни заболявания от доброкачествена чернодробна стеатоза до неалкохолен стеатохепатит (NASH), напреднала фиброза, цироза и дори хепатоцелуларен карцином [80,81].
Причини и лечение на безалкохолна мастна чернодробна болест. NAFLD: Безалкохолна мастна чернодробна болест; ER: ендоплазмен ретикулум; КАТ: Каталаза; UPR: Разгънат протеинов отговор.
Чернодробна фиброза
По време на трайно увреждане на черния дроб, фиброзата на черния дроб е резултат от дисбаланса на производството и разграждането на извънклетъчния матрикс (ECM). След като фиброгенезата надвиши фибролизата, ECM се отлага и води до чернодробна фиброза. В действителност, при прекомерна ECM, чернодробната фиброза е резултат от хронични чернодробни инсулти, като NASH и вирусен хепатит [101]. При развитието на чернодробна фиброза активирането на чернодробни звездни клетки (HSC) и други миофибробластни клетки е основният механизъм във фиброгенезата. Хепатоцитите демонстрират значително нарушена регенерация и след това се заменят с ECM, когато са изложени на хронично увреждане [102]. По този начин активирането на HSC и апоптозата на хепатоцитите участват в появата на чернодробна фиброза [76].
Цироза
От хистологична перспектива цирозата е структурирана от регенеративни възли, които са обградени от фиброзни ленти и се разглежда като напреднал стадий на чернодробна фиброза [114]. За някои пациенти NASH и вирусът на хепатит С са два рискови фактора за цироза [115,116]. Първоначалните клинични прояви на цироза са нарушения на чернодробната васкулатура, като портална хипертония, а терминалната цироза се характеризира със сериозни усложнения като чернодробна енцефалопатия [117].
Теломерите повтарят хексануклеотидни последователности и могат да поддържат стабилността на хромозомите, като избягват хромозомно сливане в края. По време на стареенето на черния дроб настъпва съизмерима загуба на дължината на теломерите с напредването на стареенето [118]. Wiemann et al [119] установяват, че теломерите при цироза се съкращават по-значително, отколкото при проби, които не са цироза. По-специално, при чернодробната цироза съкращаването на теломерите е по-очевидно в хепатоцитите, отколкото в звездните клетки, а стареенето и съкращаването на теломерите на хепатоцитите са тясно свързани с прогресирането от фиброза до цироза. В стадия на цироза съкращаването на теломерите ограничава капацитета за обновяване на хепатоцитите, като задейства пътя p53/p21, който повишава апоптозата на хепатоцитите, като по този начин ускорява развитието и прогресирането на цирозата [120,121]. Освен това, ER стресът включва образуването на цироза. Свързани със стреса протеини на ER, включително ензим 1, който изисква инозитол и хомоложен протеин C/EBP, се активират и индуцират апоптоза при цироза [122].
Прогресията от цироза към хепатоцелуларен карцином е сложен и дългосрочен процес, чийто механизъм все още не е ясен, но може да включва тясно връзката между апоптозата на клетките и цирозата [123]. Xu et al [124] откриват, че при индуцирана от диетилнитрозамин чернодробна цироза на плъх, чернодробните овални клетки се активират и пролиферират под стимулацията на апоптоза на хепатоцитите, което може да бъде основният двигател в еволюцията от цироза до хепатоцелуларен карцином.
Рак на черния дроб
Канцерогенезата е неотделима от апоптозата и клетъчното стареене. Апоптозата и стареенето обикновено са два полезни механизма за потискане на прогресията на рака, но могат да бъдат обърнати към вредни на по-късен етап от рака [125]. След 40-годишна възраст появата на хепатоцелуларен карцином нараства постепенно с възрастта, но намалява на около 70-75 години [126]. При стареенето на черния дроб предимно апоптозата се характеризира с смущения и дисбаланс в регулацията. По този начин поддържането на стабилността на броя на хепатоцитите и запазването на чернодробните функции както преди е много трудно. Продължаването на този процес допълнително намалява апоптозата постепенно и увеличава честотата на рак на черния дроб. Самата апоптоза може да елиминира анормалните клетки в черния дроб. Ако апоптозата е прекомерно потисната и анормалните чернодробни клетки не могат да бъдат елиминирани своевременно, тези анормални клетки могат да станат ракови и в крайна сметка да доведат до рак на черния дроб [33]. Агонистите на активирания от пероксизома пролифератор рецептор-алфа (PPARα), като пролифераторите на пероксизом, могат да потиснат апоптозата на хепатоцитите [127]. Чрез понижаване на регулацията на експресията на Bax иРНК и Fas иРНК и намаляване на нивото на каспаза-2, активираният PPARα потиска чернодробната апоптоза, което може да насърчи генерирането на рак на черния дроб [128].
ЗАКЛЮЧЕНИЕ
Черният дроб е незаменим орган с редица функции, включително синтез на протеини и детоксикация, а неговите функции и състояние са от решаващо значение за човешкото здраве в дългосрочна перспектива. Стареенето на черния дроб е естествен и спонтанен процес с физиологични спадове и морфологични промени [1,2]. Вътрешните и външните пътища са два основни механизма, участващи в апоптозата и могат да постигнат синергични ефекти при някои случаи [13]. При стареенето на черния дроб апоптозата се оприличава на нож с две остриета: прекомерната апоптоза причинява загуба на чернодробни клетки, което лесно може да доведе до чернодробна недостатъчност, докато недостатъчната апоптоза може да доведе до натрупване на анормални клетки, което може да доведе до генерирането на злокачествени клетки [ 133].
Бележки под линия
Изявление за конфликт на интереси: Авторите нямат конфликти на интереси в тази работа.
Източник на ръкописа: Непоискан ръкопис
Рецензията започва: 26 ноември 2018 г.
Първо решение: 12 декември 2018 г.
Статия в пресата: 26 януари 2019 г.
Тип специалност: Медицина, изследователска и експериментална
Страна на произход: Китай
Класификация на доклада за партньорска проверка
Степен А (отличен): 0
Степен B (много добър): B, B
Степен C (Добър): C, C
P-рецензент: Cheng TH, Demonacos C, Gassler N, Sugimura H S-редактор: Wang JL L-редактор: Wang TQ E-редактор: Wu YXJ
Информация за сътрудника
Shao-Jie Hu, Катедра по физиология, Медицински колеж, Университет Nanchang, Nanchang 330006, провинция Jiangxi, Китай.
Sha-Sha Jiang, Катедра по физиология, Медицински колеж, Университет Nanchang, Nanchang 330006, провинция Jiangxi, Китай.
Джин Джанг, Катедра по физиология, Медицински колеж, Университет Нанчанг, Нанчан 330006, провинция Дзянси, Китай.
Дан Луо, Катедра по физиология, Медицински колеж, Университет Нанчанг, Нанчан 330006, провинция Дзянси, Китай.
Бо Ю, Катедра по физиология, Медицински колеж, Университет Нанчанг, Нанчан 330006, провинция Дзянси, Китай.
Liang-Yan Yang, Катедра по физиология, Медицински колеж, Университет Nanchang, Nanchang 330006, провинция Jiangxi, Китай.
Hua-Hua Zhong, Катедра по физиология, Медицински колеж, Университет Nanchang, Nanchang 330006, провинция Jiangxi, Китай.
Mei-Wen Yang, отделение за медицинска сестра, Университетска болница Nanchang, Nanchang 330006, провинция Jiangxi, Китай.
Li-Yu Liu, Отделение за медицинска сестра, Университетска болница Nanchang, Nanchang 330006, провинция Jiangxi, Китай.
Fen-Fang Hong, Експериментален учебен център, Университет Нанчанг, Nanchang 330031, провинция Дзянси, Китай.
- Ефекти от кетогенна диета върху мастната тъкан, черния дроб и серумните биомаркери при заседнали плъхове и
- Ефекти на омега-3 мастната киселина при безалкохолната мастна чернодробна болест Мета-анализ
- Полза от масло от черен дроб на треска, ползи, странични ефекти, дозировка и взаимодействия
- Естрогенът предпазва от ефектите на мастния черен дроб MedPage днес
- Ефекти на полипептида от кадифени рога върху сексуалното поведение и синтеза на тестостерон при застаряващ мъж