Лаборатория по молекулярна и клетъчна медицина, Отдели за клетъчни и физиологични науки и хирургия, Институт по науки за живота, Университет на Британска Колумбия, Ванкувър, Британска Колумбия, Канада;
Лаборатория по молекулярна и клетъчна медицина, Отдели за клетъчни и физиологични науки и хирургия, Институт по науки за живота, Университет на Британска Колумбия, Ванкувър, Британска Колумбия, Канада;
Катедра по вътрешни болести, Медицински колеж в Сеул, Сеул, Южна Корея; и
Лаборатория по молекулярна и клетъчна медицина, Отдели за клетъчни и физиологични науки и хирургия, Институт по науки за живота, Университет на Британска Колумбия, Ванкувър, Британска Колумбия, Канада;
Секция по стомашно-чревна метаболитна хирургия, Катедра по хирургия, Медицински колеж Weill на Университета Корнел-Ню Йорк, Пресвитерианска болница, Ню Йорк, Ню Йорк
Лаборатория по молекулярна и клетъчна медицина, Отдели за клетъчни и физиологични науки и хирургия, Институт по науки за живота, Университет на Британска Колумбия, Ванкувър, Британска Колумбия, Канада;
Адрес за заявки за повторно отпечатване и друга кореспонденция: T. J. Kieffer, Катедра по клетъчни и физиологични науки, Институт за науките за живота, Унив. на Британска Колумбия, 2350 Health Sciences Mall, Ванкувър, Британска Колумбия, Канада V6T 1Z3 (имейл: [имейл защитен]).
Резюме
Въпреки че точният механизъм на подобрената глюкозна хомеостаза след байпасна процедура е до голяма степен неуловим, промяна в ентероендокринната система, състояща се от ентероинсуларната ос или инкретините, в момента се счита за най-правдоподобното обяснение (26, 39, 47). В това отношение ентероендокринните клетъчни популации могат да бъдат променени след байпас хирургия, тъй като е известно, че анатомичната и физиологичната пластичност на стомашно-чревната лигавица протича при няколко състояния, включително бариатрична хирургия (21, 23, 26, 37, 42). Доколкото ни е известно, все още няма доклади, изследващи популацията на ентероендокринните клетки след бариатрична хирургия. Поради това изследвахме ефекта на DJB върху дългосрочния гликемичен контрол, нивата на инкретин в плазмата, масата на β-клетките, фиброзата на островчета и промените в ентероендокринните клетъчни популации при плъхове Goto-Kakizaki (GK), добре познат животински модел за nonobese диабет тип 2, получен от колония на плъхове Wistar.
Животни.
Мъжки 9-седмични плъхове GK са закупени от Taconic (Hudson, NY), а мъжки 6-седмични плъхове Wistar са закупени от Центъра за грижа за животните на Университета на Британска Колумбия (Ванкувър, Британска Колумбия, Канада). Всички животни бяха настанени в отделни клетки при постоянна околна температура и влажност при 12: 12-часов цикъл светлина-тъмнина и хранени със стандартна чау-чау (LabDiet 5012; PMI Nutrition International, Brentwood, MO) по време на проучването. Всички проучвания са одобрени от Комитета за грижа за животните към Университета на Британска Колумбия и са проведени в съответствие с насоките на Канадския съвет за грижа за животните.
Хирургични интервенции и наблюдение.
Тест за орален глюкозен толеранс и интраперитонеален глюкозен толеранс.
След гладно през нощта се извършва или орален тест за толерантност към глюкоза (OGTT) или интраперитонеален тест за толерантност към глюкоза (IPGTT), като се използва 40% разтвор на глюкоза (1 g/kg). Нивата на глюкоза от кръвни проби от опашната вена бяха измерени с помощта на глюкомер (One Touch Ultra) на 0, 10, 20, 30, 60, 120 и 180 минути след прилагане на глюкоза. В същото време се събира кръв (0,25 ml) с хепаринизирани капилярни епруветки от вената на опашката, прехвърля се в епруветки за микроцентрифугиране и се центрофугира преди плазмените проби да се съхраняват при -20 ° C до хормонални анализи. Площта под кривата (AUC) на глюкозата се изчислява по трапецовиден метод.
Тест за толерантност към смесено хранене.
Извършен е тест за толерантност към смесено хранене след гладуване през нощта при 38 седмици след операцията. Смесено хранене (11,7 g/dl въглехидрати, 3,7 g/dl протеин, 1,8 g/dl мазнина, Shapers; Pharmaprix, Toronto, ON, Канада) се прилага чрез орален сондаж в доза 6 ml/kg телесно тегло. Нивата на глюкоза в кръвните проби от вените на опашката се измерват с помощта на глюкомер (One Touch Ultra) на 0, 10, 20, 30, 60, 120 и 180 минути след хранене. В същото време плазмените проби бяха събрани и съхранявани при -20 ° C до хормонални анализи.
Тест за инсулинова толерантност.
След гладуване през нощта, доза от 0,4 IU/kg човешки редовен инсулин (Novolin; Novo Nordisk, Toronto, ON, Канада) се инжектира интраперитонеално при плъхове в съзнание. Нивата на кръвната глюкоза се измерват с глюкомер (One Touch Ultra; Life Scan) на изходно ниво и 10, 20, 30, 60 и 120 минути след инжектиране на инсулин.
Анализи на хормони.
Общите нива на GIP в плазмата се анализират чрез ELISA (Millipore, Billerica, MA). Плазменият инсулин и общите нива на GLP-1 (GLP-17–36 амид и GLP-17–37) бяха изследвани с помощта на комплект от Meso Scale Discovery (Gaithersburg, MD) в съответствие с инструкциите на производителя.
Имунооцветяване.
Хистоморфометричен анализ.
Анализ на телесния състав.
Измерванията бяха извършени с помощта на MRI скенер Bruker Biospec 70/30 7 Tesla (Bruker Biospin, Ettlingen, Германия). Ядрено-магнитен резонансен сигнал от тялото е получен чрез използване на квадратурна обемна RF намотка, настроена на 300 MHz. "Свободният" воден компонент, съответстващ на телесните течности (напр. Урина и цереброспинална течност), обикновено е 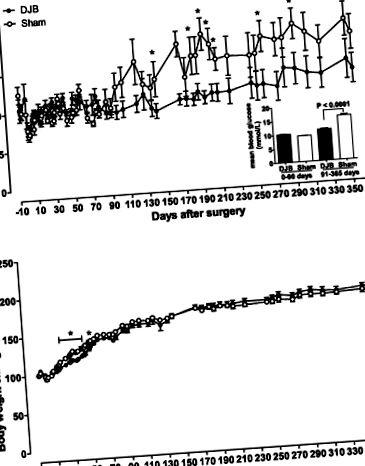
Фиг. 1.Кръвна захар (A) и увеличаване на телесното тегло спрямо изходното ниво (Б.) в плъхове Goto-Kakizaki (GK) след операция. Кръвната глюкоза и телесното тегло са измерени при хранене при 0900. A, вложка, показва средни нива на глюкоза в кръвта през ранните (0–90 дни) и късните следоперативни периоди (91–365 дни). Телесното тегло се нормализира според изходната му стойност. Animals Животни с фалшива група; ● дуоденално-йеюнален байпас (DJB) група. Данните са показани като средни стойности ± SE (н = 4–6 за всяка група). *P
OGTTs и IPGTTs бяха направени на 1, 3, 5, 10 и 18 седмици след операцията. Противно на данните за кръвната захар в хранене, AUC на OGTT и IPGTT не се различават между DJB и фалшивите групи (Фиг. 2, A и Б.). Въпреки това, в съответствие с нивата на кръвната глюкоза в хранене, нивото на кръвната захар след хранене на 120 минути след смесено хранене предизвикателство 38 седмици след операцията е значително по-ниско в групата на DJB от фиктивната група (Фиг. 2° С). Инсулиновата чувствителност, оценена чрез тест за инсулинов толеранс при 43 седмици след операцията, е сравнима между групите (Фиг. 2д).
Фиг. 2.Област под кривата (AUC) на нивата на глюкоза в кръвта по време на орален тест за толерантност към глюкоза (OGTT; A) и интраперитонеален тест за толерантност към глюкоза (IPGTT; Б.) при GK плъхове при посочените седмици след операция. AUC се изчислява по трапецовиден метод. ° С: тест за толерантност към смесено хранене е направен на 38 седмици след операция при GK плъхове. д: тест за толерантност към инсулин е извършен на 43 седмици след операция с 0,4 IU/kg инсулин при плъхове GK. Данните са показани като средни стойности ± SE (н = 5–6 за всяка група). *P
На 1 седмица след операцията няма значителна разлика в плазмените нива на инсулин и GIP по време на OGTT, докато плазмените нива на GLP-1 са леко повишени в групата на DJB, без да е показан очевиден пик (Фиг. 3, A-° С). На 18 седмици след операцията, в сравнение с фалшивата група, плазмените нива на инсулин по време на OGTT са склонни да бъдат по-високи в групата DJB, въпреки че не достигат статистическа значимост (P стойностите са в диапазона от 0,118 до 0,281; Фиг. 3д). Интересното е, че плазмените нива на GLP-1 и GIP по време на OGTT са значително по-високи в групата DJB (фиг. 3, Е. и F). В теста за толерантност към смесено хранене, който доведе до значителни разлики в нивата на глюкоза след хранене (фиг. 2д), плазмените нива на инсулин и GLP-1 са били значително по-високи в групата на DJB, отколкото в групата с фалшива фигура 3, G и З.), докато няма разлика в плазмените нива на GIP (фиг. 3Аз). В съответствие с резултатите от теста за толерантност към смесено хранене, плазмените нива на инсулин и GLP-1 по време на хранене, взети проби при седмица 32 са били по-високи в групата DJB в сравнение с фалшивата група (1,913 ± 288 срещу 641 ± 229 pg/ml за инсулин, P = 0,0064 и 31 ± 1 спрямо 22 ± 3 pg/ml за GLP-1, P = 0,015, съответно).
Фиг. 3.Плазмен инсулин, глюкагоноподобен пептид-1 (GLP-1) и глюкозозависими нива на инсулинотропен полипептид (GIP) по време на OGTT при 1 (A-° С) и 18 седмици (д-F) след операция и тест за толерантност към смесено хранене при 38 седмици след операция (G-Аз) при GK плъхове. Animals Животни от фалшива група; ● DJB група. Данните са показани като средни стойности ± SE (н = 5–6 за всяка група). *P
Инсулиновото оцветяване в панкреаса на GK плъхове изглеждаше неравномерно с вид на морска звезда, добре известна характеристика на тези животни (20). Тази нередност е по-забележима при фалшивата група, отколкото при групата DJB (Фиг. 4A, Горна част). Трихромовото оцветяване на Masson разкри по-обширна интраислетна фиброза в фалшивата група в сравнение с DJB групата (Фиг. 4A, отдолу). Количествените анализи на планиметрията разкриват недвусмислени разлики; животните DJB са имали по-висока β-клетъчна площ и по-ниска интраислетна фиброза, отколкото фиктивните животни (Фиг. 4, Б. и ° С).
Фиг. 4.Област на β-клетки и островна фиброза при GK плъхове. A: представителни изображения; Горна част 2 изображения са инсулинови имунохистохимични оцветявания и отдолу 2 изображения са трихромно оцветяване на Masson от животни 1 година след операцията. Панкреатичните островчета са обозначени с жълти пунктирани линии, а колагеновите влакна са оцветени в синьо на изображенията с трихромно оцветяване на Masson. Обърнете внимание на нормалните колагенови влакна около съдовете. Мащабни ленти, 100 μm. Резултатите от анализите на планиметрията за β-клетки (Б.) и островна фиброза (° С) са показани като средни стойности ± SE (н = 5 за групата DJB и н = 4 за фалшивата група). *P
Фиг. 5.Брутната хистология на червата при GK плъхове. Представителни изображения от дванадесетопръстника на животни от групата DJB (A), дванадесетопръстника на фалшивата група (Б.), приложеният йеюнум на DJB група (° С) и съответния йеюнум от фалшива група (д) са представени. Мащабни пръти, 200 μm. Е.: означава ± SE дължина на люспите (н = 4 за всяка група). Бели ленти, фиктивна група; черни ленти, DJB група.
Фиг. 6.Плътността на чревните ендокринни клетки при GK плъхове. A: представителни тройни имунофлуоресцентни изображения от йеюнума на животни от групата DJB. Всички изображения са наслагвания на GIP (зелено), GLP-1 (червено) и 4,6-диамидино-2-фенилиндол (DAPI) ядрено петно (синьо). Колокализацията на GIP и GLP-1 в една и съща клетка изглежда жълта (K/L клетка). Мащабни пръти, 10 μm. Б.: чревна ендокринна клетъчна плътност. K клетките са GIP (+)/GLP-1 (-) клетки, L клетките са GIP (-)/GLP-1 (+) клетки, а K/L клетките са GIP (+)/GLP-1 (+) клетки . Плътностите на K, L и K/L клетките бяха изчислени като броя на GIP-положителните клетки (средно 226), GLP-1-положителните клетки (средно 322) и двете GLP-1 и GIP копозитивни клетки (средно 187 ), нормализиран по броя на общите вили (средно 420 вили за дванадесетопръстника и 473 люспи за йеюнума) в даден надлъжен участък на червата. Бели ленти, фиктивна група; черни ленти, DJB група. Данните са показани като средни стойности ± SE (н = 4 за всяка група). *P
Nonobese, недиабетно проучване на плъхове Wistar.
Противно на констатациите при плъхове GK, нивата на глюкоза в кръвта по време на хранене при плъхове Wistar са били скромно, но значително по-високи в групата DJB, отколкото в групата с фалшива фигураA). Телесното тегло и приема на храна понякога се различават леко между групите (фиг. 7Б., вложка). В съответствие с нивата на глюкоза в хранено състояние, животните с DJB имат нарушен глюкозен толеранс по време на OGTTs, извършени на 3 и 9 седмици след операцията (Фиг. 7, ° С и д, съответно; AUC са 1 451,5 ± 76,6 срещу 1,134,5 ± 85,8, P = 0,028 при седмица 3, 1,334,2 ± 31,3 срещу 1,139,5 ± 79,0, P = 0,041 при седмица 9), което е свързано със забавен инсулинов отговор при 3 седмици (Фиг. 7Е.) и притъпен инсулинов отговор при 9 седмици след операция (AUC: 132 334,0 ± 13 279,9 срещу 198 278,8 ± 23 791,5), P = 0,037; Фиг. 7F). Няма разлика в нивата на кръвната глюкоза по време на IPGTT и инсулиновата чувствителност, оценена чрез ITT (данните не са показани).
Фиг. 7.Ефекти на DJB върху недиабетни плъхове Wistar. Нива на глюкоза в кръвното състояние (A) и телесно тегло (Б.) по време на периода на изследване, нивата на кръвната глюкоза по време на OGTT при 3 (° С) и 9 седмици (д) след операция и плазмени нива на инсулин по време на OGTT при 3 (Е.) и 9 седмици (F) след операцията са показани. Кръвната глюкоза и телесното тегло са измерени при хранене в 0900. Б., вложка, показва количеството дневен прием на храна. Animals Животни с фалшива група; ● DJB група. Данните са показани като средни стойности ± SE (н = 5 за групата DJB и н = 4–5 за фалшивата група). *P
Плъхът GK, добре проучен животински модел за неносебен диабет тип 2, получен от колония на плъхове Wistar, се характеризира с β-клетъчна загуба, свързана с обширна фиброза, която може да бъде увеличена чрез високо въглехидратна диета (20) и атенюирана от GLP-1 лечение (41). В това проучване установихме, че DJB подобрява гликемията след хранене при плъхове GK, като намалява загубата на β-клетки и фиброзата на островчета. Повишената секреция на инсулин е свързана с повишена секреция на GLP-1. Също така наблюдавахме повишен брой на K/L клетки в йеюнума, анастомозиран към стомаха при GK плъхове. Като цяло тези резултати осигуряват потенциални механизми, обясняващи дългосрочните благоприятни ефекти на изключването на DJB или предни черва върху глюкозната хомеостаза.
Едно от най-очевидните открития в нашето проучване е запазена β-клетъчна маса във връзка с намалена островна фиброза при плъхове DJB-GK. Тъй като се съобщава също, че транспонирането на илеума намалява островната фиброза при плъхове GK (26), получените от червата фактори може да са играли важна роля за смекчаване на фиброзата на островчета при хирургия на DJB. Този защитен ефект на β-клетките може да бъде от решаващо значение при дългосрочната ремисия на диабет тип 2 след операция на стомашен байпас при хора (29). Наскоро беше съобщено, че лечението с екзенатид, аналог на GLP-1, подобрява функцията на β-клетките, оценена чрез секреция на С-пептид до 2,5 пъти след 1 година лечение в сравнение с лечението с инсулин (7). Като се има предвид, че диабет тип 2 се характеризира с безмилостен спад в функцията на β-клетките (30, 43), тези резултати, включително нашите, предполагат, че анатомичното пренареждане на червата за увеличаване на секрецията на GLP-1 може да запази панкреатичната β-клетъчна маса и/или функция.
ЗАБЕЛЕЖКИ НА АВТОРА
* Тези двама автори са допринесли еднакво за тази статия и трябва да се считат за съавтори.
