Резюме
Все по-често се приема, че диетичният холестерол има много по-ниско въздействие върху прогресията на сърдечно-съдовите заболявания, отколкото се предполагаше преди. Въпреки това, както експериментите върху животни, така и проучванията при хора подкрепят виждането, че диетичният холестерол може да допринесе за прехода от доброкачествена стеатоза към потенциално фатален неалкохолен стеатохепатит. Естерите на холестерола и холестеролът се натрупват в хепатоцитите и нарушават неговата функция. Това води до оксидативен стрес и стрес на ендоплазмен ретикулум, предизвикващ освобождаването на провъзпалителни цитокини и прави хепатоцитите по-податливи на апоптотична или некротична клетъчна смърт. Клетките на Kupffer се групират около умиращите хепатоцити и фагоцитират хепатоцитните остатъци и липиди. В допълнение, те са изложени на липидни продукти за пероксидация, освободени от хепатоцитите. Така активираните клетки на Kupffer освобождават провъзпалителни, хемотаксични и профибротични цитокини, които стимулират възпалението и фиброзата. Следователно, диетичният холестерол може да бъде вреден за черния дроб, особено когато се прилага в комбинация с полиненаситени мастни киселини, които благоприятстват липидната пероксидация.
Атеросклероза и диетичен холестерол: исторически преглед
Текущ поглед върху хранителния холестерол и сърдечно-съдовите заболявания
Критичната преоценка на по-стари данни, заедно с нови проучвания, които бяха коригирани за потенциални объркващи фактори, които не бяха разгледани в ранните епидемиологични проучвания, опровергаха хипотезата, че диетичният холестерол има голямо влияние върху развитието на сърдечно-съдови заболявания, 10 -противоречиви. 11 Вместо самия диетичен холестерол, други хранителни фактори, които съвпадат с приема на диетичен холестерол в диета, богата на животински протеини, изглеждат от значение. 12 Следователно настоящите диетични препоръки включват намаляване на приема на животински продукти и увеличаване на приема на пълнозърнести храни. По-специално, заместването на наситените мастни киселини с моно- и полиненаситени мастни киселини в диетата е част от настоящите препоръки (напр. Вижте здравословното хранене на http://www.heart.org). 13–15
Физиологична роля на черния дроб в метаболизма на холестерола
До чревните епителни клетки, хепатоцитът е може би единственото място, при което значителни количества холестерол могат да бъдат отстранени от тялото или чрез екскреция под формата на свободен холестерол, или чрез секреция след превръщане в жлъчни киселини. Ако снабдяването с холестерол надвишава капацитета на хепатоцитите за синтез на жлъчна киселина и секреция на холестерол, единственият безопасен начин за изхвърляне на холестерола е образуването на естери на холестерола, които временно се съхраняват в хепатоцита.
Доказателства за влиянието на диетичния холестерол върху развитието на NASH
Безалкохолната мастна чернодробна болест (NAFLD) е чернодробната проява на метаболитния синдром. 16 Разпространението му се увеличава в резултат на нарастващия дял на пациентите с наднормено тегло и затлъстяване в популацията. Докато простата стеатоза, макар и от клинично значение, изглежда напълно обратима, по-тежките форми на заболяването, безалкохолният стеатохепатит (NASH), е хронично прогресиращо заболяване, водещо до фиброза, цироза и в крайна сметка хепатоцелуларен карцином. В момента NASH е най-честата причина за терминална чернодробна недостатъчност в западните общества. 17 Въпреки интензивните изследвания не е ясно (1) дали NAFLD и NASH са различни времеви стадии на едно и също заболяване и ако да (2) какви са молекулните механизми, които предизвикват прогресията. Последните данни сочат, че диетичният холестерол може да играе критична роля в този процес.
Влиянието на диетичния холестерол върху чернодробната патология всъщност е описано преди ролята му в развитието на атеросклероза. 1 В основната си работа по атеросклерозата Аничков описва предишна работа, при която храненето на яйчен жълтък на зайци е довело до „изключително богата инфилтрация на чернодробния паренхим с мастноподобни вещества“, която винаги е била придружена от „силно изразени области на дегенерация на паренхима“ . Този аспект на хранителния холестерол обаче до голяма степен изпадна в забрава. Едва с неотдавнашното нарастване на NASH и търсенето на подходящ модел на гризачи на NASH, се събуди интересът към въздействието на диетичния холестерол върху чернодробната стеатоза и възпаление. Докато много животински модели, базирани на диети, които предизвикват състояния, наподобяващи метаболитния синдром, също водят до чернодробна стеатоза при гризачи, повечето от тези диети не успяват да причинят чернодробно възпаление и фиброза при животните. От друга страна, диетичните интервенции, които възпроизвеждат възпроизводимо чернодробно възпаление и фиброза, като диета с дефицит на холин-метионин, не успяват да възпроизведат симптомите на метаболитния синдром, което показва, че механизмите, които предизвикват развитието на фиброза, се различават от тези в човешкия NASH. 18.
В подкрепа на физиологичната значимост на тези находки и при хората, лечението на пациенти с дилипидемия с комбинация от статини, които инхибират ендогенния синтез на холестерол, и езетимиб, инхибитор на поглъщането на холестерол, за намаляване на плазмените нива на LDL холестерол, подобрена чернодробна стеатоза и балониране като както и плазмените нива на AST, ALT и γGT в няколко проучвания. Понастоящем обаче не е ясно дали тези ефекти могат да се отдадат единствено на инхибирането на ентералното поемане на холестерол от езетимиб. 36 В по-нататъшна подкрепа за значението на диетичния холестерол за развитието на NASH, наскоро беше показано, че консумацията на яйца е свързана положително с риска от NAFLD. 37 По този начин, въпреки че все повече се признава, че в противоречие с предишните предположения, диетичният холестерол е само от второстепенно значение за развитието на сърдечно-съдови заболявания, 38–40 диетичният холестерол изглежда е важен играч в развитието на NASH. Въпреки това, основните механизми все още не са ясни.
Потенциални молекулярни механизми, в основата на които се индуцира NASH от холестерола
Натрупване на холестерол в хепатоцитите
маса 1
Влияние на диетите върху серумните липиди, натрупване на чернодробни липиди, чернодробно възпаление и чернодробна фиброза.
Оксидативен стрес
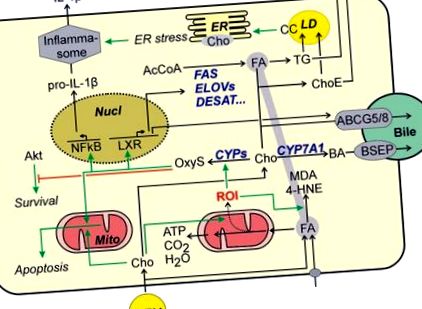
Самият холестерол също е обект на окислителни модификации. Оксистеролите са повишени при пациенти с NAFLD 53 и изглежда, че са причинители в развитието на NASH. 44 Докато оксистеролите чрез LXR индуцират пътища, които елиминират холестерола от клетката и по този начин намаляват тежестта на холестерола на клетката (фиг. (Фиг. 1), 1), в зависимост от вида оксистеролите също могат да имат неблагоприятни ефекти. По този начин е доказано, че 25-хидрокси-холестерол засилва възпалителния отговор в хепатоцитите чрез NFkB активиране 54, докато неговият конюгиращ продукт, 25-хидроксихолестерол-3-сулфат, намалява възпалението. Няколко оксистероли могат да индуцират апоптоза чрез задействане на митохондриалния апоптотичен път 55 в хепатомни клетки или първични хепатоцити на плъхове, ако клетките са били изложени на комбинация от оксистероли и мастни киселини. В допълнение, оксистеролите изглежда допринасят за клетъчната смърт чрез антагонизиране на зависимите от Akt пътища за оцеляване (фиг. (Фиг. 1 1). 56 Въпреки че в друго проучване оксистеролите очевидно не намаляват клетъчната жизнеспособност на хепатоцитите, 57 те все още могат да допринесат към развитието на NASH чрез въздействие върху непаренхимни чернодробни клетки (виж по-долу).
Свободният холестерол като спусък на апоптозата и некрозата на хепатоцитите
Холестеролът може безопасно да се съхранява в естери на холестерола. Това съхранение обаче е нарушено при пациенти с NASH. В допълнение към нарушената инхибиция на обратната връзка на синтеза на холестерол (вж. По-горе), увеличаването на активността на холестерол естер хидролазата може да допринесе за увеличаването на свободния холестерол. 58 Концентрацията на свободен холестерол се увеличава с напредване на увреждането на черния дроб. 59
Промените в свободния холестерол могат да доведат до ER стрес. 42,60 ER, предизвикано от стрес активиране на IRE1α-XBP-1 пътя, може допълнително да стимулира стеатозата чрез индуциране на ключови ензими на биосинтеза на триглицериди. В допълнение, ER стресът може да доведе до активиране на инфламазома (фиг. (Фиг. 1) 1) и последващо увеличаване на производството на IL-1β в хепатоцити, 61 директно свързващо натрупването на холестерол с индуцирането на възпалителен отговор. Освен това, предизвиканият от холестерол ER стрес може да предизвика апоптоза на хепатоцитите или да сенсибилизира хепатоцитите към други проапоптотични сигнали. 42 В друго проучване не се наблюдава медиирано от стрес медиирано активиране на апоптотични пътища. По-скоро натрупването на свободен холестерол в митохондриите причинява изчерпване на митохондриално редуцирания глутатион и сенсибилизира хепатоцитите срещу TNFα или FAS-индуцирана апоптоза и некроза, като по този начин стимулира развитието на NASH. 62
Последните данни сочат, че повишаването на вътреклетъчния свободен холестерол може да повлияе на регулирането на липидния обмен, като пречи на функцията на протеините в липидната капчица. Наблюдава се образуване на холестеролни кристали във фосфолипидния монослой, заобикалящ липидната капка 63 и корелира с прогресията на стеатозата към NASH. Докато първоначалното образуване на холестеролни кристали в хепатоцита изглежда е насърчило смъртта на хепатоцитите, остатъчните липидни капчици от мъртви хепатоцити са били заобиколени от клетки на Kupffer в короноподобни структури. Докато кристалите на холестерола са открити само във външния слой на липидните капчици в хепатоцитите, вероятно поради по-нататъшна хидролиза на холестеролови естери от клетките на Kupffer лизозмални ензими, остатъци от липидни капчици в короноподобните структури съдържат холестеролни кристали не само в липидната капчица, но също в тяхната сърцевина. 27 Клетките на Kupffer, фагоцитиращи кристалите на холестерола, се развиват в пенести клетки и реагират с възпалителен отговор (Фиг. (Фиг. 2 2)).
Зависимо от холестерола активиране на непаренхимни чернодробни клетки. Клетките на Kupffer образуват короноподобни структури около хепатоцитни остатъци и липидни капчици. Лизозомните ензими разцепват естерите на холестерола, позволявайки образуването на холестеролни кристали. Купферовите клетки фагоцитозират хепатоцитни остатъци, липиди и кристали на холестерола и по този начин се активират, за да произвеждат провъзпалителни и профиброзни цитокини. В крайна сметка клетките на Kupffer се превръщат в натоварени с липиди пяна клетки. Оксистеролите и липидно-пероксидационните продукти, освободени от хепатоцитите, могат допълнително да стимулират освобождаването на провъзпалителни и про-фиброзни цитокини от клетките на Kupffer, както и производството на тъканни инхибитори на металопротеинази, които инхибират разграждането на протеините на извънклетъчната матрица. TGFβ, получен от холестерол и Kupffer, благоприятства трансдиференцирането на звездни клетки към миофибробласти, които произвеждат прекомерни количества протеини на извънклетъчната матрица, насърчавайки развитието на фиброза. 4-HNE = 4-хидроксиноненал, IL = интерлевкин, MCP1 = моноцитен хемоаттрактант протеин 1, TGFβ = трансформиращ растежен фактор β, TIMP = тъканен инхибитор на металопротеинази.
Активиране на клетки на Kupffer и звездни клетки
Кристалите на холестерола могат да предизвикат възпалителния отговор в THP макрофаги 27 или първични клетки на Купфер, 26 фагоцитозиращи липидни капчици от апоптотични или некротични хепатоцити. Липолитичните ензими, освободени в зоната на възпаление, могат да освободят холестерол от естерите на холестерола и по този начин да подобрят образуването на кристали на холестерола (фиг. (Фиг. 2). 2). Експериментите на Transwell показаха, че директният контакт и фагоцитозата на кристалите са задължителни. Кристалите на холестерола могат да активират NLRP3 инфламазома и по този начин да стимулират активирането на IL-1β и IL-18 от техните предшественици. Следователно, инхибирането на NLRP3 инфламазома намалява тежестта на чернодробно възпаление и фиброза при генетични или индуцирани от диета миши модели на NASH. 64 Доказано е, че холестеролът благоприятства трансдиференциацията на чернодробните звездни клетки в миофибробласти (фиг. (Фиг. 2) 2) и по този начин може да допринесе за развитието на чернодробна фиброза. 65
Както беше отбелязано по-горе, оксидативният стрес е решаващ фактор за развитието на NASH. Освен директно увреждане на хепатоцитите, липидните окислителни продукти могат да активират възпалителния отговор в клетките на Kupffer. По този начин 27-хидроксихолестеролът в комбинация с 4-хидроксиноненал, и двата продукта са продукти на липидното окисление, могат да активират TLR4 сигнализиране и да предизвикат NFκB активиране при животински модели на атеросклероза. Подобен механизъм е предложен като потенциален механизъм, допринасящ за възпалението в NASH (фиг. (Фиг. 2 2). 48 В допълнение, оксистеролите повишават експресията на TGFβ и MCP1 в клетките на Kupffer, както и секрецията на IL-8 и TIMP от черния дроб звездни клетки и по този начин могат да допринесат за възпаление и фиброза
Заключителна бележка
Докато диетичният холестерол очевидно има много по-ниско въздействие върху прогресията на сърдечно-съдовите заболявания, отколкото се предполагаше по-рано, както експериментите върху животни, така и проучванията върху хора изглежда подкрепят виждането, че диетичният холестерол може да допринесе за прехода от доброкачествена стеатоза към потенциално фатален NASH. Диетичният холестерол може да бъде вреден за черния дроб, особено когато се прилага в комбинация с полиненаситени мастни киселини, които благоприятстват пероксидацията на липидите. 26 Това откритие е от особено значение, като се вземат предвид последните препоръки за заместване на наситените мазнини с полиненаситени мазнини за профилактика на сърдечно-съдови заболявания, без изрично да се предполага едновременно намаляване на приема на холестерол. 66
Благодарности
Списъкът с литература в този кратък преглед далеч не е изчерпателен. Съответната работа на много автори не е цитирана. Моля, приемете нашите искрени извинения.
Финансиране
Изследванията на авторите са финансирани отчасти от безвъзмездната помощ на DFG HE 7032/1-1.
Конфликт на интереси
Авторите нямат конфликт на интереси, който да декларират.
- Затлъстяване на черния дроб и сърцето ви - Harvard Health
- Нуждаят ли се щитовидната ви жлеза от диетични въглехидрати
- Дали месото причинява сърдечни заболявания Най-доброто (и най-лошото) месо за сърцето ви
- Хранете се, за да намалите холестерола на фондацията за сърце и инсулт
- Диетичният холестерол движи свързания с черния дроб рак на черния дроб чрез модулиране на чревната микробиота и