Резюме
Заден план
Диетите в западен стил предизвикват невровъзпаление и влошават емоционалното и когнитивното поведение у хората и животните. Предишното ни проучване показа, че диетата с високо съдържание на фруктоза причинява невровъзпалителен отговор на хипокампала и загуба на неврони при животните, но основните механизми остават неуловими. Тук са изследвани промени в чревната микробиота и чревната епителна бариера като причините за хипокампалната невроинфламация, индуцирана от диета с високо съдържание на фруктоза.
Резултати
Заключения
Нашите открития разкриват, че чревната дисбиоза е критичен фактор за индуцирана от диета с високо съдържание на фруктоза хипокампална невроинфламация при мишки C57BL/6N, евентуално медиирана от увреждане на чревната епителна бариера. В механично отношение дефектният инфламазом на NLRP6 на дебелото черво е отговорен за увреждането на чревната епителна бариера. SCFAs могат да стимулират NLRP6 инфламазома и да подобрят увреждането на чревната епителна бариера, което води до защита срещу индуцирана от диета с високо съдържание на фруктоза хипокампална невро възпаление и невронална загуба. Това проучване се занимава с пропастта в разбирането на невронните увреждания, свързани с диетите в западен стил. Подчертава се нова стратегия за намеса за намаляване на риска от невродегенеративни заболявания чрез добавяне на SCFA или консумация на диетични фибри.
Заден план
Невроинфламацията е отличителен белег на невродегенеративни заболявания, свързани с диети в западен стил, включително висококалорични диети, богати на преработени захари (фруктоза или захароза) и мазнини [1,2,3,4]. Съобщава се, че чревната микробиота модулира хипокампалната неврогенеза и неврологичната функция на възрастни, като контролира съзряването и функцията на микроглията при мишки без микроби и лекувани със специфичен патоген (SPF) [5, 6], което показва, че промяната в чревната микробиота (чревна дисбиоза) може да бъде основно събитие, иницииращо невровъзпаление и последващо невронално увреждане [5, 7, 8].
Диета, богата на фибри, подобрява дефекта на чревната епителна бариера и възпалението при индуцирани от декстран натриев сулфат (DSS) колитични мишки [28] и предпазва белия дроб на мишката от алергично възпаление [29]. Погълнатите диетични фибри лесно се ферментират от бактерии на дебелото черво, за да се получат органични киселини, включително късоверижни мастни киселини (SCFA). Лечението с SCFA отслабва индуцираната от диетата промяна в интегралната микробиота на червата и чревната епителна бариера при мишки C57BL/6, вероятно чрез инхибиране на системното възпаление [30, 31]. SCFAs могат да имат способността да модулират съзряването и функцията на микроглията в мозъка, което предполага потенциалните ползи от получените от чревната микробиота SCFAs в защита срещу невровъзпалителния процес [6, 32]. Невропротективните ефекти на SCFAs са демонстрирани и при животински модели на невродегенеративни разстройства [32, 33], но има нужда от повече доказателства.
В това проучване установихме, че диетичната чревна дисбиоза, предизвикана от диетата с фруктоза, причинява нарушение на чревната епителна бариера, свързано с появата на хипокампален невро възпаление при мишки C57BL/6N. Рецепторът, активиран от пролифератор на пероксизома (PPAR-γ), е бутиратен сензор в лумена на дебелото черво [34]. Съобщава се, че активираната от микробиота PPAR-γ сигнализация предотвратява дисбиотично разширяване на патогенни бактерии, като стимулира енергийния метаболизъм на епителните клетки на дебелото черво [35]. Ние също така подчертахме ключовите молекулярни механизми, чрез които SCFAs, както и пиоглитазон (PPAR-γ агонист), възстановяват увреждането на чревната епителна бариера чрез активиране на NLRP6 инфламазома, вероятно допринасяйки за инхибирането на хипокампалния невровъзпалителен отговор и невроналната загуба при хранене с фруктоза мишки.
Резултати
Изчерпването на чревната микробиота инхибира хипокампалния невро възпаление при мишки, хранени с фруктоза
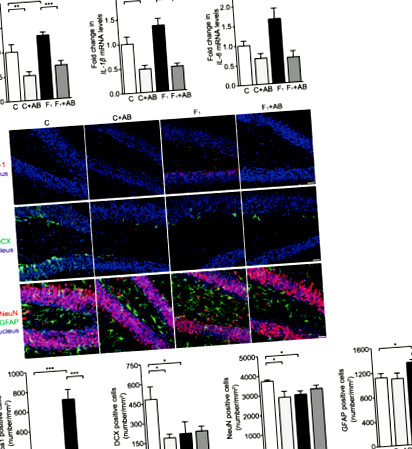
Хипокампален невровъзпалителен отговор, характеризиращ се със значително регулиране на интерлевкин-1 бета (IL-1β), фактор на туморна некроза алфа (TNF-α) и нива на иРНК на IL-6, е наблюдаван при мишки C57BL/6N, хранени с диета с високо съдържание на фруктоза в продължение на осем седмици (фиг. 1а). Имунофлуоресцентното оцветяване показва, че броят на Iba-1 + микроглия е значително увеличен в целия хипокампус на диети, хранени с високо фруктоза, в сравнение със стандартните животни, хранени с диета (Фиг. 1b и Допълнителен файл 1: Фигура S1a). Броят на NeuN + невроните и двойния кортин (DCX) + новородените неврони е значително намален, докато на GFAP + астроцитите са увеличени, в хипокампалната зъбна извивка (DG) (фиг. 1б), но не и в роговия амонис 1 (CA1) и Зони CA3 (Допълнителен файл 1: Фигура S1b) при мишки, хранени с фруктоза. Тези резултати потвърждават, че диетата с високо съдържание на фруктоза индуцира хипокампален невровъзпалителен отговор и невронална загуба при мишки C57BL/6N.
Диетата с високо съдържание на фруктоза предизвиква чревна дисбиоза, намаляване на SCFAs и увреждане на чревната епителна бариера при мишки C57BL/6N
За да се оцени влиянието на диетичната фруктоза върху чревната микробиота при мишки, фекалната микробиота се анализира, използвайки секвениране на 16S rRNA ген ампликон. Диета с високо съдържание на фруктоза в продължение на осем седмици променя структурата на микробната общност, но няма ефект върху микробното алфа-разнообразие при мишки (Фиг. 2а и б, Допълнителен файл 1: Фигура S2a). Изобилието на Бактероидети беше значително намален и Протеобактерии е значително увеличен при мишки, хранени с фруктоза. Освен това тези животни показват нарастваща тенденция през Фиксира (Фиг. 2в). Храненето с фруктоза също доведе до значително обогатяване на патогенните бактериални таксони Deferribacteraceae (Муциспирилум) и Helicobacteraceae (Хеликобактер) при мишки (Допълнителен файл 1: Фигура S2b). Въпреки че основните бактерии, произвеждащи SCFA, като Lachnospiraceae и Ruminococcaceae, са силно обогатени с мишки, хранени с фруктоза (Допълнителен файл 1: Фигура S2c), фекалните концентрации на ацетат, пропионат, бутират и общите SCFA са значително по-ниски при мишки, хранени с фруктоза, отколкото в контролната група (фиг. 2г). Антибиотиците намаляват фекалните концентрации на ацетат, пропионат, бутират и общите SCFA както при контролните, така и при хранените с фруктоза животни (фиг. 2г).
SCFAs и пиоглитазон частично оформят чревната дисбиоза и подобряват увреждането на чревната епителна бариера при мишки, хранени с фруктоза
Хранените с фруктоза мишки проявяват дефект в инфламазома на NLRP6 на дебелото черво, който се подобрява от SCFAs и пиоглитазон
По-специално, необичайното производство на гама на дебелото черво на интерферон (IFN-γ), TNF-α и IL-10 допълнително демонстрира имунен дисбаланс на червата при хранени с фруктоза мишки, които бяха подобрени от SCFAs и пиоглитазон (Допълнителен файл 1: Фигура S4a) . Нивата на NLRP6 в дебелото черво и разцепените нива на каспаза-1 P10 бяха значително намалени, а секрецията на IL-18 в дебелото черво беше намалена при хранени с фруктоза мишки (Фиг. 4а). В контролната група антибиотиците значително намаляват NLRP6 и разцепват нивата на каспаза-1 Р10 протеин, но не показват ефект върху секрецията на IL-18 в дебелото черво (Фиг. 4а). При мишки, хранени с фруктоза, антибиотиците обръщат намаляването на секрецията на IL-18 в дебелото черво и допълнително потискат експресията на NLRP6 в дебелото черво (Фиг. 4а). SCFA или пиоглитазон също предотвратяват намаляването на нивата на NLRP6 в дебелото черво и активирането на каспаза-1 при мишки, хранени с фруктоза, което води до възстановяване на продукцията на IL-18 (Фиг. 4b). В сравнение с тази при контролни мишки, експресията на NLRP3 на дебелото черво не се променя при мишки, хранени с фруктоза, лекувани със SCFA и пиоглитазон, но е намаляла значително при мишки, лекувани с антибиотици и мишки, хранени с фруктоза (Фиг. 4а, б). Освен това, експресията на дебелото черво на PPAR-γ и неговия целеви ген (ANGPTL4) беше понижено при мишки, хранени с фруктоза, които бяха възстановени от SCFA и пиоглитазон (Допълнителен файл 1: Фигура S4b и c).
В дебелото черво на нормални мишки оралното приложение на SCFA увеличава експресията на NLRP6 и увеличава производството на IL-18 (Допълнителен файл 1: Фигура S4d). В система ex vivo от култивирани експланти на дебелото черво на мишки (ex vivo екстракти на дебелото черво) SCFA също повишават експресията на NLRP6 и разцепват нивата на протеин каспаза-1 P10 и насърчават производството на IL-18 и тези ефекти се потискат от хистамин (бактериален метаболит) Фиг. 4в). Освен това, нивата на протеин NLRP6 и производството на IL-18 бяха увеличени от SCFAs, но намалени с NLRP6 siRNAs в миши CT26 клетки на карцином на дебелото черво (фиг. 4г). Нито пиоглитазон, нито GW9662 (PPAR-γ антагонист) засягат базално или SCFAs-стимулирано NLRP6 активация на инфламазома в ex vivo дебелото черво (Допълнителен файл 1: Фигура S4e). Тези резултати предполагат, че SCFAs могат да активират NLRP6 инфламазома независимо от PPAR-γ активирането.
SCFA и пиоглитазон потискат хипокампалния невровъзпалителен отговор и невронална загуба при мишки, хранени с фруктоза
Дискусия
Едно от най-поразителните наблюдения след широкоспектърно антибиотично лечение е инхибирането на хипокампалната невровъзпаление и реактивната глиоза в диета с високо съдържание на фруктоза, което е подобно на действието на антибиотици в миши модел на болестта на Алцхаймер, прогресираща невродегенеративна болест [41]. Също така установихме, че изчерпването на чревната микробиота причинява загуба на хипокампален невронал както в контролната, така и в хранената с фруктоза група, което предполага критичната роля на чревните микроби и/или техните метаболити в модулацията на хипокампалната неврогенеза. Интересното е, че SCFA или чревната микробиота могат да възстановят дефектната микроглия и да засилят целостта на кръвно-мозъчната бариера при мишки без микроби [6, 42]. Благоприятните ефекти на SCFA върху хипокампалната невро възпаление и невронална загуба при хранени с фруктоза животни допълнително демонстрират критичната роля на коменсалните микроби и/или техните метаболити в модулацията на неврологичната функция [7].
Заключения
Ясно показахме, че индуцирана от диетата с високо фруктоза аберантна структура на чревната микробиота и намалени нива на фекални SCFAs, демонстрирайки принос на чревната дисбиоза към невро възпалението на хипокампа при мишки C57BL/6N. Механично, възпалителната дисфункция на NLRP6 на дебелото черво е участвала в увреждане на чревната епителна бариера, което е подобрено от SCFA или пиоглитазон. Тези резултати предоставят нови доказателства за защитните механизми на SCFAs и пиоглитазон срещу хипокампален невровъзпалителен отговор и загуба на неврони при този модел на животни. Нашите открития подчертават неблагоприятното въздействие на характеристика на диетите в западен стил върху невро възпалението на хипокампала и предлагат нова стратегия за интервенция при неврологична дисфункция. В бъдеще обаче трябва да се получат по-преки доказателства.
Материали и методи
Животни и лечение
Четириседмични мъжки мишки C57BL/6N (17-20 g), отгледани при условия на SPF, бяха закупени от Beijing Vital River Laboratory Animal Technology Co., Ltd. (Пекин, Китай; лиценз за производство: SCXK (Su) 2016-0003 ) и се оставя да се аклиматизира в средата за животни в продължение на една седмица, преди да се използва за експерименти. Те бяха настанени в специфична среда без контрол на патогени, контролирана от температура и влажност (22 ± 2 ° C, 50 ± 5% влажност) със стандартен 12-часов цикъл светлина/тъмнина. Тези мишки получиха достъп до храна и вода ad libitum.
In vivo анализ на пропускливостта
Чревната пропускливост се оценява с in vivo FITC-декстран (FD4; Sigma-Aldrich) анализ на пропускливостта, както е описано по-рано [21]. Мишките на гладно в продължение на 4 часа се дават с 0,6 mg/g телесно тегло FITC-декстран (4 kDa) в разтвор от 25 mg/ml и кръвта се събира чрез субмандибуларно кървене след 3 часа. Интензитетът на флуоресценция в серума се измерва с помощта на флуоресцентен спектрофотометър (Synergy 2, Biotek, Winooski, VT). Концентрациите на FITC-декстран се определят от стандартна крива, генерирана със серийни разреждания на FITC-декстран.
Вземане на проби от кръв и тъкан
В края на експериментите мишките се гладуват цяла нощ и се анестезират с натриев пентобарбитал (50 mg/kg, i.p.) и кръвта се получава чрез кардиопунктура. Тези кръвни проби се центрофугират при 2500 rpm в продължение на 10 минути за събиране на серумните проби, които незабавно се замразяват при - 80 ° C за биохимични анализи. Тъканите на хипокампуса и дебелото черво бяха дисектирани за хистопатология, анализ на трансмисионна електронна микроскопия (TEM), оцветяване с имунофлуоресценция, количествена полимеразна верижна реакция (qPCR) и анализ на Western blot.
Анализи на 16S рРНК генна последователност
Пресни проби от изпражнения от мишки бяха събрани в дезинфекцирани епруветки, незабавно замразени в течен азот при събиране и съхранявани при - 80 ° C до анализ. ДНК пробите на изпражненията бяха изолирани и микробиомите бяха анализирани в Пекинския геномичен институт на платформа Illumina MiSeq. Избрани са висококачествени показания за биоинформатичен анализ и всички валидни показания от всички проби са групирани в оперативни таксономични единици (OTU) въз основа на 97% сходство на последователността. α-Разнообразието се изчислява въз основа на индекса за разнообразие Chao1. Вариацията между експерименталните групи (β-разнообразие) е оценена с графики на основен координатен анализ (PCoA). Линейният дискриминантен анализ, съчетан с размера на ефекта (LEfSe), беше извършен със софтуер LEFSE.
Определяне на концентрациите на SCFA в изпражненията
Ex vivo система от култивирани експланти на дебелото черво на мишка
Система ex vivo от култивирани експланти на дебелото черво на мишка е конструирана съгласно методите в предишен доклад [13] (Допълнителен файл 2). Дебелото черво от осемседмични нормални мишки C57BL/6N бяха отворени надлъжно и измити старателно чрез промиване няколко пъти със студен HBSS, съдържащ 100 U/mL пеницилин, 100 μg/mL стрептомицин и 50 μg/mL метронидазол. Тъканите на дебелото черво се нарязват на приблизително 4 mm 2 фрагмента, поставят се върху предварително напоени салове Gelfoam и се култивират в 1 ml среда RPMI 1640, съдържаща 0,01% BSA, 200 U/ml пеницилин, 200 μg/ml стрептомицин и 1% фунгизон. Експлантите на дебелото черво се инкубират в присъствието на смес (съотношение 3: 1: 1) на натриев ацетат, натриев пропионат и натриев бутират с хистамин (H7125; Sigma-Aldrich), пиоглитазон или GW9662 (PPAR-γ антагонист) за 24 часа според експерименталния дизайн. Културната среда и експлантите на дебелото черво са събрани, за да се тества активирането на NLRP6 инфламазома и транскрипцията на PPAR-γ.
Клетъчна култура и лечение
Миши CT26 клетки от карцином на дебелото черво са закупени от Шанхайските институти за биологични науки (Шанхай, Китай) и са отгледани в 1640 среда, допълнена с 10% фетален говежди серум в овлажнена атмосфера, съдържаща 5% CO2 при 37 ° C. За експериментите клетките се поставят в плаки с 6 ямки в продължение на 12 часа и се трансфектират с NLRP6 siRNA или отрицателна контролна siRNA (GenePharma, Шанхай, Китай), използвайки Lipofectamine 2000 за 6 часа. След това тези клетки бяха инкубирани в среда 1640 в присъствието или отсъствието на 12,5 тМ смес (съотношение 3: 1: 1) на натриев ацетат, натриев пропионат и натриев бутират в продължение на 48 часа. Културната среда се събира и общият клетъчен протеин се екстрахира за биохимичен и Western blot анализ.
qPCR анализ
Western blot анализ
Хистопатология на илеалната и дебелото черво
Изрязаната тъкан на илеума и дебелото черво се фиксира в 4% параформалдехид и се вгражда в парафин. Блоковете бяха нарязани последователно на участъци с дебелина 5 μm и оцветени с хематоксилин и еозин (H&E). Хистологичните изображения са получени с помощта на микроскоп Olympus IX53 (Токио, Япония), цифров фотоапарат Olympus DP73 и софтуер за изображения на Olympus cellSens.
Анализ на трансмисионната електронна микроскопия (ТЕМ)
Изрязаната тъкан на илеума и дебелото черво се измива обилно от фекални вещества и се фиксира в 2,5% глутаралдехид в PBS. За TEM пробите от тъкани бяха обработени със стандартни протоколи в Аналитичния център на Медицинския университет в Нанкин (Нанкин, Китай) и изследвани с помощта на пропускателен електронен микроскоп JEOL JEM-1010 (Токио, Япония).
Имунофлуоресцентно оцветяване и морфометричен анализ
Три животни от всяка група бяха анестезирани и транскардиално перфузирани с ледено студен 4% параформалдехид. Мозъците се изрязват, фиксират се в 4% параформалдехид за една нощ, инкубират се в 20% захароза/PBS през нощта при 4 ° C и се инкубират в 30% захароза/PBS за една нощ при 4 ° C. След това мозъчните проби бяха замразени в съединение с оптимална температура на рязане (Sakura Finetek, САЩ) и коронално нарязани с криостат на участъци с дебелина 30 μm. Замразените секции бяха блокирани с 10% фетален говежди серум в PBS за 1 h при стайна температура. Слайдовете се инкубират с първични антитела за една нощ при 4 ° С и след това се инкубират за 30 минути при 37 ° С с конюгирани с Alexa Fluor вторични антитела (Invitrogen). Първичните антитела включват миши анти-Iba1 (sc-32725, Santa Cruz), миши анти-NeuN (ab104224; Abcam), заешки анти-DCX (ab77450; Abcam) и заешки анти-GFAP (Z0334; Dako). Секциите бяха оцветени с 4,6-диамидино-2-фенилиндол (DAPI) за ядрено оцветяване. Изображенията са заснети с помощта на конфокален микроскоп Leica TCS SP8. Шест произволно избрани мозъчни секции от всяко животно бяха използвани за очертаване и преброяване на положителни имунофлуоресцентни клетки в хипокампалните региони DG, CA1 и CA3 с помощта на софтуера Image-Pro Plus (Media Cybernetics, САЩ).
Статистически анализ
Данните са изразени като средната стойност ± SEM. Статистическите анализи бяха извършени с GraphPad Prism Software 6.01 (GraphPad Software, Сан Диего, САЩ). Различията бяха анализирани чрез еднопосочен дисперсионен анализ (ANOVA) с post hoc тестове за сравнения на множество групи. стр стойности
Наличност на данни и материали
Всички данни за четене на последователности от 16S rRNA гени са депозирани в Националния център за биотехнологичен архив за четене на информация под номер под номер PRJNA540110.
- Диетичното ускоряване на сигнала за лептин, насърчава протуморигенната стомашна среда при мишки
- Диетичният манган насърчава стафилококовата инфекция на сърцето - ScienceDirect
- Ферментируемите диетични фибри насърчават хелминтната инфекция и обострят възпалителните реакции на домакините
- Диетичното ограничение на наличността на желязо отслабва патогенезата на UPEC в миши модел на урина
- Диетични препоръки при чревна дисбиоза