Свързани данни
Резюме
Въведение
Екстракти на щитовидната жлеза от овце и по-големи животни са били успешно прилагани за облекчаване на симптомите на хипотиреоидни микседематозни пациенти в края на 1890-те. Наблюденията, направени от внимателни лекари, които изпитват този нов терапевтичен режим, ясно показват повишаване на телесната температура, честота на пулса и дишането, както и ефективно намаляване на микседем и мастна тъкан при лекувани пациенти [1]. Magnus-Levy, който хранеше екстракти на щитовидната жлеза на пациент с хипотиреоидна микседематоза във Франкфурт, Германия, предостави първа количествена оценка на това лечение, наблюдавайки повишена консумация на кислород и производство на CO2 и увеличаване на дихателната честота, параметър, който през следващите десетилетия насочваше лекуващите лекари да избягват интоксикация с тиреоиден хормон (TH), тахикардия и прекомерна телесна температура [2]. 1
Онлайн добавка 1 (за всички онлайн допълнителни материали вижте www.karger.com/doi/10.1159/000497141) дава кратко обобщение на основните постижения, постигнати през дългата история между откриването на микроелемента йод [10], неговата ключова роля като основна химическа съставка на TH T4 и 3,3 ′, 5-L-трийодтиронин (T3) [11, 12, 13], първото характеризиране и клинично приложение на различни екстракти на щитовидната жлеза, получени от животни, създаването на надеждни биологични тестове, количествено определящи тяхното действие върху консумацията на кислород [14], базална скорост на метаболизма, термогенеза при експериментални животни, включително метаморфоза на попова головка [15] и завършваща с идентифициране на рецептори за Т3, основния тиромиметичен хормон [16, 17, 18, 19, 20, 21].
Този преглед обсъжда биологичната функция на ендогенните метаболити, т.е. „тирономът“, които се генерират ензимно от родителския TH T4. Фокусът се отделя на тиромиметично активните съединения 3,5-Т2, Tetrac и Triac, както и на „хладния“ 3-Т1-амин.
От началото на откриването на TH се съобщават и различни метаболити на йодотиронини, конюгирани със сулфат или глюкуронова киселина в позиция 4′OH, както и окислени или метаболизирани в страничната им верига на аланин аминокиселина, като оцетна киселина и аминови производни на TH с различни степени на йодиране, вариращи от 0 до 4 [22]. Съобщени са несъвместими данни по отношение на тяхната сила, механизъм и начин на действие, тяхната поява in vivo и тяхното физиологично или патофизиологично значение, да не говорим тук за потенциалното фармакологично приложение. Последователно обаче от 90-те години на миналия век се съобщава и за биологични действия и ендогенна поява на 3,5-Т2 [23], който при по-ниски концентрации изглежда е насочен към митохондриите и упражнява бързи и директни действия, различни от тези на класическото свързване на Т3 рецепторите лиганд [24]. Съобщава се обаче, че при по-високи концентрации 3,5-Т2 потиска TSH и оста на HPT, причинява неблагоприятни сърдечни ефекти, подобни на хипертиреоидни състояния, и регулира експресията на Т3-реагиращи целеви гени, подобни на Т3 [25, 26, 27].
През 2004 г. беше направено голямо откритие с първата идентификация на 3-йодтиронамина (3-T1AM) като фармакологичен агент със забележителни биологични свойства [28]. Този беден на йод биогенен амин, синтезиран от орнитин декарбоксилаза (ODC) [29] и евентуално други ензими, метаболизиращи аминокиселини, реверсивно намалява телесната температура с 8 ° C в различни животински модели, показва отрицателни инотропни и хронотропни ефекти върху сърцето и ако се прилага в непосредствена връзка с времето, предотвратява също експериментално индуцирани лезии на миокарда и мозъчния инфаркт [30]. Необходими са обаче доста високи фармакологични дози, за да се проявят тези ефекти, които в момента се разследват. Повече от 100 години след откриването на хормоналния принцип в щитовидната жлеза като йодирани аминокиселинни производни [11, 31], са правени успешни опити за генериране на щитовидната жлеза в ястие от ембрионални стволови клетки и индуцирани от човека родови стволови клетки [32, 33, 34, 35], които, като принципно доказателство, в модел на мишка могат да възстановят TH при атиреотични хипотиреоидни мишки. По този начин изглежда реалистично да се очаква лечение на хипотиреоидни заболявания и вроден хипотиреоидизъм чрез трансплантация на in vitro размножени фоликули на щитовидната жлеза на пациенти с хипотиреоиди през следващото десетилетие.
TH Дейодиране и свързани метаболити на T4
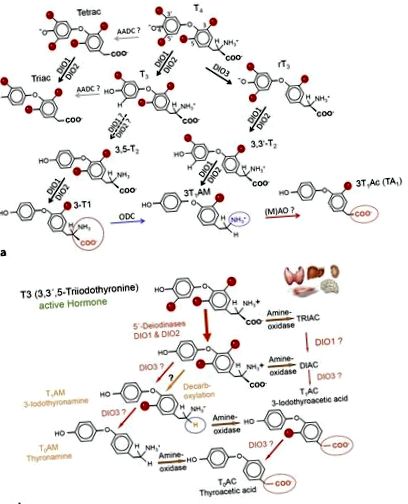
а Метаболити на щитовидната жлеза и основни метаболитни пътища на T4, T3 и 3-T1AM. Дейодинази (DIO), орнитин декарбоксилаза (ODC) и аминооксидази (AO) допринасят за метаболизма на THM, специфичен за развитието, тъканите и клетките. Т4, L-тироксин; Т3, 3,3 ', 5-трийодо-L-тиронин; 3-T1AM, 3-йодотиронамин; DIO1, 2, тип 1 и тип 2 дейодинази. б Схематичен изглед на метаболизма на ТАМ. Т4 и неговите метаболити преминават през каскада от метаболитни реакции, които могат да доведат до образуване на оцетна киселина (ТАС) и аминови производни (ТАМ). Не всички подробности за тези реакции са характеризирани. Органите символизират основните тъкани, изследвани и допринасящи за образуването на THM.
Докато биологичните функции са възложени на 3,5-Т2, в момента ролята на rT3, основен метаболит на Т4, генериран от редукционна дейодизация в тирозиловия пръстен на Т4, катализиран от дейодиназа 3 или дейодиназа 1, в момента не е ясна [58]. Производството, разграждането и серумната концентрация на много краткотрайния rT3 са строго контролирани. Установено е повишаване на серумните концентрации на rT3 при различни патофизиологични условия [59, 60] (онлайн Приложение 3). Наскоро тъканта rT3 се визуализира в метаморфозиращи попови лъчи (онлайн добавка Фиг. S3), но нейните биологични действия [61, 62, 63, 64, 65, 66, 67], ако изобщо има такива, напр. като Т3-антагонист, остават толкова противоречиви 2, колкото наблюденията за метаболити с ниско молекулно тегло на други хормони, взаимодействащи с ядрени рецептори (напр. секостероиди, ретиноиди или производни на мастни киселини хормони) [22, 68, 69, 70, 71].
rT3 представлява един от най-загадъчните ендогенни THM, вече открит рано след Т3 като незначителен компонент в тиреоглобулина [74, 75], но като обилен метаболит на Т4 в човешката кръв след разработване на хроматографски и имунологични методи. Концентрациите на rT3 в кръвта са еквимоларни или понякога дори по-високи от тези на активния хормон Т3 (Таблица (Таблица1) 1) и обикновено промените са обратни на тези на Т3 [40, 41, 59, 72, 73, 85, 93]. rT3 е запален субстрат както за Dio1, така и за Dio2 [86], което води до образуването на инертен 3,3′-дийодо-L-тиронин (3,3-T2) [22]. Наблюдаваното in vitro конкурентно инхибиране на активността на Dio1 от rT3 вероятно няма физиологично значение [87]. Нито е потвърдена неговата постулирана роля като източник на плацентарно снабдяване с йодид за плода [88], нито стехиометричните съображения подкрепят потенциална функция на rT3 като йоден източник при свързаното с фагоцитоза йодиране на чужди (бактериални) протеини, улеснено от активирани дейодинази в моноцити или левкоцити [39, 89, 90]. Плацентарните мембрани изобилно експресират както симпортер на натриев йодид [91], така и дейодинази [92, 93, 94].
маса 1
Основни характеристики на ендогенните метаболити на TH
| Т4 | Т4 | прохормон, лиганд за интегринов рецептор ανβ3 | 110 000 | [76] |
| Т3 | Т3 | тиромиметичен хормон, TR лиганд | 2100 | [76] |
| rT3 | rT3 | „Неактивен“ метаболит | 620; 140–320 | [76, 77] |
| 3,5-Т2 | 3,5-Т2 | активен „горещ“ метаболит | 55; 240 nM; 150–700 | [76, 78, 79, 80] |
| 3,3′-Т2 | 3,3′-Т2 | неактивен | 58 | [76] |
| 3-йодотиронамин | 3T1AM | „Готин“ хормон на щитовидната жлеза | 15 000 | [81] |
| Тиронамин | T0AM | „Готин“ хормон на щитовидната жлеза | ||
| Тетрайодо-тирооцетна киселина | Тетрак | антагонист на интегриновия рецептор ανβ3 | 7200; 115 | [76, 82, 83] |
| Трийодо-тирооцетна киселина | Триак | тиромиметичен лиганд за Т3 рецептори | 2 800 | [76, 84] |
| 3-йодо-тирооцетна киселина | TA1 | |||
| 4′-О-глюкурониди | TH-G | метаболити за фекално елиминиране, ентерохепатална циркулация | ||
| 4′-О-сулфати | TH-S | метаболити за бъбречно елиминиране, ентерохепатална циркулация | 10–80 | [76] |
Съгласуваните действия на дейностите на Dio2 и Dio3 регулират местната наличност и действие на T3
Дезаминираните производни на оцетната киселина (Tetrac и Triac) са ендогенни биологично активни метаболити на TH
Скоро след откриването на класическите TH T4 и T3 като йодирани производни на аминокиселини, е доказано образуването на дезаминирани производни на пропионова, оцетна киселина и мравчена киселина, използвайки хроматографски методи и маркирани с радиойод прекурсори на TH като субстрати [105, 106, 107] . Това доведе до откриването на ендогенни Tetrac и Triac като биологично активни съединения (напр. При анализи за превенция на гуша), образуване на тези метаболити и техните междинни продукти в различни тъкани (напр. Щитовидна жлеза, черен дроб, бъбреци и др.) Или техните екстракти и в субклетъчни фракции като митохондрии и цитозоли [7, 8, 36, 107, 108, 109, 110, 111, 112] (за подробности вижте онлайн Приложение 4).
Тетрак
Триак
Triac също е идентифициран като първичен биоактивен TH в протохирдатния амфиокс, където Triac, но не и T3 е добросъвестният субстрат на дейодиназа [129] и активен TR лиганд в ранен еволюционен контекст, където древният гликопротеохормон „тиростимулин“, прекурсор на TSH, регулира T4 синтез [130, 131].
Triac е получил основно внимание като краткотраен, но мощен T3-миметичен метаболит, модулиращ експресията на T3-реагиращи гени с известно предпочитание за TRβ свързване, включително някои мутирали TRβ варианти [124, 125, 132, 133]. Сред тези тъканни селективни цели е потискане на TSH в хипофизата, индукция на място 14 и DIOs в черния дроб и други избрани целеви тъкани. Triac (и Tetrac) може да не повлияе на хипоталамусния TRH [119] и сърдечната функция, докато крайните точки на костите, кожата, бъбреците и черния дроб и параметрите на телесното тегло реагират подобно на Triac, но не са идентични с класическото лечение с TH (за преглед вж. [84]) обяснява злоупотребата с него 3 [137]. Напоследък селективността на тъканите е свързана със способността му да заобикаля MCT8 като THTT, което води до експерименталното му използване както при животински модели на AHDS синдром, така и при клинични изпитвания [84, 119, 121, 122, 134] (за повече подробности вижте онлайн Приложение 4, Таблица Таблица1, 1 и преглед [84]). Дали ендогенният триак има значение за специфичното за клетките действие на ТН във (пато) физиологията, където са докладвани променени серумни концентрации [113], остава да се проучи по-подробно и с подобрени аналитични инструменти като масова спектрометрия (MS), които могат избягвайте граници на склонност към грешки количествено определяне на кръстосаната реактивност на Triac в имуноанализи T3 [22].
3,5-T2, пренебрегван, но тиромиметично активен THM
а Ефекти на метаболитите на хормоните на щитовидната жлеза 3,5-T2 и 3-T1AM. Преглед на докладваните метаболитни ефекти на горещия 3,5-T2 и „хладния“ 3-T1AM върху избрани целеви тъкани при експериментални животни (вижте текста за подробности). FA, мастни киселини; NIS, натриево-йоден симпортер на щитовидната жлеза; syst. аорт. преса., систолно аортно налягане. Фигурата е проектирана от Julika Lietzow, IEÉ. б 3,5-T2 ефекти върху оста на HPT. 3,5-Т2 потиска оста на HPT при мишки при HFD и стандартна диета. Вече ниската доза от 3,5-T2 (0,25 µg/g телесно тегло) намалява експресията на хипоталамуса Tshβ и съдържанието на T3 в черния дроб и серума. Dio1, дейодиназа тип 1; HFD, диета с високо съдържание на мазнини; Trh, тиреотропин-освобождаващ хормон; Tsh, тиротропин; Tshr, TSH рецептор; SD, стандартна диета. Фигурата е проектирана от Julika Lietzow, IEÉ [25].
3,5-Т2 серумни концентрации
Основен интерес в този контекст представляват наблюденията, направени при не бозайникови видове, като някои видове риби [168]. В техния геном са идентифицирани две форми на TRβ T3 рецептори. Дълга TRβ изоформа с 9-аминокиселинна вложка в началото на лиганд-свързващия домен и по-къса версия без тази вложка. Интересното е, че 3,5-Т2 свързва и активира дългите TRβ изоформи, докато T3 е селективен за краткото активиране на TRβ изоформа. Метаболитното и регулаторно въздействие на тези наблюдения се нуждае от допълнителни проучвания и досега не са установени такива различни TRβ изоформи при хора или бозайници [168, 169].
Специфични характеристики и фармакологични действия на ендогенния THM 3-T1AM
Човешките серумни концентрации на 3-T1AM са в диапазона 10–70 nM, както се определя чрез имунен анализ на хемилуминесценция [81]. Не са наблюдавани значителни разлики между мъжете и жените и все още не са установени промени в зависимост от възрастта. В човешкия серум 3-T1AM има изключително дълъг полуживот. Дори 6 дни след отнемане на Т4 не се наблюдава намаляване на концентрациите, докато концентрациите на Т4 и Т3 намаляват, както се очаква [81]. Авторите обясняват тази забележителна стабилност за биогенен амин с неговото високо афинитетно свързване със серумния аполипопротеин В100, който е идентифициран като силно специфичен и високоафинитетен свързващ протеин за 3-T1AM от групата Scanlan [178]. Концентрациите на серумна концентрация 3-T1AM не намаляват при нетиреоидно заболяване или следоперативно предсърдно мъждене [163], докато по-ниски концентрации се наблюдават при критично болни пациенти в интензивно отделение в сравнение със здрави индивиди [164]. Оцелелите и не-оцелелите от интензивното отделение обаче не се различават в техните серумни концентрации на 3-T1AM.
Отворени въпроси в изследванията на THM
Влияние на пъстрото разнообразие от метаболити TH върху аналитичните предизвикателства в клиничната практика и изследвания
Понастоящем тестовете за функция на щитовидната жлеза се фокусират върху определянето на TSH чрез методи, базирани на имуноанализи като биомаркер от първа линия. В зависимост от повишаването или потискането на TSH се посочват по-подробни анализи и измерването на TSH се повтаря и допълва с определяне на серумни концентрации на свободен T4 (fT4), понякога се определя и fT3. В педиатричната клинична практика често се дава предпочитание за определяне на общия T4, като се вземат предвид възрастово-зависимите промени в референтните диапазони, както и недоверието в отчитането на концентрацията на TH без серум при педиатрични пациенти. Също така, по време на бременност трябва да се обърне специално внимание на специфичните за триместъра референтни граници за функционални тестове за TH, които са свързани с повишено производство и секреция на TBG по време на бременност или свързани с орална контрацепция [217, 218, 219, 220].
Фигура Фигура 3 3 илюстрира количествени връзки между прохормона Т4 и основния THM, обсъден в тази статия. Тази картина има за цел да визуализира аналитичните проблеми, породени от огромния излишък от обща концентрация на Т4 в кръвта (58–161 nM), в сравнение с общия Т3 (Таблица 1). 1). Обикновено тези хормонални концентрации се определят чрез методология, основана на имуноанализ, илюстрираща, че кръстосаната реакция от Т4 може да създаде проблеми при определянето на концентрациите на другия THM, ако антителата не са силно специфични. Освен този основен проблем, картината има за цел да илюстрира огромното предизвикателство в надеждността на точното определяне на концентрациите на свободен TH. Лупата вече се опитва да визуализира 10-кратно разширени концентрации на fT4 в сравнение с общия обем T4 или 1000 пъти разширени за fT4 и fT3, изобразявайки референтните стойности за fT4 (> 10 pM 4 [224, 225]. MS също е прилага се за контрол на качеството на съдържанието и състава на лекарството L-T4 [226, 227].
Заключения
Декларация за оповестяване
Авторът не декларира никакъв конфликт на интереси, свързан с предмета на този преглед и като клинично ориентиран основен учен нито съветва пациенти, нито компании, произвеждащи лекарства за хормони на щитовидната жлеза. Авторът няма етични конфликти за разкриване.
Препратки
За справки, добавки и допълнителни фигури вижте онлайн допълнителни материали.
- Тиреоидна хормонална терапия при затлъстяване и нетиреоидни заболявания систематичен преглед - PubMed
- Ефектът на пеперудата Въздействието на щитовидната жлеза върху вашето здраве от Марина Тарасова Забележително -
- Wellbutrin за основи на отслабване на щитовидната жлеза
- Какво знаете за ендорфиновия хормон - ЗАГУБА НА МАСЛЕН КОРЕМ
- Известната тибетска практика за лечение на щитовидната жлеза