Резюме
Заден план
Нараства интересът към ролята на възпалението за развитието на хронично заболяване. Цитокините са мощни разтворими имунни медиатори, които могат да се използват като целеви биомаркери на възпалението; измерването им в човешки проби обаче е предизвикателство. Това проучване има за цел да оцени надеждността на про- и противовъзпалителния цитокинов панел в извадка от здрави хора, измерена с нова електрохимилуминесцентна мултиплексна платформа за имуноанализ (Meso Scale Discovery, MSD), и да характеризира техните връзки с метаболитни и възпалителни фенотипове.
Резултати
Като цяло по-голямата част от цитокините са над границата на откриване (в най-малко 85,3% от пробите). Цитокините IL-6, IL-8, TNF-α, IL-10, IL-13 и IFN-γ показват цялостна добра до справедлива надеждност (ICC> 0,40), докато IL-1β, IL-2, IL-4, и IL-12p70 показа лоша надеждност (ICC
Заден план
Възпалението все повече се признава като важен патофизиологичен феномен при стареенето [1]. Преди две десетилетия Franceschi et al. (2000) въведе термина „възпаление“ като обещаваща нова област на изследване на връзката между имунитета, хроничното възпаление и стареенето [2]. Оттогава се появиха множество доказателства, които предполагат важна роля на възпалението в развитието на хронични заболявания, като болестта на Алцхаймер, атеросклероза, сърдечни заболявания, диабет тип II и рак [3]. Основните механизми, чрез които възпалението засяга сложни патологични промени и развитие на болестта, все още не са напълно изяснени [4].
Цитокините са мощни разтворими имунни медиатори, нарушени в различни болестни състояния и тяхното измерване би могло да даде важна информация за патогенезата на много свързани с възрастта заболявания и ролята на възпалението [5,6,7]. Досега количественото определяне на цитокините в човешката циркулация е предизвикателство както за изследователите, така и за клиницистите [8]. Обикновено цитокините оказват биологични ефекти при ниски фармакологични дози и циркулиращите концентрации са под границата на откриване чрез наличните в търговската мрежа комплекти за анализи. Нивата на цитокините в кръвта имат кратък полуживот и са склонни към значителна променливост, потенциално отчетена от дневните ритми, обработката на кръвта, обработката и съхранението и методите за анализ [8].
Цитокините са измервани при нива на РНК (mRNA), чрез използване на верижна реакция на полимеразна обратна транскрипция (RT-PCR), и при нива на протеин чрез цитокинови биоанализи или ензимно-свързани имуносорбентни анализи (ELISA) [9]. Тези техники имат своите недостатъци и резултатите, получени при използване на търговски анализи, трябва да се тълкуват с повишено внимание [9]. Напредъкът в лабораторните технологии, включително поточна цитометрия, тестове, базирани на топчета Luminex [10], и планарни мултиплексни анализи позволяват измерване на по-обширен панел от цитокини в серума/плазмата за кратък период от време и с по-малки обеми проби [8]. Сред новите мултиплексни платформи, мултиплексната платформа за имуноанализ (Meso Scale Discovery, MSD) представлява комбинация от електрохимилуминесценция и шарнирни масиви с ултраниски граници на откриване. Надеждността на измерванията на цитокини с помощта на MSD платформа е оценена в две скорошни проучвания [11, 12]; нито едно от тези проучвания обаче не разглежда възможността за измервания в големи популационни кохорти, подходящи за напредък в изследванията на имунитета и стареенето. Данните от тези проучвания са ограничени от характеристиките на пациента [млади мъже с риск от заразяване с ХИВ] [11] или малък размер на пробата [н = 10] от проучванията [12].
В кохортни проучвания с голяма популация наетите участници са предимно здрави в изходното ниво на изследването и изследователите се стремят да уловят дори фините патофизиологични промени в възпалителния отговор, за да идентифицират високорискови индивиди. Освен това, повечето проучвания използват единична кръвна проба, като се приема, че едно измерване представлява дългосрочното състояние на възпаление на индивида. Досега не са провеждани проучвания, целящи да оценят времевата надеждност на провъзпалителните цитокинови панели и да характеризират корелациите с метаболитните фенотипи в преобладаващо здрава кохорта.
Поради това имаме за цел да оценим надеждността на десет цитокини [интерферон гама (IFN-γ), интерлевкин-1бета (IL-1β), интерлевкин-2 (IL-2), интерлевкин-4 (IL-4), интерлевкин-6 ( IL-6), интерлевкин-8 (IL-8), интерлевкин-10 (IL-10), интерлевкин-12p70 (IL-12p70), интерлевкин-13 (IL-13) и фактор на туморна некроза алфа (TNF-α )] измерена в човешка плазма с помощта на платформата MSD за период от 4 месеца. При вторичните анализи ние характеризирахме връзките в напречно сечение между концентрациите на цитокини и метаболитните фенотипове.
Резултати
Таблица 1 представя базовите характеристики на участниците в проучването. Общо в проучването са включени 124 жени и 83 мъже. Средната възраст на участниците в проучването е 55,4 години за жените и 57,6 години за мъжете. Участниците са имали среден индекс на телесна маса (ИТМ) от 26,1 kg/m 2 (78% мъже са имали BMI ≥ 25,0 kg/m 2; 50% жени са имали BMI ≥ 25,0 kg/m 2) и обиколка на талията (WC) от 93,0 см. Средните стойности на систолното и диастоличното кръвно налягане са съответно 136 mmHg и 88 mmHg. Кръвни проби бяха събрани от повечето участници (90%) след гладуване през нощта, а от останалите вземането на кръв беше извършено произволно.
Таблица 2 представя вътрешнокласовите корелации (ICC) и 95% доверителни интервали (CI), показващи надеждността на измерванията на цитокините за период от 4 месеца, общо и по пол. Като цяло оценките за надеждност варират от добри до справедливи, като IL-6, IL-8 и TNF-α показват най-високи ICC (0,60 Таблица 2 Повторни измервания на концентрациите на цитокини, общо и по пол, с прогнозни ICC
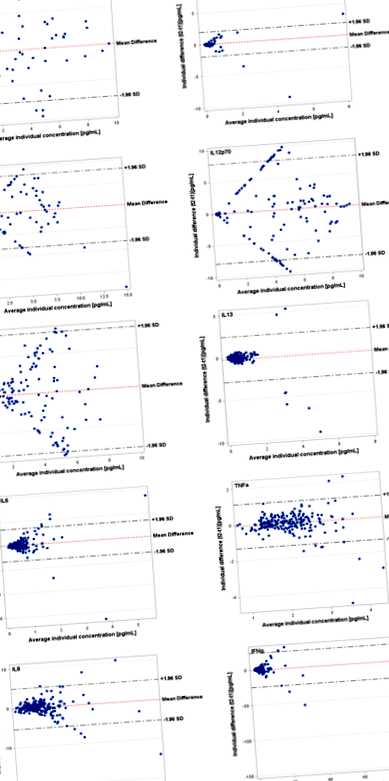
Тези данни бяха допълнително подкрепени от парцелите на Bland-Altman, които показаха съответстващи високи нива на съгласие и симетрични разпределения за цитокини с по-високи ICC (TNF-α, IL-6, IL-8, IL-10, IL-13) и намалени нива на споразумения и разпръснати разпределения за тези цитокини с ниски ICC (IL-1β, IL-2, IL-4, IL-12p70) (Фиг. 1).
Графики на Bland-Altman, показващи съгласието между логарифмично трансформирани концентрации на цитокини в началото и 4 месеца по-късно във връзка със средните концентрации за всеки индивид. Съгласие на многократни измервания (ос y) по отношение на средните концентрации (ос x) за всеки индивид. Хоризонталните линии показват средната разлика и 95% CI на границите на съгласие, които се определят като средната разлика +/− 1,96 пъти стандартното отклонение на разликите
При анализи според възрастови категории може да се наблюдава нарастващ модел на медианните концентрации на плазмата за IL-2, IL-6, IL-8, IFN-γ и TNF-α, докато средните концентрации на останалите цитокините остават почти непроменени (вж. фиг. 2). Таблица 3 представя коефициентите на частична корелация на Spearman между средните концентрации на биомаркер и антропометричните параметри, високочувствителния С-реактивен протеин (hsCRP) и физическата активност. Сред всички цитокини IL-6 изглежда е най-силно свързан с ИТМ (ρ: 0,36; 95% CI: 0,23–0,47), WC (ρ: 0,41; 95% CI: 0,28–0,51) и hsCRP (ρ: 0,53; 95% CI: 0,41–0,63). По-слаби положителни корелации с ИТМ, обиколка на талията и hsCRP могат да се наблюдават и при TNF-α (ρ: 0,20; 95% CI: 0,07–0,33; ρ: 0,16; 95% CI: 0,03–0,29 и ρ: 0,22; 95% CI: съответно 0,07–0,36). Вижда се обратна, макар и слаба корелация за IL-1β и ИТМ (ρ: -0,19; 95% CI: - 0,37-0,01), докато IL-10 и IFN-γ корелират с hsCRP (ρ: 0,19; 95% CI: 0,03–0,33 и ρ: 0,23; 95% CI: 0,08–0,37, съответно). IL-6 и TNF-α бяха обратно корелирани с физическата активност (ρ: -0,12; 95% CI: - 0,26-0,01 и ρ: -0,15; 95% CI: - 0,28-0,02). Повечето от останалите корелации са с незначителен мащаб.
Графични кутии, визуализиращи разпределението на log трансформирани концентрации на цитокини, стратифицирани по възрастови трети. Тази цифра представлява разпределение на интерлевкин 1-бета (IL-1β), интерлевкин 2 (IL-2), интерлевкин 4 (IL-4), интерлевкин 6 (IL-6), интерлевкин 8 (IL-8), интерлевкин 10 ( IL-10), интерлевкин 12p70 (IL-12p70), интерлевкин 13 (IL-13), интерферон гама (IFN-γ) и фактор за туморна некроза алфа (TNF-α) според нарастващите възрастови категории (червено: 44.9–54.7 години, зелено: 54,8–58,8 години и лилаво: 58,9–64,0 години). Концентрациите са от плазмени проби, събрани по време на първото измерване
И накрая, за да улесним прилагането на настоящите резултати за коригиране на измерванията в бъдещи проучвания, ние предоставяме оценки на истинския спрямо наблюдавания риск в зависимост от ICC на цитокините (Допълнителен файл 5). Разликите между хипотетичните съотношения на риска (от 1,5, 2,5 и 3,5) и наблюдаваните съотношения на риска са причинени от (несъвършената) надеждност на биомаркер поради интра-индивидуални вариации. Като пример, ако някой иска да изследва връзката експозиция-резултат на IL-8 въз основа на една мярка, измереният IL-8 би довел до подценяване на истинското съотношение на риска. Наблюдаваното съотношение на риска би било например 2,3, докато действителното съотношение на риска е 3,5, като се вземе предвид специфичният ICC на IL-8 (0,64).
Дискусия
В това проучване, проведено сред предимно здрави индивиди, ние оценихме надеждността на циркулиращите концентрации на десет цитокини, измерени с нова MSD платформа за период от 4 месеца. Като цяло по-голямата част от цитокините са над границата на откриване (в най-малко 85,3% от пробите). Оценките за надеждност варират от добри до лоши. Цитокините IL-6, IL-8, TNF-α, IL-10, IL-13 и IFN-γ показват като цяло добра надеждност (ICC> 0,40), докато IL-1β, IL-2, IL-4 и IL -12p70 показа лоша надеждност (ICC Таблица 4 ICC с 95% CI на възпалителни цитокини при предимно здрави участници, публикувани преди това в литературата
Нашите резултати биха могли да насочат изследователите на бъдещи проспективни изследвания на плазмените цитокини да оценят истинския относителен риск предвид наблюдавания относителен риск. По-специално, ICC могат да се използват за коригиране на относителни рискове или коефициенти на корелация и техните доверителни интервали за случайни вариации в рамките на човек, за да се отчете затихването, въведено чрез грешка в измерването [21]. Корекцията на грешките в измерването би имала съществен ефект върху крайната оценка за цитокини със скромни ICC, както е показано за други изследвания на биомаркери [22].
Широк спектър от фактори могат да повлияят на нивата на цитокините в циркулацията. Те включват възраст, пол, статус на затлъстяване и общо възпалително състояние. Поради това оценихме дали наблюдаваните резултати за надеждността на измерените цитокини също могат да бъдат повлияни от някои от тези фактори. Нашите данни не разкриват изразени разлики по слоеве на възраст, пол, затлъстяване и нива на CRP, аргументирайки евентуалното влияние на който и да е от тези фактори върху наблюдаваните оценки на надеждността. Различия между циркулиращите цитокинови концентрации при индивидите също могат да съществуват поради сезонната, хормоналната или циркадната физиологична вариабилност. Концентрациите на цитокини са по-високи при следобедните измервания в сравнение със сутрешните измервания, като се предполага, че отразяват влиянието от циркулиращия кортизол [23]. Тези открития са в съответствие с предишна работа, показваща дневна регулация на възпалителните медиатори, включително IL-6 при здрави индивиди [24]. В нашето проучване обаче вариациите може да са били ограничени поради ограничен интервал от време, когато са взети пробите.
Годишната сезонност също се предполага, че е важен фактор на околната среда, влияещ върху производството на цитокини [25]. Сезонните вариации могат да отразяват физиологичен отговор на промените в дневните часове, вътрешната или външната температура или вариациите във физическата активност през зимния и летния сезон. Например, в кохорта от 530 здрави индивида, производството на няколко цитокини (IL-1β, IL-6 и TNF-α) показва значителни пикове през лятото в сравнение с други сезони [25]. Тъй като направихме първо и второ измерване през различни сезони, между октомври – март (есен/зима) и февруари – юли (зима/пролет/лято), и имахме само една кръвна проба за време, не можем да определим дали вариациите са зависими от сезонността. Тъй като обаче не открихме големи разлики между двете измервания, бихме могли да изключим основното влияние на сезонността върху стабилността на биомаркерите. Подобно на нашите констатации, предишно проучване за надеждност, оценяващо сезонната променливост на IL-1β, IL-6, IL-8 и TNF-α (н = 48) не са наблюдавани съществени вариации през сезоните [20].
Нашето проучване има няколко силни страни. Приложихме електрохимилуминесцентната мултиплексна платформа за имуноанализ (Meso Scale Discovery, MSD) като нова удобна техника, която може да бъде полезна за бъдещи епидемиологични проучвания, в които работят голям брой участници. Нашата проучвана популация включваше двата пола и размерът на извадката ни беше сравнително голям за валидиращо проучване в сравнение с повечето проучвания за надеждност в литературата (вж. Допълнителен файл 4). Измерваните от нас биомаркери представляват различни аспекти на имунно-възпалителните пътища по време на адаптивни и вродени имунни отговори, като имат противовъзпалителни (IL-1β, IL-2, IL-8, IL-12p70, TNF-α, IFN-γ) или анти възпалителни (IL-4, IL-10) ефекти или и двете (IL-6, IL-13).
Заключение
Това проучване е предоставило първи редове доказателства, според нашите познания, за надеждността на концентрациите на цитокини, измерени с нова методология на MSD платформа. Нашите резултати предполагат, че единични измервания на IL-6, IL-8, TNF-α, IL-10, IL-13 и IFN-γ могат точно да оценят вариабилността на биомаркера в рамките на отделен човек за период от 4 месеца и биха могли да бъдат подходящи за употреба в проспективни епидемиологични и клинични проучвания. Такива проучвания са силно оправдани, за да характеризират асоциациите на цитокини с фенотипове и заболявания, свързани със стареенето.
- Диетични фибри, енергиен прием и хранителен статус по време на лечението на хронични деца
- Еозинофилен езофагит текущо състояние и бъдещи насоки Педиатрични изследвания
- Оценка на хранителните хранителни вещества за клиничните резултати при субекти с хронично-прогресивен множествен
- Диетична диаграма за пациент с хроничен панкреатит, хроничен панкреатит Диетична диаграма Либрат
- Хранителни рецепти могат да лекуват хронични заболявания