Катедра по анатомия, клетъчна биология, физиология и биофизика, Институт по биология, Държавен университет в Кампинас, Кампинас, Бразилия
Катедра по анатомия, клетъчна биология, физиология и биофизика, Институт по биология, Държавен университет в Кампинас, Кампинас, Бразилия
Катедра по анатомия, клетъчна биология, физиология и биофизика, Институт по биология, Държавен университет в Кампинас, Кампинас, Бразилия
Катедра по анатомия, клетъчна биология, физиология и биофизика, Институт по биология, Държавен университет в Кампинас, Кампинас, Бразилия
Катедра по анатомия, клетъчна биология, физиология и биофизика, Институт по биология, Държавен университет в Кампинас, Кампинас, Бразилия
Катедра по анатомия, клетъчна биология, физиология и биофизика, Институт по биология, Държавен университет в Кампинас, Кампинас, Бразилия
Катедра по анатомия, клетъчна биология, физиология и биофизика, Институт по биология, Държавен университет в Кампинас, Кампинас, Бразилия
Катедра по анатомия, клетъчна биология, физиология и биофизика, Институт по биология, Държавен университет в Кампинас, Кампинас, Бразилия
Адрес за заявки за повторно отпечатване и друга кореспонденция: A. C. Boschero, Катедра по анатомия, клетъчна биология, физиология и биофизика, Институт по биология, Държавен университет. на Campinas (Unicamp), Campinas, SP (e-mail: [имейл защитен]).
Резюме
бременността е свързана с периферна инсулинова резистентност, която се компенсира от повишена секреция на инсулин при нормални обстоятелства (3, 19, 30). Панкреатичните островчета претърпяват големи структурни и функционални промени по време на бременност, за да отговорят на това повишено търсене на инсулин (1, 30, 34). Тези промени при плъховете достигат връх около дни 14–16 бременност и плацентарните лактогени и/или пролактиновите хормони играят важна роля в този процес (6, 8, 23, 33).
Механизмите, отговорни за увеличаване на капацитета на β-клетките да реагират на по-голямо търсене на инсулин по време на бременност, са много подходящи в контекста на проучванията за диабет тип 2, тъй като те могат да дадат улики за потенциални терапевтични средства. Неспособността на майчините β-клетки да отговорят на това повишено търсене на инсулин може да доведе до развитие на непоносимост към глюкоза и до гестационен захарен диабет (10, 11).
Към днешна дата са използвани няколко модела на експериментално затлъстяване. Сред тях използването на богата на мазнини диета е интересен подход, тъй като тя наподобява прекомерното приемане на хора, засягайки специфични тъкани, участващи в регулирането на енергийните разходи (9, 36). Подобрение за този модел е използването на диетата в кафенето, която е дори по-близо до приема на храна от човека, тъй като е по-вкусна, силно увеличава затлъстяването и се предлага да бъде моделът на гризачите, който най-добре отговаря на човешкото затлъстяване (25, 27, 28).
В това проучване ние изследвахме глюкозната хомеостаза и функционалността на панкреатичните островчета при затлъстели плъхове, индуцирани от бременни и бременни в кафенето. Установихме, че глюкозният толеранс е нарушен при затлъстели бременни и небременни плъхове, хранени с кафене. Индуцираното от диетата затлъстяване в кафетерията нарушава секрецията на инсулин, индуцирана от глюкоза, толбутамид и KCl в прясно изолирани островчета. Този инхибиторен ефект обаче се преодолява в островчетата от бременни плъхове, вероятно в резултат на увеличаване на метаболитната активност, свързано с по-добро вътреклетъчно поведение на Ca 2+, при особен приток на Ca 2+.
Всички приложими институционални и правителствени разпоредби относно етичната употреба на животните са спазени по време на това изследователско проучване. Експерименталните процедури са одобрени от университетския комитет по етика в опитите върху животни от Държавния университет в Кампинас (протокол номер 1198-1).
Химикали.
d - [U-14 C] глюкоза и 125 I-човешки рекомбинантен инсулин са закупени от G. E. Health Care (Little Chalfont, Бъкингамшир, Великобритания). Приготвянето на MTS/PMS беше от воден анализ на CellTiter96 (Promega, Madison, WI). Използвани са стандартни търговски комплекти за измерване на общия холестерол в плазмата (CHOL), триглицеридите (TG) (и двете от Roche Diagnostics; Mannheim, Германия) свободни мастни киселини (FFA; Wako Chemicals, Neuss, Германия) и албумин и общите протеини (Laborlab; Guarulhos, SP, Бразилия). Fura-2 AM е закупен от Invitrogen (Карлсбад, Калифорния). Рутинни реактиви са закупени от Sigma-Aldrich (Сейнт Луис, Мисури).
Животни, хранителен режим и състав на диетата.
Характеристики на животните.
В края на периода на хранене и на 15-ия/16-ия ден от бременността плъховете бяха умъртвени чрез обезглавяване и бяха измерени теглото на перигонадалните и ретроперитонеалните мастни накладки. Нивата на кръвната глюкоза се измерват с помощта на глюкозен анализатор (Accu-Check Advantage II, Roche, Базел, Швейцария). Плазмените CHOL, TG, FFA, албуминът и общите протеини бяха измерени с помощта на стандартни търговски комплекти, съгласно инструкциите на производителя. Инсулинът се измерва чрез RIA, като се използва инсулин от плъх като стандарт.
Тест за интраперитонеален глюкозен толеранс.
На 14–15 дни след началото на бременността всички групи плъхове бяха подложени на интраперитонеален тест за толерантност към глюкоза (ipGTT). Храната се изтегля 12 часа преди експеримента, след което плъховете се претеглят и се взема проба от базална кръв от върха на опашката (т = 0 минути). Впоследствие всеки плъх получава натоварване с глюкозен разтвор (2 g/kg ip телесно тегло) и допълнителни кръвни проби се събират на 15, 30, 60 и 120 минути след инжектирането. Нивата на глюкоза по време на теста бяха измервани незабавно. Площта под кривата се изчислява от стойности за всеки плъх.
Изолация на островчета, секреция на инсулин и съдържание на инсулин.
Островчета се изолират от хранени плъхове (бременни или не; 14 седмици лечение, 15-ти/16-и ден от бременността) чрез разграждане на колагеназа на панкреаса и след това се подбират с микропипета под микроскоп, за да се изключат замърсяващи тъкани. Групи от четири островчета бяха първо инкубирани за 45 минути при 37 ° С в бикарбонатен буфер на Krebs-Ringer (KRB), съдържащ глюкоза 5.6 mmol/l и уравновесени с 95% O2-5% CO2, рН 7.4. След това разтворът беше заменен с прясна KRB и островчетата бяха инкубирани за още 90 минути със среда, съдържаща 2.8, 5.6, 8.3, 11.1, 16.7 или 27.7 mmol/l глюкоза; 2,8 mmol/l глюкоза плюс 40 mmol/l KCl; или 2,8 mmol/l глюкоза плюс 100 μmol/l толбутамид. Съдържащата се инкубационна среда (mmol/l): 115 NaCl, 5 KCl, 24 NaHCO3, 2.6 CaCl2, 1 MgCl2 и 25 HEPES; рН 7,4, допълнено с BSA (0,3% тегл./об.; Sigma). За измерване на общото съдържание на инсулин се събират групи от 10 островчета и се прехвърлят в епруветки от 1,5 ml. Към пробите се добавя алкохолно-киселинен разтвор (1 ml; крайна концентрация от 20% етанол и 0,2 mmol/l HCl), последвано от обработка с ултразвук на панкреатичните островчета (3 пъти, 10-s импулси). Инсулинът в средата беше измерен чрез RIA.
ДНК анализ.
Панкреатичните островчета се хомогенизират чрез кратки изблици на ултразвук в 500 μl буфер, съставен от 50 mmol/l Tris · HCl, 10 mM EDTA, 1% SDS (pH 8.1). ДНК се екстрахира във фенол/хлороформ, утаява се в етанол и се ресуспендира в нисък трис-EDTA буфер. Впоследствие РНК се отстранява чрез смилане с 1 μg RNase A (Sigma) за 30 минути при 37 ° С. По този начин ДНК се определя количествено с помощта на търговски комплект (Quant-iT PicoGreen, Invitrogen), съгласно инструкциите в ръководството.
Окисляване на глюкозата.
Групи от 25 островчета бяха инкубирани в продължение на 2 часа при 37 ° C в KRB, допълнени с 11,1 mmol/l глюкоза със следи от г - [U-14 C] глюкоза (20 μCi/ml) за образуване на 14 CO2. Метаболизмът на глюкозата на островчетата беше спрян с HCl (1 N) с последващо клетъчно разцепване. 14 освободен CO2 се абсорбира от NaOH (1 mol/l) за 1 h при 4 ° C, при което се получава NaH 14 CO3. Добавя се сцинтилационна течност и радиоактивността се отчита в течен сцинтилационен брояч.
Метаболитна активност.
Метаболитната активност на островчетата беше оценена чрез измерване на редуциращи еквиваленти, а именно NAD (P) H, чрез редукция на водоразтворима тетразолиева сол, MTS (3- [4,5, диметилтиазол-2-ил] -5- [3-карбоксиметокси -фенил] -2- [4-сулфофенил] -2Н-тетразолий, вътрешна сол) към съответния му формазанов продукт в жива тъканна система (29, 33). За тази цел групи от 100 прясно изолирани островчета бяха инкубирани в продължение на 150 минути в стерилен буфер Krebs/HEPES, съдържащ 11,1 mmol/l глюкоза, 15% MTS и 1% феназин метосулфат (PMS). Абсорбцията е получена при 490 nm, на всеки 10 минути след добавяне на реагентния разтвор, съгласно инструкциите на производителя.
Измерване на вътреклетъчния Са 2+ .
PCR в реално време.
Общата клетъчна РНК се извлича от групи от 500 островчета, използвайки реагент TRIzol. Два микрограма от обща РНК бяха обратно транскрибирани, използвайки обратна транскриптаза и произволни хексамерни праймери. PCR реакциите в реално време се провеждат в общ обем от 15 μl, използвайки технологията Fast SYBR Green (Applied Biosystems, Foster City, CA). Пробите се денатурират при 94 ° С за 10 минути, последвани от 40 PCR цикъла при 95 ° С/60 ° С. PCR амплификациите се извършват в два екземпляра. Чистотата на амплифицираните PCR продукти се проверява чрез криви на топене. Експресията на целевите гени се нормализира спрямо нивата на експресия на домакинския ген GAPDH. Последователността на използваните праймери бяха (5′-3 ′): саркоплазматичен/ендоплазмен ретикулум Ca 2+ ATPase 2a (SERCA2a) напред: TGGTACTGGCTGATGATAACTTCTCC, обратен: TGTTGTTGTAGATGGCACGGC; L-тип-α1.2 чувствителен на напрежение Ca 2+ канал (CaVα1.2) напред: GACACAGAGAGGAAGTTCAAGGG, обратен: GCGTGGGCTCCCATAGTTG; L-тип -β2 субединица чувствителен на напрежение Ca 2+ канал (CaVβ2) напред: TGCACTGGAGTATCCAAGCG, обратен: CCACTTCGTCTCAGCCACTC.
Статистически анализ.
Данните бяха изразени като средни стойности ± SE за броя на плъховете и пробите (н) посочено. Статистически анализ беше извършен от Student's т-тест или двупосочен ANOVA, последван от посттест на Newman-Keuls. P 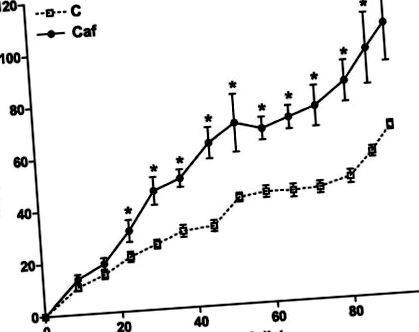
Фиг. 1.Увеличаването на теглото по време на периода на хранене се измерва ежеседмично при плъхове, хранени на чау (пунктирани линии; С) или на кафетерия (плътни линии, Caf) диета. Първоначалните телесни тегла са съответно 218 ± 3 g и 215 ± 4 g за C и Caf (незначително). Стойностите се изразяват като средни стойности ± se; н = 10–20 плъхове за всяка група. *P
Таблица 1. Телесно тегло и тегло на мазнините в края на диетичното лечение
Стойностите се изразяват като средни стойности ± SE. С, небременна; CP, бременна; Кафене, кафетерия диета хранени небременни; и CafP, кафетерия, хранена бременна.
Таблица 2. Глюкоза в кръвта, плазмен инсулин, CHOL, TG, FFA, албумин и нива на общите протеини и индекс на инсулин/глюкоза при небременни и бременни плъхове, хранени с диета в чау или кафе
Стойностите се изразяват като средни стойности ± SE. Ins/Glu, инсулин/глюкоза; ХОЛ, холестерол; TG, триглицериди; FFA, свободни мастни киселини.
* P † P ‡ P § P −1 · мин −1] (P
Фиг. 2.Кръвна захар (A) и плазмен инсулин (Б.) по време на интраперитонеален тест за толерантност към глюкоза (ipGTT) от небременни (твърди символи) и бременни (отворени символи) плъхове на дни 14 и 15 на бременност при плъхове, хранени с чау (пунктирани линии) или кафетерия (плътни линии) диета. Стойностите се изразяват като средни стойности ± se; н = 6–20 плъхове от три различни третирани групи. Символите представляват статистически разлики между групите: *P
Съдържание на инсулин на островчета и секреция на инсулин, индуцирана от глюкоза, KCl и толбутамид.
Общо съдържание на инсулин при бременност, повишено в островчетата от плъхове CafP в сравнение с другите групи (43,7 ± 3,7 срещу C 15,6 ± 1,2; CP 19,1 ± 1,5; Caf 12,6 ± 1,1, ng/ng ДНК P
Фиг. 3.Сравнителни криви на доза-отговор на глюкозата за изолирани островчета от небременни (плътни символи) и бременни (отворени символи) плъхове, хранени на диета с чау (пунктирани линии) или кафетерия (плътни линии). Островчетата се инкубират в продължение на 90 минути с нарастващи концентрации на глюкоза и освободеният инсулин се нормализира от съответното съдържание на ДНК на островчета. Стойностите се изразяват като средни стойности ± se; н = 8–15 групи островчета от три различни плъха. Символите представляват статистически разлики между групите във всяка концентрация на глюкоза: #P
Фиг. 4.Инсулинова секреция, индуцирана от KCl и толбутамид, при 2,8 mmol/l глюкоза, в изолирани островчета от плъхове C, CP, Caf и CafP. Стойностите на инсулина се нормализират от съответното съдържание на ДНК на островчета. Стойностите са средни стойности ± se; н = 8–10 групи островчета от три различни плъха. Символите в горната част на всяка колона представляват статистически разлики между групите, *P
Окисляване на глюкозата и метаболитна активност.
Тъй като секрецията на инсулин от β-клетките е тясно свързана с метаболизма на глюкозата, ние анализирахме някои метаболитни показатели в островчета от затлъстели и бременни плъхове. При 11,1 mmol/l глюкоза, превръщането на г - [U-14 C] глюкоза в 14 CO2 (окисление на глюкоза) е по-високо в островчетата от плъхове CafP, в сравнение с останалите групи (CafP 2,9 ± 0,1 срещу C 2,1 ± 0,2; CP 2,0 ± 0,1 и Caf 1,9 ± 0,1 pmol/ng ДНК · 2 часа; P
Фиг. 5.Метаболитна активност на островчета, стимулирани с 11,1 mmol/l глюкоза, нормализирана от съдържанието на ДНК в островчетата. Стойностите са средни стойности ± se; н = 12 партиди островчета от три различни плъха. Символите в горната част на всяка колона представляват статистически разлики между групите във всяка точка от времето, #P
Индуцирани от глюкоза и толбутамид цитоплазмени изменения на Са 2+.
След излагане на панкреатичните островчета на 11,1 mmol/l глюкоза, концентрациите на цитозолен Ca 2+ бяха увеличени във всички групи (фиг. 6, A-д). Амплитудата на измененията на Ca 2+, измерена след 3–6 минути експозиция на глюкоза, е значително по-ниска при островчетата от Caf в сравнение с останалите три групи (фиг. 6Е.) (P Концентрациите 2+ също бяха увеличени от толбутамид (100 μmol/l) във всички групи, а площта под кривата беше по-ниска в Caf в сравнение с C островчета (0.72 ± 0.14 срещу 1.20 ± 0.10 F340/F380 · min; P
Фиг. 6.Представителни криви на промени във вътреклетъчните концентрации на Ca 2+ в отговор на 11,1 mmol/l глюкоза (барове) в островчета, изолирани от C (A), CP (Б.), Caf (° С) и CafP (д) плъхове. Средните стойности ± se представляват амплитудата в съотношение единици (Е.), честота (F) и амплитуда на трептенията в съотношения (G) от [Ca 2+] i при 11,1 mmol/l глюкоза. н = 6–10 островчета от три различни плъха; същите букви над колоните показват сходство между групите, P
Експресия на Cavα1.2, Cavβ2 и SERCA2a.
Намаление и на Cavα1.2 (64% спрямо C; P
Фиг. 7.PCR определяне в реално време на Cavα1.2 (A), Cavβ2 (Б.) и SERCA2a (° С) експресии на тРНК в изолирани островчета от плъхове C, CP, Caf и CafP. Данните бяха коригирани за експресия на GAPDH и са показани като процент от C; означава ± se; н = 5–8. Символите в горната част на всяка колона представляват статистически разлики между групите, *P
Нарушеният глюкозен толеранс, наблюдаван при затлъстели плъхове, бременни и небременни, е в съответствие с няколко наблюдения, показващи, че затлъстяването предизвиква инсулинова резистентност (4, 16, 22, 25). Интересното е, че плазмената глюкоза на гладно и хранене е нормална при инсулиноустойчивите плъхове, особено при бременни групи, което показва, че по-високите плазмени нива на инсулин са достатъчни за поддържане на нормогликемия. Резистентността към ендогенен инсулин при плъхове се развива между дни 16 и 19. от бременността (18), оправдаващо нормалните нива на инсулин, наблюдавани при бременни плъхове с диета по време на ipGTT на 14-15-ия ден от бременността.
По-рано са наблюдавани намаления на секрецията на инсулин, стимулирани от глюкоза в островчета от плъхове, хранени с високо въглехидратни, високобелтъчни или високолипидни диети (31). По този начин се очаква плъховете със затлъстяване в кафенето да имат и по-нисък капацитет за освобождаване на инсулин. Независимо от това, възстановяването на този капацитет по време на бременност е от решаващ интерес и информацията относно вътреклетъчните събития, водещи до тази засилена секреция на инсулин, все още не е известна. Следователно, нашите резултати, показващи повишена метаболитна активност, подобрено боравене с Ca 2+ и възстановяване на секрецията на инсулин в β-клетките на панкреаса на плъхове със затлъстяване по време на бременност са, доколкото ни е известно, първите данни, които допринасят за изясняването на молекулярния механизъм на това явление. От друга страна, то е в противоречие с намалената секреция на инсулин, наблюдавано при бременни плъхове с високо съдържание на наситени мазнини (15). Разбираме, че различните открития може да са резултат от различни научни стратегии (вид и време на диета и време на бременност), но е ясно, че диетата в кафенето е много по-близка до прехранването при хора от другите експериментални модели.
Перспективи и значение
Настоящите наблюдения показват, че диетата в кафенето предизвиква затлъстяване и инсулинова резистентност, както и намалява секрецията на инсулин, стимулирана от глюкоза и други деполяризиращи агенти. Инхибиторният ефект на затлъстяването върху секрецията на инсулин изглежда се дължи на дефект в мобилизацията на Ca 2+ от тези острови, независимо от промените в метаболизма на островите. Бременността възстановява секреторния капацитет в островчетата от затлъстели плъхове, което е свързано с възстановяването на способността на β-клетките да управляват Са 2+, особено чрез увеличаване на капацитета на поемане на Са 2+. Изглежда, че това явление зависи поне отчасти от увеличаването на експресията на L-Type Ca 2+ канали подединица α1.2. Освен това, по време на бременност метаболитната активност на панкреатичните островчета се засилва при плъхове със затлъстяване, което може да увеличи реакцията на глюкозата на панкреасните β-клетки. По-нататъшни проучвания, насочени към изясняване на вредните ефекти на затлъстяването върху движенията на Ca 2+ и секрецията на инсулин, както и откриването на агенти, които помагат на островните клетки да възстановят такава способност по време на бременността, могат да помогнат при разработването на стратегии за поддържане на нормогликемия при Пациенти със затлъстяване с диабет тип 2.
Авторите не декларират конфликт на интереси.
- Спленектомията отслабва затлъстяването и намалява хиперсекрецията на инсулин при плъхове със затлъстяване в хипоталамуса -
- Мултиорганна чувствителност към инсулин при слаби и затлъстели пациенти за диабет
- Остеопонтинът е необходим за ранното начало на инсулинова резистентност, индуцирана от високо съдържание на мазнини при мишки
- Почти една трета от населението на света е със затлъстяване или с наднормено тегло, показват нови данни от Институт за
- Дължина на иглата при пациенти със затлъстяване, използващи инсулин, диабетици - изглед в пълен текст
