Резюме
Безалкохолната мастна чернодробна болест (NAFLD) е клиничнопатологичен субект, който все повече се признава като голяма тежест за здравето в развитите страни. Той включва спектър от чернодробни увреждания, вариращи от проста стеатоза до неалкохолен стеатохепатит (NASH), напреднала фиброза и рядко прогресия до цироза. Последните проучвания подчертават ролята на инсулиновата резистентност, оксидативен стрес и последващо липидно пероксидиране, провъзпалителни цитокини, адипокини и митохондриална дисфункция в развитието и прогресирането на NAFLD. Освен това натрупването на доказателства подкрепя връзка между NAFLD и метаболитния синдром. Въпреки че данните са главно епидемиологични, патогенезата на NAFLD и метаболитният синдром изглежда имат общи патофизиологични механизми, като фокусът е върху инсулиновата резистентност като ключов фактор. Този преглед обобщава настоящите знания за епидемиологията, патофизиологията и диагностиката както на NAFLD, така и на метаболитния синдром и констатациите, които силно подкрепят връзката на безалкохолната мастна чернодробна болест като възможен компонент в групата на метаболитния синдром.
Безалкохолната мастна чернодробна болест (NAFLD) е най-често срещаното чернодробно заболяване, тъй като разпространението му се оценява на 20-30% в общото население на западните страни 1. NAFLD се среща като хистологичен спектър на заболяването и включва подвидовете проста стеатоза и неалкохолен стеатохепатит (NASH). Смятало се, че това е доброкачествено състояние, но сега все повече се признава като основна причина за свързаната с черния дроб заболеваемост и смъртност. Проучванията показват, че NAFLD може да прогресира до цироза, чернодробна недостатъчност и хепатоцелуларен карцином 2. Доказано е, че NAFLD е силно свързана с характеристиките на метаболитния синдром. Инсулиновата резистентност е ключов патогенен фактор както при NAFLD, така и при метаболитния синдром. Наличните данни от клинични, експериментални и епидемиологични проучвания показват, че NAFLD може да бъде чернодробната проява на метаболитен синдром 3 .
Метаболитен синдром
Определение - Диагноза
Метаболитният синдром е натрупване на рискови фактори, което значително увеличава вероятността за развитие на атеросклеротично сърдечно-съдово заболяване (ASCVD), захарен диабет тип 2 и хронично бъбречно заболяване. Преобладаващите основни рискови фактори изглежда са коремно затлъстяване, атерогенна дислипидемия, хипертония, повишена плазмена глюкоза, протромботично състояние и провоспалително състояние 4 - 7 .
Няколко организации са се опитали да формулират дефиницията на метаболитен синдром и са използвали прости критерии за неговата диагноза, но това е извън обхвата на настоящия преглед, за да очертае публикуваните дефиниции 8 - 12. През 2001 г. Националната програма за образование на холестерола (NCEP) Панел за лечение на възрастни III (ATP III) въведе прости клинични критерии, които са широко приети, тъй като са лесни за използване в клиничната практика и тъй като голям брой проучвания оценяват тяхната надеждност 13. През 2005 г. Американската сърдечна асоциация (AHA) и Националният сърдечен институт за белите дробове и кръвта (NHLBI) актуализираха критериите ATP III с малки изменения 5. По този начин метаболитният синдром се идентифицира от наличието на три или повече от следните компоненти: коремно затлъстяване (обиколка на талията> 102 cm при мъжете,> 88 cm при жените), повишени триглицериди (> 150 mg/dl или при медикаментозно лечение за повишени нива на триглицериди), намалено ниво на HDL-C (130 mmHg или диастолично кръвно налягане> 85 mm Hg или при антихипертензивно медикаментозно лечение) и нарушена глюкоза на гладно (100 - 125 mg/dl или при антидиабетно медикаментозно лечение) 5 .
Липсата на стандартна дефиниция затруднява сравненията между проучванията. В зависимост от използваната дефиниция, оценките за разпространението на метаболитния синдром ще се различават. Въпреки това, проучвания, сравняващи определенията, съобщават, че всички определения ще идентифицират лица с повишен риск от диабет, сърдечно-съдови заболявания и смъртност от всички причини 7, 10. Данните показват, че разпространението на метаболитния синдром варира значително в различните популации. Според Националното изследване на здравето и прегледите (NHANES) III (1988-1994 г.) и NHANES 1999-2000 г., преобладаващото възрастово разпространение на МС е съответно 24,1% и 27% 14. В Гърция през 2003 г. беше проведено проучването MetS-Гърция и възрастово коригираното разпространение на метаболитния синдром в общата популация беше 23,6%. Това е подобно при мъжете (24,2%) и жените (22,8%), но разпространението се увеличава с възрастта и при двата пола. Това може да се отдаде на подобна възрастова тенденция във всеки от компонентите на метаболитния синдром. Повечето лица с МС са имали три компонента на синдрома (61%), 29% са имали четири и 10% са имали всичките пет компонента.
Най-честите отклонения са коремното затлъстяване (72%) и артериалната хипертония (66%). Разпространението на повишената глюкоза (включително пациенти със захарен диабет) е неочаквано високо (53%). Разпространението на повишените нива на триглицеридите сред субектите с МС е 62%, а на ниските нива на HDL-C е 54% 15 .
Патофизиология
Инсулиновата резистентност и компенсаторната хиперинсулинемия имат централна етиологична роля в развитието на МС 16. Данните от животински модели, както и проучвания при хора, идентифицират свръхпроизводството на липопротеини с много ниска плътност на черния дроб (VLDL) като критичен основен фактор за развитието на хипертриглицеридемия, една от основните характеристики на МС. Намаляването на HDL-холестерола е следствие от промени в състава и метаболизма на HDL 17. Затлъстяването също е описано като основен причинителен компонент в развитието на МС. Както в мускулните клетки, така и в адипоцитите на индивиди със затлъстяване, инсулинът се свързва с неговия рецептор, рецепторното фосфорилиране, активността на тирозин киназата и фосфорилирането на IRSs. Повишеното съхранение на мастна енергия при затлъстяване води до увеличен поток на FFA към други тъкани и увеличено съхранение на триглицериди в тези тъкани, които насърчават инсулиновата резистентност и други неблагоприятни ефекти 18 .
Натрупаната висцерална мастна тъкан произвежда и секретира редица адипоцитокини, като TNF-α и IL-6, които предизвикват развитие на хипертония 19. Хората с МС имат значително по-висока скорост на реабсорбция на натрий и вода на проксимално тубулно ниво 20. Инсулинът насърчава производството на ендотелин-1 (ЕТ-1) от ендотелните клетки, както и действието на ЕТ-1 в съдовите гладкомускулни клетки, причинявайки вазоконстрикция и повишена пролиферация на гладкомускулните клетки 21, 22. Инсулинът също така повишава активността на симпатиковата нервна система 23 .
Хроничното възпаление често се свързва с МС и основните възпалителни медиатори са адипоцитокините и FFA. Провъзпалителните цитокини, които са свързани с МС, включват CRP, TNF-α, IL-6 и други и водят до по-голяма инсулинова резистентност и липолиза на запасите от триглицериди в мастната тъкан, в засилено производство на чернодробна глюкоза и VLDL. Цитокините и FFA също увеличават производството на фибриноген и инхибитор на активатора на плазминоген-1 (PAI-1) от черния дроб, което допълва свръхпроизводството на PAI-1 от мастната тъкан, като по този начин предизвиква протромботично състояние 24 .
Безалкохолна мастна чернодробна болест
Определение
NAFLD е клиникопатологичен орган с широк хистологичен спектър, който включва проста стеатоза и стеатохепатит (NASH). Стеатозата се определя чрез оценка на дела на хепатоцитите, съдържащи капчици мазнини. Предложеният долен праг е 5% от хепатоцитите. Характеристиките на стеатохепатита включват хепатоцелуларно увреждане (балониране, апоптоза/некроза, хиалин на Mallory, гигантски митохондрии), възпаление и фиброза (перисинусоидални, перицелуларни) 25, 26. Съществуват различни предложения относно нивото на консумация на алкохол, които могат надеждно да разграничат алкохолния мастен черен дроб и NAFLD. Много центрове приемат, че максимално допустимото ниво на прием на алкохол за определяне на NAFLD е 2 стандартни напитки на ден (140 g етанол/седмица) за мъже и една стандартна напитка на ден (70 g етанол/седмица) за жени 27 .
NAFLD може да бъде категоризиран като първичен или вторичен в зависимост от основната патогенеза. Първичната NAFLD е свързана с инсулинова резистентност и метаболитен синдром. Други състояния, свързани с NAFLD, са пълно парентерално хранене, остър глад, коремна хирургия (напр. Обширна резекция на тънките черва, билиопанкреатична диверсия и йеюнален байпас), употреба на няколко лекарства (напр. Амиодарон, тамоксифен, глюкокортикоиди, синтетични естрогени, дилтиазем, аспирин, метотрексат, силно активна антиретровирусна терапия). Също така се свързва с хепатит С, ХИВ и метаболитни нарушения, т.е.хипобеталипопротеинемия, липодистрофия, хипопитуитаризъм, хипоталамусно затлъстяване, синдром на Вебер-Кристиан, остър черен дроб на бременността, синдром на Рейес и синдром на Мориак 28, 29. Проучванията показват, че професионалното излагане на органични разтворители може да играе роля в развитието на NAFLD 30 и че жените със синдром на поликистозните яйчници могат да имат повишено разпространение на безалкохолно мастно чернодробно заболяване 31 .
Епидемиология - естествена история
Въпреки че е често срещана и потенциално сериозна, естествената история на NAFLD остава слабо изяснена. Смъртността е значително увеличена сред пациентите с NAFLD в сравнение с очакваната смъртност на общото население на същата възраст и пол. Смъртта, свързана с черния дроб, е водеща причина за смъртност, въпреки че абсолютният риск е нисък 2. Пациентите с проста стеатоза имат относително доброкачествена чернодробна прогноза с 1,5% развиваща се цироза и 1% умират от чернодробни причини в продължение на едно до две десетилетия 44. За разлика от това, 30-50% от хората със стеатохепатит ще развият фиброза, 15% ще развият цироза и 3% ще прогресират до терминална чернодробна недостатъчност 3, 38. Проучванията съобщават, че по-възрастната възраст, затлъстяването и наличието на захарен диабет са независими предиктори за тежка чернодробна фиброза при пациенти с неалкохолен стеатохепатит (NASH) 45, 46. Важно наблюдение е, че много пациенти с криптогенна цироза са имали погрешна диагноза NAFLD. Това се дължи на намаляването на хистологичните данни за чернодробна стеатоза, тъй като заболяването преминава в цироза 2. И накрая, NAFLD може да представлява значителен дял от случаите на хепатоцелуларен карцином (HCC). Проучване съобщава, че NAFLD представлява поне 13% от случаите на HCC 47 .
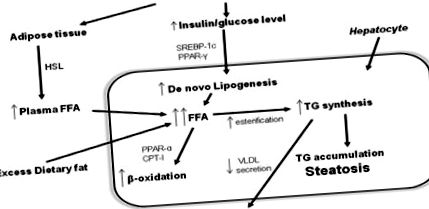
Патофизиология (Фигура 1)
Най-широко приетият модел за обяснение на развитието на NAFLD и прогресирането от проста стеатоза към NASH е "хипотезата с два удара". „Първият удар“ е натрупването на липиди в хепатоцитите, а инсулиновата резистентност е ключовият патогенен фактор за развитието на чернодробна стеатоза. „Вторият удар“ води до увреждане на хепатоцитите, възпаление и фиброза. Факторите, иницииращи второто попадение, са оксидативен стрес и последващо липидно пероксидиране, провъзпалителни цитокини, адипокини и митохондриална дисфункция 52 .
Последните открития при животински модели показват, че натрупването на триглицериди в черния дроб може да бъде хепатозащитно, а не хепатотоксично, тъй като намалява натрупването на свободни мастни киселини в хепатоцитите, тяхното пероксидиране и оксидативен стрес 56. Въпреки това, според "хипотезата за два удара" стеатозата увеличава уязвимостта на черния дроб към "втори удар", оксидативен стрес. Нарушаването на баланса прооксидант/антиоксидант представлява оксидативен стрес. Последиците от оксидативния стрес са липидна пероксидация, клетъчна дегенерация и некроза, апоптоза, проинфламаторна експресия на цитокини, активиране на чернодробни звездни клетки и фиброгенеза. Идентифицирани са множество възможни източници на оксидативен стрес, които включват митохондриална дисфункция, чернодробен цитохром CYP2E1, β-окисление от пероксизоми в митохондриите и рекрутирани възпалителни клетки 57 - 59 .
Първоначално се смяташе, че чернодробното желязо е определящ фактор за развитието на NASH. Неотдавнашни проучвания обаче съобщават, че натоварването с желязо и мутациите на HFE не допринасят значително за чернодробната фиброза при повечето пациенти с NAFLD 69 .
Друг потенциален фактор за чернодробната стеатоза и възпаление е свръхрастежът на бактерии. Предполага се, че бактериалният свръхрастеж увеличава ендогенното производство на токсини като етанол или бактериален липополизахарид, които насърчават производството на реактивни кислородни видове от хепатоцитите и чернодробните макрофаги. Този предложен механизъм се подкрепя от проучвания от проучвания върху животни, но остава непроверен при пациенти 70, 71 .
Фактът, че разпространението на NAFLD варира сред различните расови групи, честото наблюдение на значителни вариации в тежестта на чернодробното заболяване сред индивиди с NAFLD и подобни рискови фактори и наблюдението, че няколко много редки човешки моногенни нарушения са свързани с развитието на мастен черен дроб заболяване предполагат, че генетичните фактори влияят върху развитието на NAFLD. Понастоящем само няколко малки проучвания изследват потенциални гени, които са свързани с патогенетичните механизми на NAFLD. Данните показват, че множество промени в генната експресия характеризират простата стеатоза. Всички тези проучвания са интересни и провокативни, но ще изискват допълнително валидиране при по-големи популации, преди истинското им значение да стане известно 91 .
Симптоми, лабораторни отклонения, диагноза
Повечето пациенти с NAFLD са асимптоматични. Болестта се открива случайно по време на рутинно лабораторно изследване при субекти, лекувани с хиполипидемични лекарства и по време на сонографско изследване за съмнение за жлъчнокаменна болест. Когато са налице, клиничните симптоми са неспецифични и ненадеждни за оценка на тежестта на заболяването. Най-честите признаци и симптоми са умора и дискомфорт в десния горен квадрант. По време на физически преглед няма патогномични признаци и най-честите отклонения са затлъстяването и хепатомегалията, които са докладвани при до 50% от пациентите. По-малка част от пациентите изпитват симптоми, показателни за по-сериозно чернодробно заболяване като асцит, жълтеница и чернодробна енцефалопатия 58, 92 - 94 .
КТ изображенията може точно да открие и количествено определи количеството на стеатозата при пациентите. При стеатоза> 30% чувствителността и специфичността са съответно 82% до 93% и 100%. CT сканирането обаче не може да разграничи простата стеатоза от стеатохепатита. Няма разлика в диагностичната стойност между неконтрастно КТ сканиране и контрастно усилено 108, 110, 111 .
Ядрено-магнитен резонанс (ЯМР) е най-точната налична техника за диагностика и количествено определяне на чернодробната стеатоза. Тя се основава на разликите в сигнала между мазнини и вода. ЯМР показва добра корелация с хистологичното изследване и чувствителността и специфичността са съответно 100% и 92,3% 111, 112. Ограниченията на метода включват разходи, невъзможност за употреба при пациенти с имплантируеми устройства или клаустрофобия и променени стойности при пациенти с претоварване с желязо 93 .
Магнитно-резонансната спектроскопия (MRS) е алтернативен, неинвазивен метод за измерване на съдържанието на чернодробни триглицериди (HTGC), но е използван само в малки научни изследвания. Принципът на MRS се основава на разликите в резонансните честоти на протоните. Szczepaniak et al съобщават, че MRS е достатъчно чувствителен, за да открие малки количества триглицериди и не се влияе от приема на храна. Друго предимство пред останалите често използвани образни методи е, че това е количествен, а не качествен или полуколичествен метод. Точността и безопасността на MRS го правят идеална методология за оценка и мониторинг на чернодробната стеатоза 113 .
Преходната еластография (ТЕ) е наскоро разработен, неинвазивен метод, предназначен за прогнозиране на чернодробна фиброза, базиран на механична вълна, генерирана от вибрации. Измерването на скоростта на вълната през чернодробния паренхим дава оценка на еластичността на черния дроб, което от своя страна е маркер на чернодробната фиброза. Той може точно да диагностицира напреднала чернодробна фиброза, но ефективността му при ранна чернодробна фиброза е по-малко задоволителна. Неговата възпроизводимост е значително намалена при пациенти със стеатоза и повишен ИТМ. Чернодробната фиброза също има тенденция да се надценява от TE, когато нивата на ALT са повишени 114, 115 .
Чернодробната апоптоза играе важна роля в прогресията на NAFLD и биомаркерите на чернодробната апоптоза са изследвани като потенциално диагностично средство. Генерираният от каспаза цитокератин-18 (CK-18) е протеин, участващ в апоптозата и е установено, че е по-висок при пациенти с NASH. Wieckoska и сътр. съобщава, че плазмените CK-18 фрагменти са поразително увеличени при пациенти с NAFLD в сравнение с контролите и плазмените нива корелират с нивата на експресия в черния дроб. Тези открития предполагат, че CK-18 е независим предиктор на NASH и може да се превърне в полезен и надежден инструмент за определяне на тежестта на хистологичното заболяване при пациенти с NAFLD. В ход е голямо многоцентрово проспективно валидиращо проучване 93, 94, 121 .
Метаболитен синдром и безалкохолен мастен черен дроб
В проспективно обсервационно проучване на 4401 очевидно здрави индивиди Hamagushi et al установява, че МС е силен рисков фактор за безалкохолна мастна чернодробна болест. Участниците с МС имат 4 до 11 пъти по-висок риск от бъдещи безалкохолни мастни чернодробни заболявания. В допълнение, ако съществува алкохолна мастна чернодробна болест и МС, регресията на заболяването е по-малко вероятно 105. Освен това Hsiao et al демонстрират, че наличието на тежка мастна чернодробна корелация значително корелира с разпространението и степента на хипертония, абнормен метаболизъм на глюкоза и триглицериди 137 .
Заключение
Безалкохолният мастен черен дроб е обект на значителен научен и клиничен интерес, който ще се увеличава през следващите години. Епидемиологичните проучвания показват, че NAFLD и MS се очертават като основни проблеми на общественото здраве. Целите на бъдещите изследвания са да се изясни патогенезата и да се установи ефективно лечение както при NAFLD, така и при MS. В ход са няколко проучвания и няколко от тях дадоха обнадеждаващи резултати.
- Метаболитен синдром и безалкохолна мастна чернодробна болест Анали на хепатологията
- Продължителното хранене с високо съдържание на мазнини насърчава безалкохолната мастна чернодробна болест и променя червата
- Метаболитен синдром; модерен вариант на свързана със стреса болест; Revista Española de Cardiología
- Ролята на храненето в патогенезата и профилактиката на безалкохолни мастни чернодробни заболявания
- Роля на диетата и промените в начина на живот при неалкохолна мастна чернодробна болест