Субекти
Резюме
Глюкагоноподобни пептид-1 (GLP-1) рецепторни агонисти (GLP-1R) се появиха като възможности за лечение на захарен диабет тип 2 (T2DM). GLP-1R сигнализира чрез G-протеинозависими и G-протеинонезависими пътища чрез ангажиране на белтъчния β-арестин протеин на скелето; преференциалното сигнализиране на лиганди през единия или другия от тези клонове е известно като „пристрастие на лиганда“. Тук съобщаваме за откриването на мощния и селективен GLP-1R G-протеин, пристрастен агонист, P5. Идентифицирахме P5 в високопроизводителен автокринен скрининг на големи комбинаторни пептидни библиотеки и показваме, че P5 насърчава сигнализирането на G-протеин, сравним с GLP-1 и Exendin-4, но показва значително намален отговор на β-арестин. Предклиничните проучвания, използващи различни модели мишки на T2DM, показват, че P5 е слаб инсулинов секретагог. Независимо от това, хроничното лечение на мишки с диабет с P5 повишава адипогенезата, намалява възпалението на мастната тъкан, както и чернодробната стеатоза и е по-ефективно за коригиране на хипергликемия и понижаване на нивата на хемоглобин А1с от Exendin-4, което предполага, че GLP-1R G-протеинови агонисти могат да осигуряват нов терапевтичен подход към T2DM.
Въведение
Захарният диабет тип 2 (T2DM) е сложно метаболитно разстройство, характеризиращо се с хипергликемия, произтичаща от комбинация от недостатъчна секреция на инсулин заедно с развитието на инсулинова резистентност. Инкретинът, подобен на глюкагон пептид-1 (GLP-1), е ендогенен пептиден хормон, секретиран от чревни ендокринни клетки в отговор на приема на храна 1. GLP-1 намалява изтичането на глюкоза след хранене чрез усилване на стимулирана от глюкоза секреция на инсулин от β-клетки на панкреаса и наскоро е доказано, че насърчава оцеляването на β-клетките при гризачи 2. В допълнение, GLP-1 упражнява екстра-панкреатични действия като насърчаване на изпразването на стомаха, загуба на тегло и повишаване на инсулиновата чувствителност в периферните тъкани Следователно, базирани на инкретин терапии представляват стратегия за лечение на T2DM.
GLP-1 упражнява своето действие чрез GLP-1 рецептора (GLP-1R) 4, експресиран в панкреаса, други периферни тъкани и централната нервна система. Активирането на GLP-1R задейства свързването на Gαs-протеин, което води до повишаване на цикличния AMP (cAMP), модулира вътреклетъчната концентрация на калций 5 и индуцира набиране на β-арестин 6,7. В исторически план се смята, че β-арестините играят изключителна роля в десенсибилизацията на G-протеин, свързан с рецептор (GPCR) 8. Оттогава обаче е показано, че β-арестините могат да функционират и за активиране на сигнални каскади 9,10. В тази връзка, в панкреатичната β-клетка, повишаването както на cAMP, така и на цитозолния Ca 2+ и β-арестин, сигнализиращи след активирането на GLP-1R, са критични събития за насърчаване на глюкозозависимата секреция на инсулин.
Наскоро се появи концепцията за „функционална селективност“ или „пристрастие на лиганда“, при което свързването на лиганда насърчава ангажирането само на определена подгрупа от пълния GPCR сигнален репертоар, като изключва останалите 11. По-доброто разбиране на GLP-1R плейотропното сигнализиране и основните физиологични последици може да осигури нови пътища за разработване на лекарства с нови начини на действие, които имат потенциала да осигурят по-голяма терапевтична стойност, като същевременно се избегнат нежелани странични ефекти 12,13. Поради това разработихме автокринна система, за да скринираме големи и разнообразни, комбинаторни пептидни библиотеки, съдържащи до 100 милиона различни членове, с цел идентифициране на мощни, селективни, G-протеинови GLP-1R агонисти. Идентифицирахме един такъв лиганд, означен като P5, и сме го характеризирали инвитро фармакологичен фенотип и изследва терапевтичния му потенциал.
Резултати
Базиран на автокрин избор на нов GLP-1R агонист
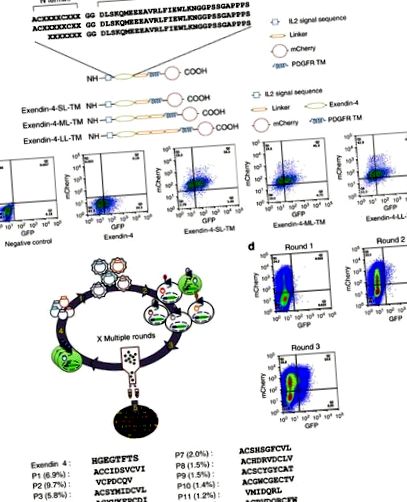
За да идентифицираме потенциални G-протеинови лиганди за GLP-1R, ние експресирахме пептидна библиотека на клетъчната повърхност на репортерска клетъчна линия, ко-експресираща GLP-1R и репортерния ген на зеления флуоресцентен протеин (GFP) под контрола на CRE промотор (HEK293-GLP-1R-GFP) за скрининг за пептиди, които индуцират GLP-1R-медиирано производство на сАМР. Тази автокринна система, свързана с активирано от флуоресценция сортиране на клетки (FACS), има способността да проверява до 20 милиона събития на час. Exendin-4 (Ex4) е 39 аминокиселинен пептиден агонист на GLP-1 рецептора. С-крайните области на Ex4 взаимодействат с N крайния извънклетъчен домен на GLP-1R, улеснявайки взаимодействието на Ex4 N края с трансмембранния домен на рецептора, което води до активиране на рецептора 3. За разлика от това, пептидът Exendin 9–39 (Ex 9–39; Ex4 без 8-те първи аминокиселини) се държи като състезателен антагонист 14. Въз основа на тези прозрения за структурата-активност на Exendin бяха генерирани три комбинаторни пептидни библиотеки, състоящи се от произволни 7-10 аминокиселини, слети до N-края на Ex 9–39.
Тъй като няколко GPCR естествени лиганди са циклични пептиди като калцитонин, окситоцин и соматостатин 15, са проектирани две библиотеки, кодиращи цикличен пептид N окончания (или рандомизиран тетрапептид (CX4C), или пентапептид (CX5C)) (фиг. 1а). Третата библиотека се състои от седем произволни аминокиселини, слети към N-края на Ex 9–39 (фиг. 1а). Всяка библиотека беше вмъкната между разцепваща се сигнална последователност на интерлевкин 2, използвана за насърчаване на локализирането на клетъчната повърхност, и линкер, последван от трансмембранния домейн, получен от тромбоцитния рецептор на растежен фактор (PDGFR), за да закрепи библиотеката на клетъчната повърхност (фиг. 1а). В допълнение, флуоресцентният протеин mCherry беше слят към края на С на последователността PDGFR, за да се даде възможност за проследяване на ефективността на трансдукция.
(а) Схематично представяне на пептидните библиотеки. (б) Схематично представяне на привързания с мембрана Exendin-4 (отгоре) и FACS анализ на експресията на mCherry и GFP 2 дни след трансдукция на клетки HEK293-GLP-1R-GFP с привързан с мембрана Exendin-4, показващ различен размер на свързващия елемент (отдолу) . (° С) Схематично представяне на автокринната селекция на комбинаторна пептидна библиотека. Лентивирусните пептидни библиотеки се приготвят от лентивирусни плазмиди (стъпка 1). Реакционната клетъчна линия GLP-1R, отговаряща на CRE, се трансдуцира с лентивирусна библиотека (стъпка 2). GFP експресиращите клетки се сортират (стъпка 3) и гените, кодиращи пептиди, се амплифицират от геномна ДНК на сортираните клетки, за да се направи библиотеката за следващия кръг на селекция (стъпка 4). След итеративни кръгове на селекция, обогатените пептидни последователности се анализират чрез дълбоко секвениране (стъпка 5). (д) Обогатяване на GFP положителни клетки по време на три кръга на FACS селекция. (д) N крайни последователности на топ 13 пептиди (честота> 1,0% представяне).
След това изследвахме способността на P5 да насърчава GLP-1R-медиираната вътреклетъчна мобилизация на Ca 2+. P5 индуцира зависещо от концентрацията увеличение на [Ca 2+]i и показва подобна сила и ефикасност в сравнение с референтния лиганд Ex4 и (Фиг. 2в; Таблица 1). В сравнение с GLP1, P5 е 3 пъти по-мощен (Таблица 1). Общоприето е, че GLP-1R-медиираното увеличение на [Ca 2+]i в β-клетките се дължи на GLP-1R активиране на Gαs пътя, индуцирайки cAMP- и PLC/Ca 2+ -зависими отговори, а не чрез предаване на сигнал Gαq/11. Независимо от това, индуцираното от P5 увеличение на [Ca 2+]i в клетки, експресиращи CHO-GLP-1R, се инхибира от селективния Gαq инхибитор FR900359 (справки 17, 18; Допълнителна фигура 1г), потвърждавайки, че GLP-1R може функционално да се сдвоява с Gαq.
Предишни доклади демонстрират, че GLP-1R също директно се свързва с β-арестин 1 и -2 след активиране с Ex4 (справки 6, 7). Следователно ние изследвахме способността на P5 да индуцира набиране на β-арестин 1 и -2, използвайки клетъчен анализ, който наблюдава прякото взаимодействие между β-арестин и рецептора. P5 показа силно намалена ефикасност и потентност (Е.макс = 29 и 32%; EC50 = 447 и 529 nM, съответно за β-арестин 1 и -2 набиране), в сравнение с референтния агонист Ex4 (EC50 = 29,57 и 5,6 nM за β-арестин 1 и 2 набиране; Фиг. 2d, д) и към ендогенния пептид GLP-1 (Е.max = 71 и 77%; EC50 = 280 и 60 nM за β-арестин 1 и -2 набиране, съответно).
Освен това определихме количествено относителното пристрастие на P5, използвайки сравнение с „еквиактивност“ и Ex4 като референтен лиганд. Ендогенният лиганд GLP-1 не демонстрира откриваемо отклонение, докато P5 дава фактори на пристрастие (β), от 0,9 и 1,4 за Gαs-протеин над β-арестин 1 и -2, съответно, и от 1,7 и 2,4 за Gαq-протеин над β-арестин 1 и -2, съответно (фиг. 2е; Допълнителна таблица 1), като по този начин потвърждава, че P5 има предпочитание за насърчаване на GLP-1R-медиирано активиране на G-протеин пред β-арестин набиране (наричано G-протеин пристрастие).
P5 е слаб инсулинов секретагог и подобрява глюкозния толеранс
P5 е по-ефективен при контролиране на хроничната хипергликемия
За да се определи дали хроничното лечение с GLP-1R агонист, пристрастен към G-протеин, може да подобри хипергликемията, ob/ob мишките са били третирани ежедневно с 10 μg kg -1 от P5 или Ex4 в продължение на 3 седмици. И двата пептида значително намаляват приема на храна (фиг. 4а) и телесното тегло (фиг. 4б) по време на началната фаза на лечението. Независимо от това, към 21-ия ден от лечението, за разлика от Ex4, P5 не повлиява значително телесното тегло или мастната маса в сравнение с третираното с носител ob/ob мишки (фиг. 4б, в). Лечението с P5 обаче значително намалява ad libitum-хранени нива на глюкоза в кръвта (фиг. 4г), без да се засягат нивата на инсулин (фиг. 4д), докато лечението с Ex4 няма ефект върху гликемията (фиг. 4г). Важното е, че разликите в Ex4 и P5 in vivo ефикасността не се дължи на разликите във фармакокинетиката на пептидите, тъй като и двата пептида показват сходен полуживот в миши серум (допълнителна фигура 3). Тези данни показват, че P5 има по-добра антихипергликемична ефикасност при диабетици ob/ob мишки.
Хроничното лечение с P5 и Ex4 значително намалява ектопичното отлагане на липиди в черния дроб, както е показано чрез намаляване на броя на липидните капчици (фиг. 6а, б), намалени нива на триглицериди (фиг. 6в) и чернодробно тегло (фиг. 6г). G-протеиновият агонист се представя еднакво добре за намаляване на циркулиращите нива на липопротеини с ниска плътност, без да се засягат нивата на липопротеини с висока плътност или триглицериди в сравнение с подобно дозиране на Ex4 (допълнителна таблица 2). Важно е, че хроничното лечение с Р5 не предизвиква хепатоцелуларна токсичност, което се отразява от липсата на промени в плазмените нива на аланин аминотрансфераза, алкална фосфатаза и аспартат аминотрансфераза (фиг. 6д). Като цяло тези данни предполагат, че хроничното лечение с агонистичен пептид, пристрастен към GP-1R G-протеин, поддържа масата на eWAT чрез увеличаване на адипогенезата и предотвратява ектопично отлагане на мазнини в черния дроб, предизвикано от диета с високо съдържание на мазнини.
Дискусия
GPCR пептидните лиганди винаги са били забелязвани за тяхната селективност, сила и бърза оптимизация, но обикновено пептидите се синтезират химически, което е процес с ниска производителност, който по същество няма разнообразие. Въпреки че базирани на афинитет скринингови технологии като фаг и дисплей на дрожди позволяват високопроизводителен скрининг на големи комбинаторни пептидни библиотеки, те разчитат на използването на рекомбинантни протеинови или мембранни препарати и не правят разлика между агонисти, инверсни агонисти и антагонисти. За да се справим с това, ние разработихме функционална автокринна система на базата на клетки за подбор на лиганди от големи вътреклетъчни комбинаторни пептидни библиотеки. Тази функционална клетъчна система може да позволи скрининг на 100 милиона пептиди при 2 милиона събития на час. В експериментите за доказателство за концепция, представени тук, ние генерирахме и скринирахме три отделни пептидни библиотеки и показваме как тази методология позволява на човек да открива и идентифицира нови GLP-1R лиганди с уникална фармакология. Освен това, тази автокринна система за подбор е мощен подход, който може да се използва за деорфанизиране на осиротели GPCR и да се прилага към други рецептори на клетъчната повърхност.
В остра обстановка този агонист, пристрастен към G-протеин, значително подобрява гликемичния контрол при метаболитно здрави животни, както и при миши модели на T2DM. При метаболитно здрави мишки Р5 подобрява толерантността към кръвната глюкоза в същата степен като 100 пъти по-висока доза Ex4. Тези наблюдения заедно с фармакокинетичното проучване предполагат, че разликата в ефективността на P5 е присъща на пептида. При този редукционистки подход P5 значително повишава нивото на инсулин в сравнение с контрола. Активността на секретагога Р5 обаче е значително намалена спрямо референтния пептид Ex4. Тези резултати предполагат това in vivo, β-арестин 1/2 сигнализиране след активирането на GLP-1R играе критична роля за усилване на стимулираната от глюкоза секреция на инсулин. Тези данни са в съответствие с предишни доклади, показващи, че β-арестин 1/2 са необходими за потенциращото действие на GLP-1 върху стимулираната от глюкоза секреция на инсулин в култивирани панкреатични β клетки 6,7 .
В обобщение, високопроизводителният автокринен функционален скрининг на комбинаторни пептидни библиотеки позволи откриването на високоефективен G-протеинов пристрастен GLP-1R агонист, демонстриращ нови фармакологични добродетели. В поредица от транслационни предклинични проучвания ние демонстрираме, че P5 е слаб инсулинов секретагог, но показва превъзходен антидиабетен ефект (Фиг. 7). По този начин GLP-1R G-протеиновите лиганди могат да предложат нови и неоценени предимства в контекста на хронично лечение, като насърчаване на адипоцитна хиперплазия, възстановяване на инсулиновата реакция и дългосрочен гликемичен контрол, като същевременно се запазва функцията на панкреас β-клетки чрез минимизиране на секреторния инсулин тежест.
Използвайки автокринна система, свързана с FACS, ние проверихме големи, разнообразни, комбинаторни пептидни библиотеки и идентифицирахме P5, мощен и селективен агонист на GLP-1R, пристрастен към G-протеин. P5 показва намален инсулинотропен ефект, но съществено подобрен глюкозен толеранс и инсулинова реакция чрез насърчаване на хиперплазия на бяла адипоцитна тъкан.
- Усещате ли ефектите от твърде много сол
- 6 Вредни ефекти от излишната сол в ежедневната ви диета - NDTV храна
- Употреба на касис, странични ефекти, взаимодействия, дозировка и предупреждение
- Ползи от маслото от черни семена, странични ефекти, дозировка и взаимодействия
- 6 естествени начина за избягване и намаляване на антибиотичните странични ефекти от жизненоважно значение