Джоузеф Канер
отдел по наука за храните, ARO Volcani Center, Bet-Dagan, Израел
b Институт по биохимия, хранителни науки и хранене, Факултет по земеделие Храна и околна среда, Еврейският университет в Йерусалим, Реховот, Израел
Джейкъб Селхуб
c Витаминен метаболизъм и стареене, Jean Mayer USDA от Университета Туфтс, Бостън, Масачузетс, САЩ
Ади Шпайзер
b Институт по биохимия, хранителни науки и хранене, Факултет по земеделие Храна и околна среда, Еврейският университет в Йерусалим, Реховот, Израел
Борис Рабкин
отдел по наука за храните, ARO Volcani Center, Bet-Dagan, Израел
Inbal Shacham
отдел по хранителни науки, ARO Volcani Center, Bet-Dagan, Израел
Орен Тирош
b Институт по биохимия, хранителни науки и хранене, Факултет по земеделие Храна и околна среда, Еврейският университет в Йерусалим, Реховот, Израел
Резюме
Графичен резюме
1. Въведение
Постпрандиалният оксидативен стрес (POS) се характеризира с увеличаване на податливостта на организма към окислително увреждане след консумация на храна, богата на липиди. POS, засегнати от диета с високо съдържание на мазнини, обикновено се придружава от преходна ендотелна дисфункция, възпаление и клетъчен оксидативен стрес, които са установени като важен рисков фактор за ССЗ [1], [2], [3]. Няколко епидемиологични проучвания, както и експериментални данни показват, че популацията на диети, характеризиращи се със западен модел, с висок прием на мазнини с червено месо, преработено месо, пържени храни, рафинирани зърнени храни, но с ниско съдържание на плодове и зеленчуци, са изложени на висок риск за развитие на сърдечно-съдови заболявания (ССЗ), диабет, рак на дебелото черво и други дегенеративни заболявания [4], [5], [6], [7], [8].
Модифицираните LDL или MDA-LDL са признати като ключови фактори за иницииране и ускоряване на атеросклерозата [16], като маркери за тежестта на коронарните артериални заболявания [17] и други сърдечно-съдови заболявания [18], [19]. За да се оцени способността на стомашния биореактор, за по-нататъшно пероксидиране на липидите в храната, ние разработихме рандомизирано кръстосано проучване при хора, чрез което на доброволци беше дадено ястие от пуешко червено месо и бяха определени нивата на MDA в плазмата и урината. След хранене с котлети от месо, плазмените нива на MDA се повишават и причиняват постпрандиална модификация на LDL до MDA-LDL. Установено е, че модификацията на LDL чрез MDA зависи пряко от повишаването на нивото на MDA в плазмата след хранене [8], [20], [21]. Абсорбция на реактивни карбонили от консумирано хранене, което съдържа AGEs, също е установено при хора [9], [22]. Въпреки това, повечето от AGEs на избрани популярни храни са получени от тези, съдържащи месо и високо съдържание на мазнини [9].
Анализът на симулирана стомашна течност (SGF) е утвърден метод, който имитира състоянията в стомаха [8], [19], [20] за определяне степента на липидна пероксидация на различни меса въз основа на освобождаването на MDA. За да потвърдим тази система, проведохме проучвания, които сравниха липидното окисление при тези условия с появата на MDA в човешката кръв след консумация на същото месо. Резултатите показват много висока корелация (R 2 = 0,913) между концентрациите на MDA, генерирани при стомашни условия на SGF, и MDA в кръвта при човешки доброволци за различни комбинации от храни [21], [33], [34].
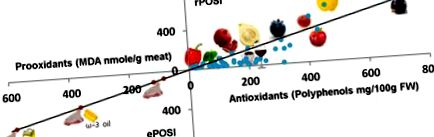
Целта на това проучване е да се определи намаляващата способност на различни храни (плодове, зеленчуци, напитки и подправки) да инхибират липидната пероксидация в стомашната среда от много активни прооксидантни храни (месо от червена пуйка) и да се изчисли постпрандиалното Индекс на оксидативен стрес (POSI), който може да помогне за оценяване на диетите за подобряване на човешкото здраве.
2. Материал и методи
2.1. Химикали
Прясно месо (пуйка, пилешко и говеждо месо), замразена риба (риба тон, сьомга, камбала и тилапия), рафиниран зехтин (ROO), съдържащ 16 mg/L полифеноли, (BORGES, Испания), ω – 3 добавка рибено масло „Alsepa MAX ”(Ocean-Nutrition, Канада) са получени от местни магазини. Метмиоглобин (metMb, от скелетна мускулатура на кон), ß-каротин, Tween 20, бутилиран хидрокситолуен (BHT), катехин, пепсин (A, от свински стомашни лигавици), железен амониев сулфат, ксиленол оранжев и трифенилфосфин (TPP) са получени от Sigma Chemical Co. (Сейнт Луис, Мисури, САЩ). Натриев хлорид, водороден прекис (30%) и 1-аскорбинова киселина (АА) са получени от Merck (Дармщат, Германия). Железен хлорид (Fe) е получен от Riedel-de-Haen (Хановер, Германия). Натриевият борохидрид е от BDH (Poole, Dorset, Англия). Всички разтворители бяха с HPLC клас (J. T. Baker, Phillipsburg, NJ, USA). Соево масло, червено вино (израелско каберне совиньон) и пуешко месо на скара (шаурма) са закупени в търговските магазини в Израел. Симулираната стомашна течност (SGF) е прясно приготвена в съответствие с Американската фармакопея (United States Pharmacopeia Inc. Rockville, MD, 2000). SGF съдържа NaCl (200 mg), пепсин (320 mg) и HCl (700 µL от 36%) до DDW (100 ml) [35].
2.2. Определяне на малондиалдехид в месото след инкубация в симулирана стомашна течност (SGF)
Пуешкото червено месо, под формата на малки филийки, се загрява в продължение на 1 минута в микровълнова фурна, охлажда се, разделя се на порции и се поддържа при -80 ° C в очакване на използването му [32]. Това замразено месо (10 g) се смила с 30 ml SGF за 60 s в лабораторен смесител (Waring, New Hartford, CT) и се коригира до рН 3.0. Сместа месо-течност (хомогенат), при всяка обработка, се разделя на няколко епруветки и се инкубира в разклащаща баня при 37 ° С в продължение на 180 минути. В четири времеви точки (0, 30, 90 180 минути), липидната пероксидация се определя като MDA чрез метода TBA, описан от Kanner et al. [32], както следва: всяка проба се смесва незабавно с 15% TCA при съотношение 1: 1 и се центрофугира за 10 минути при 20 800 g. След това супернатантата се третира с TBA (2.8 mg/ml) при 1: 1 (v/v). Пробите се нагряват в кипяща водна баня в продължение на 20 минути и се отчитат при 532 nm (Synergy HT, BIO-TEK). Концентрацията на MDA е изчислена според 1 µmol/L = 0.156 абсорбция [36].
2.3. Определяне на липидни хидропероксиди
Липидните пероксиди се определят съгласно FOX-2 анализ [33]. Червеното месо се третира, както е описано за малондиалдехид. След инкубация при 37 ° С, 1 ml от хомогената се смесва с 9 ml метанол, съдържащ BHT (4.4 mM) за екстракция с пероксид и след това се центрофугира при 14 500 g за 3,5 минути. Супернатантата (100 uL) се добавя (трикратно) към епруветки, съдържащи 10 uL метанол (или метанол + TPP) и се инкубира при 25 ° С за 30 минути. След инкубация се добавя FOX-2 реагент (890 uL), който съдържа BHT (4.4 mM) и се инкубира за допълнителни 30 минути. Пробите се измерват с спектрофотометър при 560 nm. Липидните хидропероксиди са изчислени, като се вземе предвид намаляването на резултатите само от метанол от проби метанол + ТЕЦ. Извършва се стандартна крива, като се използва водород-пероксид с чист висок клас. Определянето на H2O2 в масла се извършва с реагент FOX-2 с и без каталаза за определяне на присъствието на H2O2. (1000 µM хидропероксиди са същите като 1 mmol еквивалентни пероксиди/kg масло).
2.4. Окисляване на ß-каротин в хомогенат на месо
Пуешкото червено месо в SGF след хомогенизиране се смесва с ß-каротин при крайна концентрация 15 µM. Приготвянето на основен разтвор на ß-каротин във вода е както е публикувано по-рано. Накратко, ß-каротин (25 mg) и Tween 20 (0,9 ml) бяха разтворени в хлороформ (25 ml) [37]. Разтворът (1 ml) се изпарява до сухо и се разтваря с Н20 (10 ml) до основен разтвор. Реакционните епруветки се инкубират на два пъти в разклащаща баня при 37 ° С в продължение на 90 минути. Реакцията се спира чрез смесване с един обем хексан и един обем етанол и сместа се оставя за още 5 минути за фазово разделяне. Ss-каротинът се екстрахира с горната фаза на хексана и се определя чрез спектрален анализ при 460 nm. Коефициентът на екстинкция на ß-каротин в хексан при 460 nm (за 1%, A = 2550) е използван за изчисляване на концентрацията на каротеноиди [37].
2.5. Определяне на полифеноли в храни и напитки
Съдържанието на полифеноли в храните се определя с реагента Folin-Ciocalteau и се изчислява като еквивалент на катехин след корекция за съдържанието на аскорбат във всяка храна. Последното се определя чрез HPLC (виж по-долу). Представените резултати са средствата на три повторения, а на фигурите всяка посочена грешка означава стандартното отклонение. Аскорбиновата киселина като ефективно редуциращо средство взаимодейства с реагента Фолин-Чиокалто и влияе с това на резултатите от хранителните полифеноли. Аскорбиновата киселина се използва за генериране на стандартно калибриране с реагента Folin-Ciocalteau. Количеството аскорбинова киселина, определено по HPLC метод, се нормализира с тези от реагента на Фолин-Чиокалто и се намалява спрямо резултатите, приети за полифеноли, за по-добра оценка на общото количество полифеноли в храните [37].
2.6. Измерване на витамин С
Хомогенатните проби се смесват с TCA (11.3%), (1: 1 v/v) и се центрофугират в продължение на 3 минути при 20 800 g. Супернатантата се филтрува през 0.2 µm мембрана и 20 µL аликвотна част се инжектира в HPLC (Merck-Hitachi L-6200A) и се отделя с колона Merck Lichrocart RP-18, 125-4, елуирана с изократична подвижна фаза на KH2PO4 (10 mM): MeOH (97: 3 v/v) и тетрабутиламониев хидроксид 0,75 mM, при скорост на потока 1 ml/min и детектиран с диоден детектор (Shimatzu, Kyoto) при 268 nm. Аскорбиновата киселина (Merck) е използвана за генериране на стандартна крива на калибриране [37].
2.7. Подготовка на растителни материали за индекса POS
Пресният растителен материал се нарязва на малки филийки
1 cm 3 и веднага се бланшира чрез нагряване в продължение на 1 min в микровълнова фурна (Dow, S-Korea, при 800 W), охлажда се и се държи във вакуумен пакет при -80 ° C, докато се използва. Растителният материал се смила и хомогенизира за 60 s със симулирана стомашна течност (в съотношение 1/1 w/v), регулирана до рН 3, в лабораторен смесител (Warring, New Hartford, CT). Бланширането се извършва за инактивиране на ензими, по-специално полифенол-оксидаза, аскорбат оксидаза и като цяло пероксидази, които могат да окисляват полифеноли, аскорбинова киселина и други редуциращи агенти. Напитките се приготвят с гореща вода, както е описано по-горе [33], [38].
2.8. Статистически анализ
Резултатите (означава ± SD) се изразяват като процент или тегло или моларна база. Статистическата значимост се определя с помощта на еднопосочен дисперсионен анализ, следвайки процедура за класиране, използвайки тест на Student-Newman-Keuls (софтуер на SAS, SAS Institute Inc., Cary, NC). Резултатите са средството за трикратно повторение и на фигурите всяка лента за грешка (I) обозначава стандартните отклонения.
3. Резултати
3.1. Основата на подобреното изчисление на индекс на оксидативен стрес след хранене (ePOSI)
Липидната пероксидация на червено пуешко месо (200 g) в SGF се определя чрез разширяване на TBA-RS и се изразява като натрупване на MDA (nmole/g месо) при 37 ° C, 180 минути. Тези количества MDA (120 ± 6,1 nmole/g месо), генерирани от 200 g месо в 1000 ml SGF или в еквивалентна по-малка моделна система, бяха изчислени като ePOSI = 100. Месото от червена пуйка, най-високият усилвател на липидната пероксидация в стомашната среда между сухоземните животни [36], беше избрано за референт на месото за изчисляване на инхибиторния ефект на различни растителни хомогенати. Установено е, че пуешкото червено месо в SGF и в присъствието на зехтин (25 ml) или ω-3 масло (25 ml) има ePOSI
300, съответно. POSI може да бъде повлиян от много храни, но особено от мускулни храни (Таблица 1).
маса 1
Подобрители на мускулната храна на POSI (ePOSI).
| Турция - Бедро | 120 ± 11,2 | 100 |
| Пуешки гърди | 29 ± 0,5 | 24 |
| Пилешко бутче | 40 ± 0,4 | 34 |
| Пилешки гърди | 20 ± 0,2 | 17 |
| Говеждо месо - плешка (pH 4,6) | 65 ± 0,6 | 54 |
| Свински бут | 45 ± 0,4 | 38 |
| Риба тон | 152 ± 7,5 | 126 |
| Сьомга | 122 ± 3.3 | 102 |
| Камбала | 25 ± 0,5 | 21. |
| Тилапия | 7 ± 0,0 | 6 |
| Пуйка + зехтин | 86 ± 2.4 | 72 |
| Турция + ω-3 | 367 ± 6,3 | 306 |
| Турция + масло от риба тон | 583 ± 3,0 | 486 |
| Говеждо месо + ω-3 (pH 4,6) | 139 ± 3,5 | 116 |
3.2. Основата на изчислението на намаления индекс на оксидативен стрес след хранене (rPOSI)
Намаленият индекс на оксидативен стрес след хранене (rPOSI) се определя като капацитет на растителна храна в грамове, за да инхибира напълно (100%) образуването на MDA от 200 g пуешко месо, инкубирано в SGF за 180 минути при 37 ° C. Липидната пероксидация в SGF се определя от степента на образуване на MDA, измерена като TBA-RS адукционен продукт или окислен ß-каротин. Фиг. 1 показва липидно пероксидиране на червено месо, определено чрез двата метода чрез червени боровинки. IC50 за боровинки за инхибиране на липидната пероксидация на 100 g месо беше
2,7 g и 10,8 g за 100% инхибиране (IC100). Тъй като обаче повечето индивиди консумират 200 g месо на хранене, rPOSI се изчислява на тези основи. За 200 g месо IC100 е 21,8 g = rPOSI 100. Количеството в g от всеки растителен хомогенат за IC100/200 g = rPOSI 100. За да оценим разликите между растението rPOSI, изчислихме индекса на база 100 g на растението . Чрез използването на този метод на изчисление rPOSI на 100 g боровинки е (100 g/21,6 g) × 100 = 462. Чрез използване на същите процедури rPOSI на различни храни са представени в таблица 2, таблица 3, таблица 4, таблица 5, таблица 6 .
Крива на реакция на дозата при липидно пероксидиране на червено месо от Турция, инхибирано от червени боровинки (IC50/100 g), определено чрез методите на окисление на ß-каротин и натрупване на MDA, в SGF, pH 3.0, 37 ° C, t = 180 min.
- Хранителен статус при болестта на Уилсън и неговият ефект върху оксидативния стрес Baranovsky Experimental
- Затлъстяването и разпределението на телесните мазнини предизвикват ендотелна дисфункция чрез диабет с оксидативен стрес
- Подуване на стомаха Седем храни, които трябва да избягвате, ако искате по-плоско коремче
- Индекс на ситост кои храни са най-задоволителни Добре настроени от BCBST
- Класиране на ежедневните храни по калорийна плътност от Evidenced Fitness Evidenced Fitness Medium