Резюме
Въведение
D iet има определено въздействие върху здравето и се смята, че оказва значително влияние върху риска от развитие на някои заболявания, особено рак и сърдечни заболявания. Счита се, че много хранителни фактори, открити в растенията или фитохимикалите, имат мощни антиоксидантни и противоракови действия с ниска токсичност [прегледано в (9–21)]. Флавоноидите са може би най-често срещаната група фитохимични съединения, които се намират в човешката диета поради тяхното повсеместно присъствие и широко разпространение в множество ядливи растения (133). Твърди се, че хранителни фактори като флавоноиди предпазват клетките от преждевременно стареене и заболявания, като предпазват ДНК, протеини и липиди от окислително увреждане въз основа на съдържанието и активността на диетичния фактор. Освен че се изповядват като общо безопасни, те изглежда имат ефективност като противоракови средства, като предотвратяват или обръщат премалигнените лезии и/или намаляват честотата на втори първичен тумор (59).
За съжаление, едно от най-големите предизвикателства за учените-изследователи е да се намали продължаващото натрупване на изкривявания и половин истини, които се съобщават в популярните медии относно ползите за здравето на някои храни или хранителни добавки, включително флавоноиди. Употребата на храна или хранителни добавки не е нова, но интересът към тяхната употреба се е увеличил драстично поради предполагаемите ползи за здравето, които вероятно се придобиват без неприятни странични ефекти (52). Това важи особено за профилактиката и лечението на рака. Флавоноидите се рекламират, за да упражняват противовъзпалително (147), противораково (38) и антиоксидантно (2) действие in vitro. Въпреки това дали флавоноидите могат да предизвикат тези ефекти in vivo е спорен (116, 143, 147). Следователно, идентифицирането на специфичните пътища за трансдукция на сигнала, целите на ген, протеин и транскрипционен фактор и механизми, обясняващи предполагаемата противоракова активност на специфични диетични фактори и по-специално флавоноиди, може да осигури ефективни алтернативи или допълнения към традиционните методи за профилактика на рака (т.е. химиопрофилактика) или лечение на рак (т.е. химиотерапия).
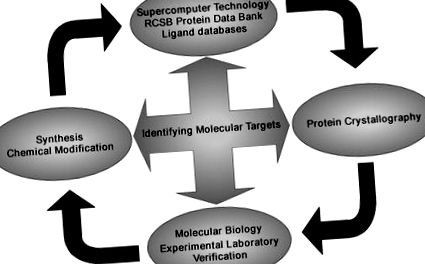
Основна стратегия за идентифициране на специфични молекулни цели на флавоноиди и други фитохимикали. Използваме суперкомпютърна технология за скрининг на RCSB протеинова банка данни и много бази данни за лиганди, комбинирани с протеинова кристалография, за да визуализираме прогнозираните комплекси. Това също се комбинира с молекулярна биология и експериментална проверка на ефективността на съединението при намиране и въздействие върху неговата протеинова цел. Много ефективни съединения могат да бъдат синтезирани и химически модифицирани, за да се получат по-ефективни производни.
Използвайки тази стратегия, ние изучихме противораковите дейности и изяснихме ролята и молекулните цели за различни флавоноиди, открити в ежедневната ни диета. Останалата част от тази статия ще подчертае основните ни констатации по отношение на специфичните молекулярни механизми и белтъчно-свързващи мишени на някои от тези диетични флавоноиди като ефективни противоракови средства. Основният акцент ще бъде върху белтъчните цели, които досега са идентифицирани за тези съединения.
Протеинови цели на флавоноидите
Флавоноидите са много ефективни антиоксиданти in vitro (31, 57). Предполага се обаче, че приносът in vivo е незначителен поради липса на бионаличност и метаболизъм (43, 99, 143). Клетъчните ефекти на флавоноидите могат да бъдат по-скоро свързани с техните ефекти върху трансдукцията на сигнала, отколкото с общите антиоксидантни ефекти (143). Съобщени са различни косвени противоракови ефекти, включително инхибиране на пролиферацията на ракови клетки и индуциране на апоптоза (3, 72, 118, 125), намалено възпаление (25, 113, 126), инхибиране на туморната инвазия и ангиогенеза (3, 76 ) и стимулиране на активността на ензим за детоксикация фаза II (79, 140). Докато флавоноидите са свързани с намален рак при животински модели (4, 23, 27, 41, 42, 48–50, 56, 60, 67–71, 75, 85–90, 93, 95–98, 130, 131, 139, 148, 149), изследванията върху хора са по-малко убедителни (1, 44, 45, 47, 58). Ще са необходими повече клинични изпитвания, за да се определи дали специфични флавоноиди могат да се използват за предотвратяване или лечение на рак.
Основен акцент в голяма част от нашата работа през последното десетилетие беше изясняването на молекулярните и клетъчните механизми и цели, които са от съществено значение за превенцията на рака, и особено за превенцията на рака на кожата. Преобладаващата идея в наши дни е, че ракът може да бъде предотвратен (17) или лекуван чрез използване на малки молекули, като флавоноиди, за насочване към специфични и може би множество ракови гени, сигнални протеини и транскрипционни фактори. Поради голямата си продължителност, фазата на насърчаване на развитието на рак може да бъде фазата, при която диетата може да има най-голямо въздействие. Досегашната ни работа разкри, че много от флавоноидните съединения изглежда са насочени към множество ефектори надолу по веригата на човешкия рецептор на епидермален растежен фактор (HER)/erbB. Неподходящото фосфорилиране и активиране на това семейство рецептори на тирозин киназа е наблюдавано при много видове рак (32) и е свързано с резистентност към традиционните ракови терапии. В допълнение, много от рецепторите за епидермален растежен фактор (EGFR) надолу по протежение на протеиновите ефектори също са необичайно изразени при различни видове рак (141). Активирането на EGFR задейства предимно Ras/Raf/MEK/MAPK пътя, PI3-K/PTEN/Akt/mTOR пътя и сигналния преобразувател и активатор на транскрипция (STAT) сигнална каскада (6, 37, 39, 63, 65) (Фиг. 2).
Обща схема за активиране на EGFR. Активирането на EGFR задейства предимно пътя Ras/Raf/MEK/MAPK, пътя PI3-K/PTEN/Akt/mTOR и сигналната каскада STAT. Веднъж задействан, сигналът се усилва и води до активиране на различни транскрипционни фактори, които причиняват редица клетъчни реакции, като повишена преживяемост, пролиферация, намалена апоптоза и възпаление. EGFR, рецептор за епидермален растежен фактор; ERK, извънклетъчна сигнално-регулирана киназа; MAP, протеин, активиран от митоген; MEK, митоген-активирана протеин киназа/ERK киназа; mTOR, мишена на рапамицин за бозайници; PI3-K, фосфатидилинозитол 3-киназа; PTEN, фосфатаза и тензин хомолог; STAT, преобразувател на сигнал и активатор на транскрипция.
Инхибиране на Ras/Raf/MEK/MAPK сигнализиране от флавоноиди
Неопластичната трансформация на клетките и възпалението се считат за основни събития, допринасящи за канцерогенезата. EGFR се активира от растежни фактори, като епидермален растежен фактор (EGF). Свързването на EGF води до активиране и фосфорилиране на EGFR върху неговите тирозинови остатъци, което в крайна сметка задейства активирането на Ras. Ras активира Raf, който фосфорилира митоген-активирана протеин киназа/ERK киназа (MEK) 1/2, която впоследствие активира митоген активиран протеин (MAP) кинази или MAP киназа киназа (MKK) сигнализиране. Последващите ефектори на каскадите MAP киназа и MKK включват съответно извънклетъчни сигнално-регулирани кинази (ERKs), p90 рибозомни S6 кинази (RSKs) и c-Jun N-терминални кинази (JNKs), съответно (фиг. 3). Ras и/или Raf са конститутивно активирани в различни ракови клетъчни линии и MEK играе критична роля при предаването на сигнали, инициирани от различни туморни промотори, като EGF или 12-O-тетрадеканоилфорбол-13-ацетат (TPA). Конститутивното активиране на MEK1 причинява клетъчна трансформация и блокирането на активността на MEK киназата може да потисне трансформацията и растежа на тумора in vivo (35, 129).
EGFR активиране на пътя Ras/Raf/MEK/MAPK. Свързването на EGF води до активиране и фосфорилиране на EGFR върху неговите тирозинови остатъци, което в крайна сметка задейства активирането на Ras. Ras активира Raf, който фосфорилира MEK1/2, който впоследствие активира MAP кинази или MKK сигнализация. Ефекторите надолу по веригата на каскадите MAP киназа и MKK включват съответно ERK, RSK и JNK. Трансактивацията на AP-1 и NF-κB е често срещан резултат от активирането на този път и може да доведе до повишена клетъчна трансформация, пролиферация на ракови клетки и туморен растеж. AP-1, активатор протеин-1; JNKs, c-Jun N-терминални кинази; MKK, MAP киназа киназа; NF-κB, ядрен фактор-kappaB; RSKs, p90 рибозомни S6 кинази.
Активирането на пътя Ras/Raf/MEK/MAPK често задейства AP-1 транзактивация. Хомодимеризация на Jun протеини или хетеродимеризация на Jun и Fos протеини от двете подсемейства или други транскрипционни фактори, включително активиращия транскрипционен фактор 2 (ATF2), осигурява на комплексите способността да разпознават специфични ДНК последователности, известни като TPA-реагиращи елементи или AP- 1 сайта. Нетният резултат от активирането може да включва повишена пролиферация, ангиогенеза, метастази, оцеляване, подвижност и намалена апоптоза. TPA, 12-0-тетрадеканоилфорбол-13-ацетат.
Много от флавоноидните съединения, които сме изследвали в нашата лаборатория, изглежда благоприятстват MEK като протеинова цел (фиг. 5; Таблица 1), въпреки че повечето флавоноиди са насочени към множество протеини, за да упражнят своите ефекти. Обща характеристика при взаимодействието на различни флавоноиди с МЕК е неконкурентно инхибиране на аденозин трифосфат (АТФ). Делфинидин (таблица 1) е антоцианидин (т.е. растителен пигмент), който се съдържа в много плодове, особено плодове и нар. Това съединение отслабва индуцираната от EGF или H-Ras клетъчна трансформация и намалява експресията на циклооксигеназа 2 (COX2) в кожни клетки на JB6 P + чрез директно свързване и потискане на Raf и MEK киназни активности (70). Свързването на делфинидин с Raf1 или MEK1 наистина е неконкурентно с ATP, което е подобно на други MEK инхибитори. Инхибирането на Raf и MEK от делфинидин също води до последващо затихване на TPA-индуцирано фосфорилиране на MEK, ERK и RSK и намалява активирането на AP-1 и ядрени фактори-kappaB (NF-kB) транскрипционни фактори, индуцирани от TPA 70).
Флавоноидите предпочитат Raf1 и MEK1 и техните субстратни протеини надолу по веригата, за да упражняват своите инхибиторни ефекти. Преференциалните цели на много флавоноиди включват неконкурентното (т.е. с АТФ) инхибиране на Raf1 и MEK1. Много съединения също потискат киназната активност на ERK2, RSK2, MKK4 и Cot по начин, който е конкурентен на ATP. Резултатите от инхибирането включват намаляване на индуцираната от туморен промотор клетъчна трансформация, COX2 активност, AP-1 и NF-κB активиране, туморен растеж и пролиферация и образуване на тумор in vivo. АТФ, аденозин трифосфат; COX2, циклооксигеназа 2.
маса 1.
Протеинови цели на избрани флавоноиди
Кверцетин (Таблица 1) е флавоново (т.е. флавонолно) съединение, което се намира на високи нива в различни храни, включително грозде и червено вино. Съобщава се, че кверцетинът потиска пролиферацията на раковите клетки, но не засяга нормалните клетки и също така намалява промотирания от TPA рак на кожата на мишката (132). Ние съобщихме, че екстрактът от червено вино (RWE) или кверцетин намаляват TPA-индуцираната неопластична трансформация на епидермална кожна клетка JB6, което е свързано с дозозависимо намаляване на AP-1 и NF-κB активиране (92). Резултатите от падащите анализи показват, че RWE или кверцетин директно се свързват с Raf1 или MEK1 и намаляват индуцираното от ТРА фосфорилиране на ERK и RSK. Въпреки че RWE или кверцетин потискат активността на Raf1 киназа, ефектът им върху MEK1 е много по-мощен. В допълнение, кверцетинът има по-силен инхибиторен ефект от PD098059, добре известен фармакологичен инхибитор на MEK. Резултатите от докирането на протеини от силико предполагат, че кверцетинът образува водородни връзки с гръбначната амидна група на Ser212 на MEK1, което е ключово взаимодействие за стабилизиране на неактивната конформация на активационната верига на MEK1 (92).
Изофлавоните са подсемейство от флавоноидни съединения, които не само действат като антиоксиданти, но и се държат подобно на слабите естроген-активни съединения и по този начин се наричат фитоестрогени (53). Счита се, че тези съединения са основните компоненти в соята, които са отговорни за докладваните биологични ефекти (36). Ензимите в дебелото черво преобразуват соевите изофлавони, като даидзеин, до множество метаболити, включително еквол (66, 73), 6,7,4′-трихидроксиизофлавон [6,7,4′-THIF (81)] и 7,3 ′, 4′-трихидроксиизофлавон [7,3 ′, 4′-THIF (81, 82) Таблица 1]. Епидемиологичните и животински проучвания показват, че изофлавоните могат да намалят риска от рак. За разлика от това, при някои проучвания при хора и животни също се наблюдават стимулиращи тумора ефекти. По този начин изясняването на основните молекулни цели и механизмите на дейностите на соевите съединения като даидзеин и неговите метаболити, еквол, 6,7,4′-THIF и 7,3 ′, 4′-THIF е важно и критично за разбирането на очевидното противоречиви ефекти от консумацията на соя. Установихме, че метаболитите на даидзеин са по-ефективни химиопрофилактични средства от изходното даидзеиново съединение. Техните протеинови цели обаче са уникални.
Доказано е, че Equol (Таблица 1) предпазва от индуциран от ултравиолетовите лъчи рак на кожата в модел на обезкосмена мишка (142). Сравнихме ефектите на equol и daidzein върху индуцираната от TPA активност на AP-1 и трансформацията на JB6 P + клетки и резултатите показаха, че equol, но не и daidzein, са насочени към сигналния път MEK/ERK/p90RSK/AP-1. Той силно потиска MEK киназната активност, което води до потискане на активирането на c-Fos и AP-1 трансактивация и намалена клетъчна трансформация (71). Equol, но не и дайдзеин, атенюира TPA-индуцирано фосфорилиране на ERK1/2, p90RSK и Elk, но не и фосфорилиране на MEK или JNKs. Въпреки това, equol инхибира MEK1, но не и Raf1, киназна активност. Важно е, че екволът се свързва специфично с MEK неконкурентно с ATP, за да потисне активността на MEK (71). Тези резултати разкриха молекулярна основа за противораковото действие на еквол и може частично да обяснят докладваните химиопрофилактични ефекти на соята. Другите метаболити на даидзеин нито инхибират, нито взаимодействат с MEK или Raf и ще бъдат обсъдени по-късно.
Изорамнетин (Таблица 1) е друго растително флавонол, което се намира в различни плодове и лечебни билки. Ние съобщихме, че изорамнетинът инхибира индуцираната от EGF неопластична клетъчна трансформация на клетки JB6 и потиска зависимия от закотвянето и независим растеж на клетките на човешки епителни карциноми A431 (75). Isorhamnetin атенюира индуцираната от EGF експресия на COX2 в клетки JB6 и A431 и намали растежа на тумора A431 и експресията на COX2 в модел на мишка с ксенографт. Изорамнетин ефективно потиска EGF-индуцираната фосфорилация на ERKs, RSK, p70S6 киназа и Akt. Тези ефекти са обяснени с резултатите от теста за свързване, което показва, че изорамнетинът се свързва директно с MEK1 по ATP-неконкурентен начин, за да потисне неговата активност.
Последващите ефектори на активността на MEK включват протеините ERK и RSK. Тези кинази също са популярни директни флавоноидни мишени (фиг. 5). Кверцетин-3-метиловият етер, естествено съединение, което присъства в различни растения, включително годни за консумация кактуси от бодлива круша, има мощна противоракова активност. Установихме, че кверцетин-3-метиловият етер може да контролира растежа на раковите клетки на гърдата, които са чувствителни или устойчиви на рецепторния инхибитор на тирозин киназата, лапатиниб (95). Кверцетин-3-метиловият етер изглежда действа главно чрез индуциране на спиране на клетъчния цикъл и апоптоза при двата клетъчни типа (95). Също така установихме, че кверцетин-3-метиловият етер инхибира пролиферацията на епидермални клетки на мишка кожа JB6 P + в зависимост от дозата и времето чрез индуциране на натрупване на G2/M фаза в клетъчния цикъл и намаляване на AP-1 активирането и ERKs фосфорилиране (94) . Нетният резултат е потискане на TPA-индуцирана JB6 неопластична клетъчна трансформация. Тестовете с изтегляне разкриват, че кверцетин-3-метиловият етер директно се свързва с ERKs, засягащи ERK2, за да упражни своята мощна химиопрофилактична активност (94).
Рибозомната S6 киназа 2 (RSK2) е член на семейството на p90RSK (RSK) протеини. Това е широко експресирана серин/треонин киназа, която се фосфорилира и активира от ERKs и фосфоинозитид-зависима киназа 1 (PDK1) в отговор на растежни фактори и нейното активиране подобрява клетъчното оцеляване. RSK2 е важен регулатор на индуцираната от туморен промотор клетъчна трансформация и неговата висока експресия увеличава пролиферацията, както и независима от закотвянето трансформация на JB6 Cl41 кожни клетки и образуване на огнища в NIH3T3 клетки (26). Нивото на протеин RSK2 е значително по-високо в раковите клетъчни линии, както и в раковите тъкани в сравнение с немалигнените клетъчни линии или нормалните тъкани. Решихме и докладвахме кристалната структура за NH2-крайния киназен домен [NTD; (102)] и COOH-крайния киназен домен [CTD; (103)] и използва тези структури за идентифициране на нови инхибитори на тази онкогенна киназа.
Кемпферол (таблица 1) е флавонол, който присъства в различни природни източници, особено в листата на лука (832,0 mg/kg) (107). Установихме, че кемпферол инхибира пролиферацията на злокачествени клетъчни линии на човешки рак, включително епителния карцином A431, меланомите SK-MEL-5 и SK-MEL-28 и раковите клетки на HCT-116 (27). Механизмът на инхибиране е свързан с директното му свързване с RSK2 за потискане на активността на RSK2. Предоставихме доказателства, които показват, че активирането на NTD на RSK2 е необходимо за активиране на ERKs-медиирания CTD. Изчислителното моделиране прогнозира, че кемпферолът се свързва с NTD, но не и CTD (27), за да упражнява своята активност. Тази прогноза беше потвърдена експериментално и проведохме експерименти с мутагенеза, за да покажем ясно, че Val82 и Lys100 са критични аминокиселини за свързване на кемпферол и активност на RSK2 (27).
Ериодиктиолът (Таблица 1) е флаванон, който се намира в различни плодове и ние открихме, че той също се свързва с NTD на RSK2, за да инхибира активността на RSK2 N-терминална киназа (79, 85, 98). В същото проучване установихме, че ATF1 е нов субстрат на RSK2 и че сигнализирането на RSK2-ATF1 играе важна роля в индуцираната от EGF неопластична клетъчна трансформация. RSK2 фосфорилира ATF1 при Ser63 и повишена транскрипционна активност на ATF1 и индуцирана от тумор промотор JB6 клетъчна трансформация. Eriodictyol няма ефект върху фосфорилирането на RSK, MEK1/2, ERK1/2, p38 или JNKs, което показва, че това съединение потиска специфично RSK2 сигнализирането. Фосфорилирането на ATF1 от RSK2 и последващите му клетъчни ефекти, включително образуването на фокус, медиирано от Ras, бяха значително атенюирани с лечение с ериодиктиол (98). Освен пътя Ras/Raf/MEK/MAPK, флаваноидите също така силно взаимодействат с Src и Fyn трирозинкиназите, за да пречат на тяхната активност (Фиг. 6).
- Нови култивиране на симбиоза на гъбички-насекоми, молекулярни и хистологични методи определят сапрофитния
- Рената Валецило Молекулярна и клетъчна биология
- Новини и съобщения Молекулярна и клетъчна биология в магистърска програма в UMass Amherst
- Новини и съобщения Молекулярна и клетъчна биология в магистърска програма в UMass Amherst
- Съдържание на разтворима галактоза в избрани зърнени храни и сокове за бебешка храна - ScienceDirect