1 Отдел по гастроентерология, Отделение по вътрешни болести, Мемориална болница Mackay, Тайван
2 Медицински колеж Mackay Junior, медицински сестри и мениджмънт, Тайпе, Тайван
3 Медицински колеж Mackay, Ню Тайпе, Тайван
4 Отделение по радиационна онкология, болница Mackay Memorial, Тайпе, Тайван
5 Завършил Институт по фармакология, Медицински университет в Тайпе, Тайпе, Тайван
Резюме
Заден план. Перитонеалната карциноматоза (PC), придружена от образуване на асцит, причинява няколко тревожни симптоми, водещи до лошо качество на живот. Методи. Двадесет голи мишки BALB/c, генерирани чрез директно ортотопично инжектиране на човешки рак на панкреаса PANC-1 клетки бяха рандомизирани, за да получат или основна лабораторна диета, или основна диета, допълнена с глутамин. Половината от мишките бяха умъртвени на ден 76 за измерване на количеството на асцитна течност и обем на тумора на панкреаса. Останалите мишки са подложени на анализ на оцеляването. Нивата на серумен албумин се изчисляват на всеки 2 седмици. Резултати. На ден 76 средното количество асцитна течност, измерено в контролната група, беше
mL от мишки с добавка на глутамин (
). Обемът на тумора на панкреаса беше
cm 3 в контролната група и
cm 3 при мишки с добавка на глутамин (). Средното време за оцеляване на мишките, допълнени с глутамин, беше удължено от
до дни (). Средните нива на серумен албумин са били по-високи в групата с добавка на глутамин. Заключения. Това предклинично проучване показа, че пероралното добавяне на глутамин може да осигури редуцираща асцит активност при пациенти с рак на панкреаса с PC, чрез клетъчно-медииран имуно-независим механизъм.
1. Въведение
Перитонеалната карциноматоза (PC) е добре установена като терминална характеристика на напреднали първични или вторични новообразувания, включващи перитонеума. PC е предизвикателно усложнение, свързано с лоша прогноза и ограничени възможности за лечение [1]. Локално напредналият рак на панкреаса е едно от най-често срещаните заболявания, причиняващи PC и последващо образуване на асцит. Пациентите с рак на терминален стадий с PC имат средна преживяемост от 3–6 месеца [2]. На този терминален етап качеството на живот, а не удължаването на оцеляването, се счита за най-важния въпрос в палиативните грижи. Независимо от това, значението на удължаващите живота палиативни грижи придобива признание в новата ера на управлението на рака.
Тъй като асцитът, свързан с PC, се развива поради фактори на хидростатичното налягане, а не на осмотичните фактори, настоящото управление на състоянието включва абдоминална парацентеза, приложение на диуретици и ограничаване на солта. Подкрепата за храненето представлява алтернативна стратегия за подобряване на общото благосъстояние след управление на асцит. Въпреки това, стойността на хранителната подкрепа при пациенти с PC остава противоречива с неоспорими ползи за оцеляване [3] и се опасява, че може да ускори растежа на тумора [4, 5].
Патогенезата на образуването на асцит в PC е неясна. Смята се, че това е корелация между ендотелните клетки, ангиогенезата и цитокините, освободени в перитонеума [6–8]. Взаимодействията между ендотели и левкоцити със сигурност играят роля, водеща до освобождаване на цитокини и до активиране на ендотела на перитонеума. Предишно експериментално проучване предполага, че инжектирането на генетично модифицирани фибробласти, експресиращи интерлевкин-12, е лечение с ефект при миши панкреатичен PC чрез активиран вроден имунитет и особено активира M1 макрофаги [9]. Друго проучване установи, че ангиопоетин-1, регулатор на ендотелните клетки, може да намали образуването на асцит чрез посредничество на съдов ендотелен растежен фактор [10].
Глутаминът (GLN), най-разпространената свободна аминокиселина в циркулацията, служи като важен енергиен източник за много бързо пролифериращи клетки, особено ентероцити, лимфоцити и фибробласти. Различни рандомизирани контролирани проучвания при неракови пациенти показват, че GLN подобрява метаболизма на азота и поддържа имунния отговор, като по този начин подобрява резултата на пациента [11, 12].
Целта на настоящото проучване беше да се оценят потенциалните ефекти на перорално прилагания GLN при тумор-носещи гостоприемници с PC и асцит.
2. Методи
2.1. Модел за животни и експериментален компютър
Мъжки голи мишки BALB/c, на възраст между 6 и 8 седмици, бяха използвани в съответствие с институционалните насоки. PANC-1 клетки, получени от лошо диференциран човешки панкреатичен епителиоиден карцином, са закупени от American Type Culture Collection (ATCC, Rockville, MD, USA). PANC-1 клетките се събират при концентрация 5 × 106/ml от субконфлуентни култури. Експериментален компютър е генериран чрез директно ортотопично инжектиране на PANC-1 клетки в опашката на панкреаса. За да се предотврати изтичането, памучен тампон се държи внимателно за 1 минута над мястото на инжектиране. След това коремната рана беше затворена с конци. Животните са получили лапаротомия, за да потвърдят растежа на тумора, достигащ до 5 mm на 10-ия ден (Фигура 1).
2.2. Протоколи за лечение
Двадесет мишки с потвърден туморен растеж на 10-ия ден бяха рандомизирани в 2 групи с подобно средно телесно тегло във всяка. Група А (
) получи основна лабораторна диета с носител за глутамин, а група В () получи основна лабораторна диета, допълнена със 100% GLN (5 mg/(kg · ден)).
2.3. Растеж на тумора, серумен албумин, ниво на аспартат аминотрансфераза и брой на бялата кръв, образуване на асцит и оцеляване
Пет мишки от всяка група бяха умъртвени на ден 76. Асцитите бяха събрани чрез извършване на разрез на долната средна линия, напълно източване на интраабдоминалната течност и количеството аскетична течност беше измерено с помощта на 0,5 ml инсулинова спринцовка. След това разрезите бяха разширени, за да се позволи наблюдение на перитонеалната кухина и потвърждаване на степента на PC. Туморите бяха изрязани и обемът на тумора беше измерен като 1/2 ×
(= максималният диаметър и = минималният диаметър). След това останалите 5 мишки от всяка група бяха наблюдавани до анализ на смъртта за оцеляване. Серумен албумин, нива на аспартат аминотрансфераза (AST) и броя на белите кръвни клетки в кръвта (WBC) за всяко животно се събират на всеки 2 седмици. Това проучване получи одобрение от Институционалния комитет по грижите и употребата на животните и Институционалния съвет за преглед на болница Mackay Memorial, Тайпе, Тайван.
3. Резултати
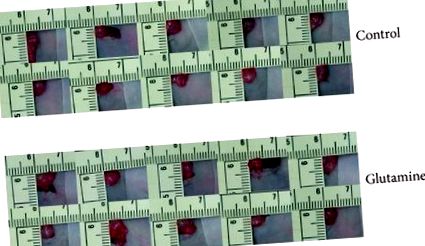
Всички мишки понасят добре лечението. Количеството на събрания асцит е 1,2 ± 0,3 и 0,5 ± 0,5 ml в контролната и GLN-третираната група, съответно (). На 76-ия ден обемът на тумора на панкреаса е 2,60 ± 0,8 cm 3 при контролните мишки и 1,98 ± 1,3 cm 3 в групата, лекувана с GLN (). След това останалите 5 мишки от всяка група бяха наблюдавани до анализ на смъртта за оцеляване. На 85-ия ден само 1 животно от контролната група беше живо в сравнение с всички 5 мишки в групата, третирана с GLN. Коремната обиколка очевидно е била по-малка при третирани с GLN мишки (Фигура 2). Средният период на оцеляване на мишките () беше по-дълъг на 101 ± 2 дни с добавка на GLN за разлика от 87 ± 4 дни в контролната група (). Средното ниво на серумен албумин е по-високо в групата, лекувана с GLN, за всяка събрана кръвна проба (Фигура 3). Няма значителна разлика в нивото на циркулиращия WBC и серумния AST и в двете групи.
4. Дискусия
Имунонутриентите са специфични хранителни вещества, които оказват имунологични ефекти, когато се консумират на нива над дневните нужди. GLN е добре познат имунонутриент, тъй като е от съществено значение за растежа и функцията на Т-лимфоцитите и естествените клетки-убийци, за които е доказано, че и двете потискат прогресията на рака чрез тяхната цитолитична активност [13]. Доказано е, че орално приложена добавка на GLN предотвратява растежа на тумора на гърдата чрез инхибиране на производството на антиоксидант глутатион, активиране на p53 сигнализиране и инхибиране на PI3 K/Akt сигнализиране [14, 15]. В модела на атимни мишки, използван в нашето проучване, ние демонстрирахме благоприятна роля на GLN за намаляване на образуването на асцит, забавяне на растежа на тумора и удължаване на преживяемостта. Нямаше значителна разлика в циркулиращия WBC в тези две групи. Като се има предвид, че Т-клетъчно-медиираният имунитет е недостатъчен при атимични мишки, благоприятните ефекти от добавките с GLN вероятно ще се получат чрез механизъм, независим от Т-клетъчно-медиирания имунитет. Въпреки това, въздействието на GLN върху имунните клетки, инфилтриращи се в асцит, остава да бъде изследвано при имунокомпетентни опитни животни.
В това предварително проучване перорално приложената добавка на GLN намалява количеството на асцит, произведен в PANC-1 мишки, носещи тумор с PC. Потенциалните механизми на действие на GLN включват поддържане на целостта на лигавицата, противовъзпалителни ефекти в резултат на повишен синтез на глутатион и индуциране на синтез на протеин от топлинен шок за отслабване на цитокините и подобряване на имунната компетентност [12].
Предишното безпокойство, че използването на хранителна подкрепа може да стимулира растежа на тумора, не беше наблюдавано в нашето проучване, тъй като средният обем на тумора на тумора на панкреаса беше по-малък при третирани с GLN мишки в сравнение с контролната група. Освен това добавките с GLN увеличават времето за оцеляване. През последните 2 десетилетия няколко клинични проучвания оценяват толерантността и безопасността на GLN при пациенти с рак. В повечето от тези клинични проучвания перорално приложеният GLN се понася добре, без данни за повишен туморен растеж. Важно е ефектът от добавките на GLN върху растежа на туморите да получи допълнително потвърждение както в животни, така и в клинични проучвания.
Средното ниво на серумен албумин е по-високо в групата, лекувана с GLN. Този резултат може да подкрепи предишната констатация, че хранителните добавки с GLN са имали положително влияние върху статуса на висцерален протеин [16]. Остава да се изясни дали повишените нива на албумин корелират с намаленото образуване на асцит. Тъй като няма значителна разлика в серумните нива на AST между тези две групи, механизмът на нарастване на албумина може да не е свързан с подобряване или защита на чернодробната функция. Освен това, ефектът на увеличаване на албумина на GLN предполага възможното му приложение при лечение на асцит, свързан с дефицит на албумин, като цироза на черния дроб.
Подобряването на управлението на асцит при пациенти с рак на панкреаса в терминален стадий е критичен въпрос не само за подобряване на качеството на края на живота, но и за постигане на удължаване на живота. Това предварително проучване показва, че пероралното добавяне на GLN при пациенти с PC може да представлява обещаващ имунонутриент за подобрен контрол на асцита. Необходимо е допълнително изясняване на механизма на действие, както и клинично валидиране.
Конфликт на интереси
Авторите декларират, че няма конфликт на интереси по отношение на публикуването на тази статия.
Признание
Това проучване беше подкрепено от Grants MMH-9700-01, MMH-100-01 и MMH-10016 от болница Mackay Memorial, Тайван.
Препратки
- L. Santarpia, L. Alfonsi, F. Pasanisi, C. de Caprio, L. Scalfi и F. Contaldo, „Прогнозни фактори за оцеляване при пациенти с перитонеална карциноматоза при домашно парентерално хранене“ Хранене, об. 22, бр. 4, стр. 355–360, 2006. Преглед на: Издателски сайт | Google Scholar
- J. M. Davies и B. O'Neil, „Перитонеална карциноматоза от стомашно-чревен произход: естествена история и възможности за лечение“, Становище на експертите относно изследваните наркотици, об. 18, бр. 7, стр. 913–919, 2009. Преглед на: Издателски сайт | Google Scholar
- P. Good, J. Cavenagh, M. Mather и P. Ravenscroft, „Медицинско подпомогнато хранене за палиативни грижи при възрастни пациенти“ База данни на Cochrane за систематични прегледи, не. 4, Идентификатор на статия CD006274, 2008. Преглед на: Google Scholar
- М. Х. Торосян, „Стимулиране на растежа на тумора чрез хранителна подкрепа“, Вестник за парентерално и ентерално хранене, об. 16, допълнение 6, стр. 72S – 75S, 1992. Изглед на: Google Scholar
- M. H. Torosian и R. B. Donoway, „Общо парентерално хранене и туморни метастази“, Хирургия, об. 109, бр. 5, стр. 597–601, 1991. Изглед в: Google Scholar
- J. K. Min, Y. M. Kim, S. W. Kim et al., „Индуциран от TNF активиран цитокин повишава левкоцитната адхезивност: Индукция на ICAM-1 и VCAM-1 чрез TNF рецептор-свързан фактор и протеин киназа C-зависим NF-κB активиране в ендотелните клетки, " Вестник на имунологията, об. 175, бр. 1, стр. 531–540, 2005. Изглед в: Google Scholar
- S. Ghosh, S. Roy, M. Banerjee и P. Maity, „Модулация на индуцирана от тумор ангиогенеза при асцитен тумор на Ehrlich“, Списание за експериментални и клинични изследвания на рака, об. 23, бр. 4, стр. 681–690, 2004. Преглед в: Google Scholar
- C. L. Yeh, C. S. Hsu, S. C. Chen, M. H. Pai и S. L. Yeh, „Ефект на глутамин върху експресията на клетъчна адхезионна молекула и трансмиграция на левкоцити в ендотелни клетки, стимулирани от плазмена или перитонеална дренажна течност от хирургичен пациент,“ Шок, об. 25, бр. 3, стр. 236–240, 2006. Преглед на: Издателски сайт | Google Scholar
- J. M. Péron, C. Bureau, P. Gourdy et al., „Лечение на експериментална миши панкреатична перитонеална карциноматоза с фибробласти, генетично модифицирани, за да експресират IL12: роля за перитонеалния вроден имунитет,“ Червата, об. 56, бр. 1, стр. 107–114, 2007. Преглед на: Издателски сайт | Google Scholar
- O. Stoeltzing, S. A. Ahmad, W. Liu et al., "Ангиопоетин-1 инхибира растежа на тумора и асцита в миши модел на перитонеална карциноматоза," Британски вестник за рака, об. 87, бр. 10, стр. 1182–1187, 2002. Преглед на: Сайт на издателя | Google Scholar
- M. Coëffier, O. Miralles-Barrachina, F. le Pessot et al., „Влияние на глутамин върху производството на цитокини от човешките черва in vitro“, Цитокин, об. 13, бр. 3, стр. 148–154, 2001. Преглед на: Издателски сайт | Google Scholar
- Y. C. Hou, C. S. Hsu, C. L. Yeh, W. C. Chiu, M. H. Pai и S. L. Yeh, „Ефекти на глутамин върху експресията на адхезионната молекула и трансмиграцията на левкоцитите в ендотелните клетки, изложени на арсен“, Списание за хранителна биохимия, об. 16, бр. 11, стр. 700–704, 2005. Преглед на: Издателски сайт | Google Scholar
- K. S. Kuhn, M. Muscaritoli, P. Wischmeyer и P. Stehle, „Глутаминът като незаменим хранителен елемент в онкологията: експериментални и клинични доказателства“, Европейски вестник за храненето, об. 49, бр. 4, стр. 197–210, 2010. Преглед на: Издателски сайт | Google Scholar
- V. K. Todorova, S. A. Harms, Y. Kaufmann et al., „Ефект на диетичния глутамин върху нивата на туморен глутатион и свързани с апоптозата протеини при DMBA-индуциран рак на гърдата на плъхове,“ Изследване и лечение на рак на гърдата, об. 88, бр. 3, стр. 247–256, 2004. Преглед на: Издателски сайт | Google Scholar
- В. К. Тодорова, С. А. Хармс, С. Луо, Ю. Кауфман, К. Б. Баб и В. С. Климберг, „Пероралното добавяне на глутамин (AES-14) инхибира сигнализирането на PI-3K/Akt при експериментален рак на гърдата,“ Вестник за парентерално и ентерално хранене, об. 27, бр. 6, стр. 404–410, 2003. Изглед на: Google Scholar
- M. M. Rogero, M. C. Borges, I. A. de Castro, I. S. Pires, P. Borelli и J. Tirapegui, „Ефекти от хранителните добавки с глутамин върху телесния състав и протеиновия статус на рано отбити мишки, инокулирани с Mycobacterium bovis Bacillus Calmette-Guerin, ” Хранителни вещества, об. 3, бр. 9, стр. 792–804, 2011. Изглед на: Издателски сайт | Google Scholar
- Шипката инхибира ксантиноксидазната активност и намалява серумните нива на урат в миши модел
- MicroRNA 34a инхибира частично образуването на бежови и кафяви мазнини при затлъстяване, като потиска адипоцитите
- Диета с шест пакета Брад Крьониг, мъжки модел, яде ориз, за да остане тънък
- Следродилното хранене с диета с високо съдържание на мазнини предизвиква затлъстяване и преждевременен пубертет при малките мишки C57BL6J
- NephroCare - Пациенти вкъщи - Вашата диета - Хранене за пациенти на перитонеална диализа