Джеръми Л. Дейвис
1 Отделение по хирургия, Мемориал Слоун Кетъринг, Център за рак, Ню Йорк, Ню Йорк
Люк В. Селби
1 Отделение по хирургия, Мемориал Слоун Кетъринг, Център за рак, Ню Йорк, Ню Йорк
Джоан Ф. Чоу
2 Отдел по биостатистика и епидемиология, Център за раково заболяване Memorial Sloan Kettering, Ню Йорк, Ню Йорк
Марк Шатнър
3 Катедра по медицина, Център за рак на Мемориал Слоун Кетъринг, Ню Йорк, Ню Йорк
Дейвид Х. Илсън
3 Катедра по медицина, Център за рак на Мемориал Слоун Кетъринг, Ню Йорк, Ню Йорк
Маринела Капану
2 Отдел по биостатистика и епидемиология, Център за раково заболяване Memorial Sloan Kettering, Ню Йорк, Ню Йорк
Мъри Ф. Бренан
1 Отделение по хирургия, Мемориал Слоун Кетъринг, Център за рак, Ню Йорк, Ню Йорк
Даниел Г. Койт
1 Отделение по хирургия, Мемориал Слоун Кетъринг, Център за рак, Ню Йорк, Ню Йорк
Вивиан Е. Силна
1 Отделение по хирургия, Мемориал Слоун Кетъринг, Център за рак, Ню Йорк, Ню Йорк
Резюме
Заден план
Загубата на тегло след гастректомия при пациенти с рак на стомаха не е добре характеризирана. Оценихме въздействието на променливите, специфични за пациента и процедурата, върху следоперативната загуба на тегло след гастректомия за рак.
Методи
Проспективно поддържана база данни за рак на стомаха идентифицира пациенти, подложени на гастректомия за рак. Извличани са клинични и патологични характеристики, изходен индекс на телесна маса (ИТМ) и следоперативни тегла. Промяната в теглото се анализира чрез процентна промяна в теглото и абсолютна промяна в ИТМ. Използвани са модели на случайни коефициенти, за да се провери дали скоростта на промяна в теглото с течение на времето се различава от фактори от интерес.
Резултати
От 376 последователни пациенти, които са претърпели резекция за стомашен аденокарцином, 55% са мъже, средна възраст 66 години и среден предоперативен ИТМ 27,1 (диапазон 16,2–45,6). Общата гастректомия е свързана с по-голяма загуба на тегло от субтоталната гастректомия на 1 година (15 срещу 6%, ранен стадий; 17 срещу 7%, късен стадий). Максимална промяна на теглото се наблюдава на 6–12 месеца след операцията и остава стабилна или подобрена на 2 години. При пациенти в ранен и късен стадий средната загуба на тегло на 1 година е по-голяма за ИТМ ≥ 30 спрямо ИТМ 1,2 След операция на горната част на стомашно-чревния тракт, ползите от ранното перорално хранене са добре установени, докато допълнителното хранене често се осигурява за успокояват опасенията за загуба на тегло, недохранване и лошо качество на живот. 3–5
Сегашното ни разбиране за загуба на тегло след гастректомия е предимно информирано от резекция за язвена болест. Например в кохортата на Джонсън от 1958 г., по-малко от 10% от пациентите са имали резекция за доброкачествени или злокачествени тумори на стомаха или хранопровода. 6 Съвременните проучвания на азиатски пациенти с рак на стомаха са фокусирани върху въздействието на следоперативната загуба на тегло, свързано с провеждането на адювантна терапия, и рецидив на заболяването и оцеляване. 7,8 Въпреки тези доклади, способността ни да идентифицираме пациенти с риск от излишна следоперативна загуба на тегло и да предскажем загуба на тегло за отделни пациенти след гастректомия е ограничена.
Целта на това проучване е да опише модели на загуба на тегло след гастректомия за рак на стомаха и да идентифицира фактори, специфични за пациента и лечението, свързани с продължителността или степента на загуба на тегло. Изследвахме пациенти с рак на стомаха в ранен стадий, лекувани с гастректомия като монотерапия, за да оценим въздействието на операцията върху загубата на тегло. Тъй като предоперативният индекс на телесна маса (ИТМ) преди това е бил корелиран с постоперативни усложнения, ние също изследваме влиянието на ИТМ върху следоперативната загуба на тегло. 9 Освен това прегледахме пациенти в късен стадий, които са били подложени на мултимодална терапия, за да проучим въздействието на свързаните с лечението фактори върху следоперативната загуба на тегло.
МЕТОДИ
След одобрението на борда на институционалния преглед, всички пациенти, подложени на лечебна гастректомия за стомашен аденокарцином между юли 2007 г. и юли 2013 г., бяха идентифицирани от проспективно поддържана институционална база данни за рак на стомаха. Пациентите бяха изключени, ако не им беше записано следоперативно тегло, за палиативни или R2 резекции, проксимална гастректомия и езофагогастректомия, смърт в рамките на 90 дни или рецидив на заболяването в рамките на 12 месеца след операцията и съпътстващ рак. Предоперативната височина и тегло, записани в рамките на 10 дни след операцията, и следоперативно тегло са извлечени от електронната медицинска карта. Промяната в теглото се анализира чрез процентна промяна в теглото (килограми) и абсолютна промяна в ИТМ.
Всички пациенти са били подложени на гастректомия в една институция и са получили стандартизирани следоперативни грижи. Всички пациенти са получили или D1, или D2 лимфаденектомия. Степента на гастректомия се основава на местоположението на тумора и реконструкцията според количеството остатъчен стомах. Реконструкцията на Roux-en-Y (RY) е използвана за тотална гастректомия и субтотални гастректомии, където са отстранени повече от 50% от стомаха; Реконструкция на Billroth II (BII), когато бяха отстранени по-малко от 50% от стомаха. Пациентите са класифицирани като такива с ранен стадий (следоперативни T1/T2, N0, M0) или късен стадий (следоперативни T3/T4, N0, M0 или всякакви T, N1-3, M0-1) тумори въз основа на крайната патология според седмото издание на Американската съвместна комисия по рака (AJCC). 10 Всички пациенти получават следоперативни диетични консултации; диетичните добавки не се предоставят като част от рутинните клинични грижи.
Статистически анализ
Всички анализи бяха проведени отделно за пациенти в ранен и късен стадий. В групата на ранен етап са използвани многовариантни модели на случайни коефициенти със стабилни стандартни грешки и неструктурирана ковариационна матрица за прогнозиране на средния процент загуба на тегло от операция, а най-малко квадратни средства са използвани за прогнозиране на процент загуба на тегло за ковариатите от интерес (възраст, пол, предоперативен ИТМ, вид операция, голямо следоперативно усложнение, неоадювантна химиотерапия). 11 Визуалното изследване на графиките на данните показва квадратична връзка с времето, като по този начин многовариантните модели включват квадратичен член между времето и ковариати от интерес, което се подкрепя от по-малкия информационен критерий Akaike за моделите на квадратичните случайни коефициенти в сравнение с линейните модели. Всички модели бяха коригирани за възраст, пол и ИТМ. В допълнение към методите на многовариантна регресия бяха използвани обобщени статистически данни за описване на промяната в теглото от изходно ниво до 1 месец (3–6 седмици), 3 месеца (10–14 седмици), 6 месеца (5–7 месеца), 12 месеца ( 10–14) и 24 месеца (22–26) след операцията.
Индекс на телесна маса на ИТМ, BII Billroth-II, RY Roux-en-Y
Туморите са най-често локализирани в дисталния стомах (n = 187, 50%) или тялото (n = 106, 28%). Седем пациенти (2%) са имали аденокарцином на гастроезофагеалната връзка на Siewert III, осем пациенти (2%) са имали дифузно инфилтриращи тумори, а четирима пациенти (1%) са имали тумори в остатъчния стомах след предишна частична гастректомия. Типът на Лорън е записан като дифузен (n = 122, 32%), чревен (n = 168, 45%), смесен (n = 79, 21%) или неизвестен (n = 7, 2%). Неоадювантната химиотерапия се прилага на 40% от нашата кохорта (n = 150), докато неоадювантната лъчетерапия е рядка (n = 2, 0,5%). Пациентите са претърпели или субтотална гастректомия с BII гастроеюностомия (субтотална/BII, n = 142), междинна гастректомия с RY гастроеюностомия (субтотална/RY, n = 92) или тотална гастректомия с RY езофагоеюностомия (общо/RY, n = 142). Като цяло 23% (85/376) от всички пациенти са получили минимално инвазивна гастректомия и не е имало разлика в загубата на тегло между пациенти, които са били подложени на открита гастректомия и тези, които са били подложени на минимално инвазивна гастректомия.
Разпределението на следоперативния патологичен стадий беше: етап 0 (n = 16, 4%, всички от които получиха неоадювантна химиотерапия с пълен патологичен отговор), етап I (n = 153, 41%), етап II (n = 121, 32% ), етап III (n = 82, 22%) и етап IV (n = 4, 1%). Адювантна химиотерапия е прилагана при 35% (n = 132) от пациентите; 7% (n = 25) са получили адювантна лъчева терапия. Основни усложнения (степен 3 и 4) са регистрирани при 54 пациенти (14%). По-малка част от пациентите са поставили епруветки за ентерално хранене (n = 20, 5%), винаги в контекста на следоперативни усложнения. 12
Ранно заболяване
Късна стадия на заболяването
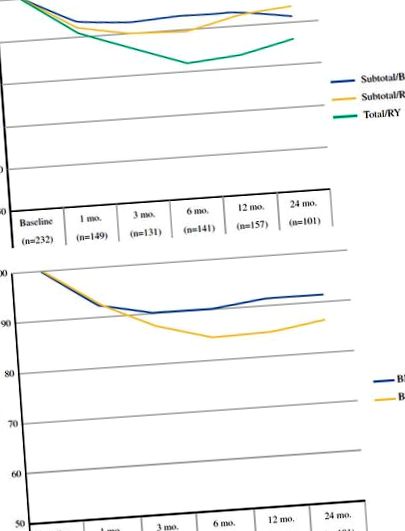
Моделите на загуба на тегло при 221 пациенти в късен стадий са подобни на тези, наблюдавани при пациенти в ранен стадий. Надирът в следоперативното тегло е настъпил на 6 месеца и теглото изглежда се е увеличило или се е увеличило след това. Както се очакваше, пациентите в късен стадий имат по-висок процент неоадювантна (49 срещу 27%) и адювантна химиотерапия (49 срещу 15%), отколкото пациентите в ранен стадий. Прилагането на неоадювантна химиотерапия е свързано със средно процентно изменение на теглото от първоначалната оценка до времето на операция от -1,9% (SD ± 6,4), а адювантната терапия няма статистически значим ефект върху загубата на тегло. Както при пациентите в ранен стадий, пациентите в късен стадий, претърпели тотална гастректомия, са достигнали най-ниско следоперативно тегло приблизително на 6 месеца (фиг. 2б).
Промяна в теглото с течение на времето при пациенти с късен стадий на рак на стомаха по тип процедура (а) и изходен ИТМ (б). Броят на пациентите, допринасящи за изчисляването на средната стойност на загуба на тегло във всяка точка от времето, е показан в скоби
Поставянето на перкутанна ендоскопска еюностомична епруветка в следоперативния период е рядко явление (n = 20, 5%), предимно при пациенти в късен стадий (n = 14; 70% от всички поставяния) и винаги в резултат на усложнение което предотвратява пероралното хранене. Пациентите, претърпели тотална гастректомия, са имали постоперативни епруветки за хранене, поставени по-често (8%) в сравнение с субтотална гастректомия с двата метода на реконструкция (BII, 3%; RY, 4%). Няма връзка между поставянето на сонда за хранене и загубата на тегло и няма разлика нито в предоперативното тегло, нито в ИТМ между пациентите, които са получавали и не са получавали следоперативни епруветки за хранене (p = 0,4 и p = 0,06, съответно). Ниската честота на основните усложнения при пациенти в ранен (n = 20, 13% от всички пациенти) и късен стадий (n = 34, 15%) изключва анализа на ефекта от усложненията върху загубата на тегло.
За да изследваме ефекта от изключително нисък или висок ИТМ върху следоперативната загуба на тегло, анализирахме отделно пациенти с ИТМ 35. 145-те пациенти с ИТМ 35 (медиана 37,5). Те са претърпели тотална гастректомия (n = 8), междинна сума/RY (n = 7) или междинна сума/BII (n = 12). От 14 пациенти в късен стадий, 7 са получили неоадювантна химиотерапия, а 13 пациенти са имали ранен стадий на заболяването. Основни следоперативни усложнения настъпиха при 5 пациенти, а на 2 бяха поставени сонда за хранене.
ДИСКУСИЯ
Това проучване предлага най-голямото описание на следоперативната загуба на тегло след гастректомия за рак на стомаха в западен център. Загубата на тегло е най-голяма при пациенти, които се нуждаят от пълна гастректомия и най-ниски стойности между 6 и 12 месеца следоперативно за пациенти в късен стадий (фиг. 2) и 12 и 18 месеца за пациенти в ранен стадий (фиг. 1). Независимо от процедурата, пациентите с по-голям изходен ИТМ губят значително повече тегло от пациентите с по-нисък ИТМ, като същевременно поддържат нормален или с наднормено тегло ИТМ през цялото време.
Пациенти с ранен стадий на заболяване и ИТМ 13 Приблизително две трети от тези пациенти са имали ранен стадий на заболяването и среден предоперативен ИТМ в нормални граници.
Изпитване от Fein et al. сравнява реконструкция на RY със или без торбичка след пълна гастректомия и отчита 15% загуба на тегло на 3–6 месеца, която продължава при 5 години за всички пациенти. 14 По същия начин установихме, че пациентите с рак на стомаха в ранен стадий, подложени на тотална гастректомия с реконструкция на RY, са имали очаквана загуба на тегло от изходно ниво от 12 и 19% съответно на 3 и 6 месеца. Пациентите с късен стадий на заболяването, подложени на тотална гастректомия, са имали сравнима наблюдавана загуба на тегло на 3 и 6 месеца след операция съответно от 13 и 17%.
Нашата практика е да позволяваме ограничено количество течности през устата на първия следоперативен ден, ако жизнените показатели и клиничният преглед на пациента са нормални. Диетата се усъвършенства ежедневно и до постоперативния ден 4 пациенти може да консумират диета след гастректомия. Всички пациенти получават диетични консултации от медицински и медицински сестри преди изписването. Ние не включваме хранителни добавки като част от рутинните клинични грижи. Рентгенологична оценка на анастомозите се извършва при клинични показания. Тъй като рутинното използване на епруветки за хранене не е подкрепено от бъдещи данни и може да бъде вредно, ние ги поставяме само след усложнение, което предотвратява оралното хранене. 4,5,15,16 След гастректомия, опасенията относно следоперативната загуба на тегло и хранителните дефицити са мотивиращи фактори за продължаване на проучването на ранното следоперативно ентерално или парентерално хранене. Нашите данни показват, че не само можем да предскажем значителна следоперативна загуба на тегло въз основа на планираната операция и изходния ИТМ, но също така и че рутинната употреба на ентерални епруветки за хранене е ненужна.
Това проучване е ограничено от неговия ретроспективен характер и пристрастия, които придружават всеки доклад за една институция. Целяхме да характеризираме въздействието на степента на резекция на стомаха и други лесно измерими променливи, свързани с лечението, върху следоперативната загуба на тегло. Като такова нашето проучване не се опитва да корелира фактори като загуба на тегло преди диагнозата, хранителни параметри (напр. Преалбумин) или съпътстващи заболявания, като диабет или тютюнева зависимост.
Наблюдението на предсказуема и закономерна загуба на тегло въз основа на общоизмерими фактори добавя сила към обобщаемостта на нашите констатации. Основна сила на тези данни е лечението на последователни пациенти в съвременната ера от хирурзи с последователни практики. Следоперативната загуба на тегло явно зависи от предоперативния ИТМ и степента на резекция. Повечето пациенти изпитват умерена загуба на тегло, достигат най-ниски стойности между 6 и 18 месеца след операцията (в зависимост от клиничния стадий и степента на операция) и впоследствие стабилизират или увеличават теглото си. Тези данни ще позволят на клиницистите да идентифицират и да консултират пациенти с риск за значителна следоперативна загуба на тегло.
Благодарности
Авторите благодарят на Мариан Бенинати за нейния опит и отдаденост в управлението на базата данни за рак на стомаха.
ОПОВЕСТЯВАНЕ Това изследване е финансирано отчасти чрез гранта за подкрепа на Центъра за рак на NIH/NCI P30 CA008748.
- Предсказващи загуба на тегло в края на лечението и 1-годишно проследяване за поведенческа загуба на тегло
- Предсказващи упражнения за успех при отслабване срещу
- Модели и предиктори за отслабване след гастректомия за рак - PubMed
- T2D, Отслабване, независимо свързано с по-висок риск от рак на панкреаса AJMC
- Питър Фачинели разкрива отслабване с 30 кг, позира без риза за рак на простатата