Субекти
Резюме
Съобщаваме за неочаквана връзка между стареенето, термогенезата и наддаването на тегло чрез рецептора, свързан с протеин G протеин GPR3. Мишките, които нямат GPR3 и се поддържат в нормален чау, са имали сходни телесни тегла през първите 5 месеца от живота си, но след това са натрупали значително повече тегло и са показали намален общ енергиен разход и по-ниска основна телесна температура. Към 5-месечна възраст GPR3 KO мишките вече са имали по-ниска термогенна генна експресия и ниво на разединяване на протеин 1 и показват нарушено усвояване на глюкоза в междускапуларната кафява мастна тъкан (iBAT) спрямо WT котилата. Тези молекулярни отклонения в iBAT на GPR3 KO мишки предшестват измерими разлики в телесното тегло и основната телесна температура при условия на околната среда, но са свързани с неуспех да се поддържа термична хомеостаза по време на остра студена атака. В същото време същото студено предизвикателство предизвика 17-кратно увеличение на експресията на Gpr3 в iBAT на WT мишки. По този начин GPR3 изглежда има ключова роля в термогенния отговор на iBAT и може да представлява нова терапевтична цел при свързаното с възрастта затлъстяване.
Въведение
Затлъстяването представлява голяма глобална тежест за здравеопазването, която вече не се ограничава до развитите страни. Неотдавнашен доклад изчислява, че почти една трета от младите и възрастните в цял свят са с наднормено тегло или затлъстяване 1 и тази част се очаква да продължи да нараства в резултат на застаряващото общество 2,3,4,5,6. До 2050 г. броят на възрастните в САЩ на възраст 65 и повече години се очаква да се удвои от 40,2 милиона на 88,5 милиона 7 .
Въпреки цялостния забележителен напредък в разбирането на биоенергийните пътища, въпросът защо стареенето предразполага към наддаване на тегло остава неадекватно разгледан. Наблюдавано е затлъстяване при възрастни или късно настъпване при мишки, при които липсва активационен фактор 8 на тромбоцитите, тип 3 аденилил циклаза 9, инсулинов рецептор в кафява мастна тъкан 10, при трансгенни мишки с ген на човешки ренинов ген или е експериментално индуциран при овариектомизирани млади женски плъхове 12 . Нарастването на теглото, свързано с възрастта, постоянно се асоциира с нарушена термогенеза поради програмирана загуба на функция на междускапуларната кафява мастна тъкан (iBAT) 8,13,14, която премества излишната енергия към висцерални и подкожни мастни депа за съхранение . И все пак зависимите от възрастта фактори, контролиращи функцията на iBAT, остават до голяма степен неизвестни.
GPR3 е сирак от клас А на суперсемейството на G протеин-свързан рецептор (GPCR), хомолог на клъстера, който включва GPR6 и GPR12, чиито естествени лиганди все още са неизвестни 16,17,18,19,20. Синтетична малка молекула наскоро беше идентифицирана като специфичен сурогатен агонист на човешки GPR3 21,22. GPR3 е силно експресиран в ооцити, където е свързан с поддържане на мейотичен арест на ооцити 23,24,25,26,27,28,29,30 и яйчникова недостатъчност 31,32,33. GPR3 също се изразява силно в мозъчните области, замесени в невродегенеративни заболявания 34,35. Възможната роля на GPR3 в метаболитните и стареещите ефекти, особено по отношение на наддаването на тегло, не е проучена. Нашият интерес към GPR3 първоначално беше обусловен от неговата хомология на последователността с два съществуващи канабиноидни рецептора 36, което го направи потенциален кандидат в нашето търсене на все още неидентифициран трети канабиноиден рецептор. Бяхме изненадани обаче да открием нов и неочакван фенотип, който даде нова посока на нашето изследване. Тук съобщаваме за неочаквана връзка между стареенето и затлъстяването чрез GPR3. Мишките, които нямат GPR3, показват затлъстяване с късно начало, свързано с намаляване на нивото на отделяне на протеин 1 в iBAT и термогенезата.
Резултати
По-старите мишки Gpr3 KO имат затлъстял фенотип
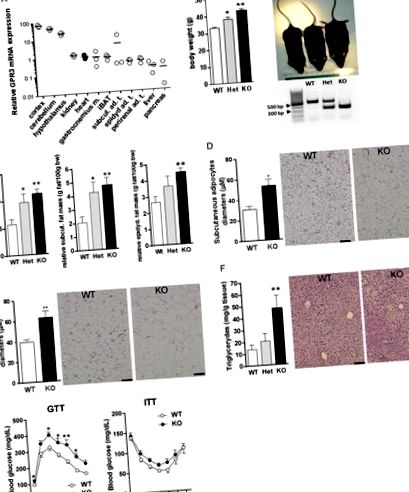
Gpr3 се изразява в няколко метаболитно активни периферни тъкани, макар и на по-ниски нива от тези в централната нервна система (ЦНС) (фиг. 1А) и неговата частична или пълна делеция води до специфични за генотипа промени в телесното тегло на по-възрастните (12-месечни ) мишки (фиг. 1В). По този начин, в продължение на една година, GPR3 хетерозиготни (Het) и нокаутиращи (KO) мишки, поддържани на редовна миша чау, печелят средно
30% по-голямо тегло, съответно, от техните съотборници на диви видове (WT) и визуално се различават един от друг (фиг. 1Б). Разликите в телесното тегло сред 12-месечните жени на GPR3 WT, Het и KO също са значителни, но по-малко забележими, отколкото при мъжете (съответно 27,31 ± 1,14 g, 27,39 ± 0,83 g и 30,93 ± 1,04 g; P Фигура 1
Фенотипни разлики сред GPR3 мишки.
Индексите на затлъстяване при по-стари GPR3 Het и KO мъжки мишки са се увеличили съответно 1,7 ± 0,3 пъти и 2,0 ± 0,1 пъти, в сравнение с WT котилата (фиг. 1С). Най-забележимите разлики са наблюдавани в подкожни (фиг. 1D) и епидидимни (фиг. 1Е) мастни депа, които представляват по-голямата част от затлъстяването и наддаването на тегло. В съгласие с появата на хистологични разрези, подкожните и епидидималните адипоцити са забележимо по-големи при 12-месечни мишки GPR3 KO, отколкото при съпоставени с възрастта WT кученца (фиг. 1С). Оцветяването на хематоксилин и еозин (H&E) на чернодробни секции от по-стари мишки GPR3 KO разкрива натрупване на мастни капчици, което е успоредно със значително увеличение на съдържанието на чернодробни триглицериди (фиг. 1С). Изненадващо, изтриването на GPR3 няма ефект върху серумните метаболитни маркери при 12-месечни мишки на гладно. Едно забележително изключение беше лептинът, чиято висока концентрация в GPR3 KO мишки директно корелира с повишеното им затлъстяване (Таблица 1). Също така, след гладуване през нощта, концентрацията на базална глюкоза в кръвта при по-възрастни мишки GPR3 KO е била значително по-висока, отколкото при техните сънародници в WT, а GPR3 KO показва значително увреждане на техния глюкозен толеранс (GTT; Фиг. 1G, ляв панел), както е отразено от по-висок Стойност на AUC, отколкото при аналозите на WT (съответно 353,63 ± 34,02 и 248,02 ± 11,64 часа x mg/dL, P Таблица 1 Серумни метаболитни маркери и концентрация на глюкоза в пълна кръв при 12-месечни мишки.
По-старите мишки GPR3 KO са намалили общия разход на енергия
Непряката калориметрия разкрива забележимо и трайно намаляване на общия енергиен разход при по-стари мишки GPR3 KO (TEE; фиг. 2А) без значителна промяна в дихателния им коефициент (RQ; фиг. 2В). Намаляването на TEE е свързано със съпътстващи спада на консумацията на кислород и производството на въглероден диоксид в групата GPR3 KO (Фигура S1). Приемът на храна също е бил по-нисък при GPR3 KO мишки, отколкото при техните WT поколения (фиг. 2C), докато, което е важно, амбулаторната активност остава сходна между генотиповете (фиг. 2D). Тези метаболитни разлики са сходни по време на светлата и тъмната фази (фиг. 2, десни панели) и са в хармония с фенотипа със затлъстяване.
Метаболитни профили на по-стари GPR3 мишки, анализирани с помощта на индиректна калориметрия.
GPR3 KO мишките показват фенотип със затлъстяване със закъснение
За да изследваме временната динамика на фенотипа GPR3 KO, проследихме телесното тегло на стандартни мишки, хранени с чау в продължение на до 18 месеца. Както е показано на Фиг. 3А, телесното тегло не се различава между WT и GPR3 KO мишките през първите 5 месеца от живота, но GPR3 KO мишките натрупват значително повече тегло след това. На възраст от 5 месеца и двете групи имат сходни стойности на TEE, RQ, прием на храна и амбулаторна активност (Фиг. 3B – E). Те също имат сходно съдържание на фекални триглицериди (Фигура S2), което предполага сравними способности за абсорбция на червата. С напредването на възрастта на животните мишките GPR3 KO започнаха да наддават значително повече тегло. За да разберем по-добре защо GPR3 KO мишките развиват затлъстяване по-късно в живота, проведохме допълнителни проучвания върху 5-месечни (възрастни) животни, тъй като това беше най-късният момент преди фенотипът на затлъстяването да стане очевиден.
Мишките GPR3 KO показват фенотип със затлъстяване със късно начало с непроменен метаболитен профил до зряла възраст.
Възрастните мишки GPR3 KO имат нарушено усвояване на глюкоза в iBAT
Първо направихме експерименти с хиперинсулинемична евгликемична скоба, за да изследваме тъканно специфични разлики в усвояването на глюкоза при 5-месечни мишки. На тази възраст животните с WT и GPR3 KO все още имат сходни телесни тегла (съответно 31,55 ± 1,02 g и 31,06 ± 1,15 g; n = 6–7). Основни нива на глюкоза в кръвта преди фиксация (фиг. 4А), скорости на инфузия на глюкоза (GIR) и нива на глюкоза в кръвта по време на фиксиране (фиг. 4А – В), клирънс на глюкозата в цялото тяло (Rd; фиг. 4С) и инсулиново индуцирано потискане на производството на чернодробна глюкоза (hGP; Фиг. 4D) също са сходни при възрастни GPR3 генотипове. И все пак, имаше някои видими разлики между WT и GPR3 KO мишките в усвояването на глюкоза в отделни тъкани (Фиг. 4Е). Особено забележително е двукратното по-ниско поглъщане на глюкоза в iBAT на GPR3 KO мишки в сравнение с техните WT аналози. За разлика от това, усвояването на глюкоза е значително по-високо в епидидималната мастна тъкан на мишките GPR3 KO, докато остава сходно между групите в подкожната и периреналната мазнини, черния дроб и гастрокнемичния мускул и в хипоталамуса (фиг. 4Е).
Гликемичен контрол при възрастни GPR3 мишки.
Молекулярните промени в iBAT на възрастни мишки GPR3 KO предшестват намаляването на основната телесна температура на по-възрастните мишки
Не наблюдавахме съществени разлики в основната телесна температура през първите 5 месеца от живота, въпреки че телесната температура имаше тенденция да намалява по-бързо с времето при GPR3 KO, отколкото при WT мишки. Когато животните достигнат 12-месечна възраст, телесната температура е била значително по-ниска при GPR3 KO, отколкото при WT мишки и е останала по-ниска 6 месеца по-късно (Фиг. 5А). Това беше придружено от по-ниски нива на iBAT норепинефрин и по-ниски серумни тироксин (Т4), но не и концентрации на трийодтиронин (Т3) и тиреостимулиращ хормон (TSH) при 12-месечни мишки GPR3 KO (Фигура S3). Понижаването на експресията на гена Gpr3 също се забелязва при 12-месечни WT мишки (фиг. 5В).
Термогенни характеристики на възрастни мишки GPR3.
На 5-месечна възраст мишките GPR3 KO и WT са имали сравними нива на норепинефрин в тъканите и серумни концентрации на T3, T4 и TSH (Фигура S3). И все пак, въпреки нормалната телесна температура в покой, iBAT при възрастни GPR3 KO мишки вече показва някои молекулярни промени, които са в хармония и предсказват загубата на термогенна функция в по-късна възраст. Мишки без GPR3 са имали значително по-ниска базална експресия на несвързан протеин 1 (UCP1), активиран от пероксизома пролифератор рецептор-γ коактиватор 1 алфа (PGC1α) и тип 2 йодотиронин дейодиназа (Dio2), без промяна в гените, кодиращи адренергични рецептори, глюкозни транспортери, синтаза на мастни киселини или стеароил-КоА десатураза (фиг. 5С). Както се доказва от Western blot, iBAT на GPR3 KO мишки също имаше значително намалено съдържание на UCP1 без разлика в нивото на протеин на субединица II на цитохром с оксидаза (MTCO2). Това наблюдение беше допълнително подкрепено от тяхната по-ниска интензивност на маркиране на флуоресценция на UCP1 на iBAT секции (Фиг. 5D).
За да проверим дали намаленият UCP1 протеин в iBAT има физиологично въздействие върху възрастни мишки GPR3 KO, временно ги поставихме в студена среда (4 ˚C) и изследвахме способността да защитават основната им телесна температура след остро излагане на студ. Както е показано на фиг. 5Е, WT мишките са успели успешно да поддържат своята физиологична температура в студени камери по време на експеримента. За разлика от това, въпреки че имат нормална основна телесна температура при околна среда, сравними нива на iBAT норепинефрин и серумни маркери на функцията на щитовидната жлеза между групите по време на излагане на студ (Фигура S4), 5-месечните мишки GPR3 KO показват нарушена толерантност към студ което се проявяваше с прогресивно намаляване на основните им телесни температури по време на студеното предизвикателство. В края на студената сесия телесната температура при мишките GPR3 KO беше по-ниска със средно 0,9 ° C, отколкото при групата WT, докато телесната температура на възрастните мишки GPR3 KO веднага се върна към нивата преди експозицията, след като животните бяха прехвърлени в техните домашни клетки при условия на околната среда (фиг. 5D).
Острото излагане на студ оказа силно влияние върху GPR3 експресия на иРНК в iBAT на WT мишки, която се е увеличила 17 пъти спрямо нивото в околните условия (фиг. 5Е). За разлика от тях, изразът на Gpr6 и Gpr12 остана непроменен (Фигура S5), докато промените в други гени, които представляват интерес по време на студеното предизвикателство, бяха доста скромни и следваха същия модел и в двете групи. Едно забележително изключение беше по-високото, евентуално компенсаторно увеличение на Dio2 генна експресия в GPR3 KO спрямо тази при WT мишки (Фигура S6).
Горните резултати показват, че 5-месечните мишки GPR3 KO, като същевременно поддържат нормални температури на сърцевината при околни условия, са компрометирани в способността си да защитават термичната хомеостаза по време на студеното предизвикателство.
Дискусия
Стареенето е неразривно свързано с метаболитни промени, които предразполагат човек към затлъстяване и свързани патологии. Въпреки припокриващите се сигнални пътища, факторите, които свързват стареенето със затлъстяването, остават до голяма степен неизвестни.
В настоящото проучване ние изследвахме ефектите от аблация на сираци GPR3 върху енергийния метаболизъм при мишки. Този рецептор преди е бил замесен в преждевременно стареене на яйчниците 31,32,33 и невродегенеративни нарушения 34,35, като и двете са свързани с възрастта патологии. Тук за първи път съобщаваме, че мъжките мишки без GPR3 показват затлъстяване със късно начало, когато се поддържат на редовна чау диета. Телесното тегло и метаболитните профили не се различават сред мъжките GPR3 KO и WT групи през първите 5 месеца от живота, след което телесното тегло се увеличава систематично и по специфичен за генотипа начин, така че до 12-месечна възраст GPR3 KO мишките са значително по-тежки от техните сънародници в WT, поради значително по-висок индекс на затлъстяване и свързани с нарушена термогенеза. Ефект на дозиране на гена е очевиден и при междинния фенотип на хетерозиготни животни. Женските мишки GPR3 KO са наддали значително по-малко тегло от мъжете, което показва, че преждевременното стареене на яйчниците е малко вероятно да бъде отговорно за фенотипа със затлъстяване и ако изобщо може да ограничи експресията на този фенотип при женски мишки.
Въпреки наднорменото тегло, метаболитният профил на 12-месечни мишки GPR3 KO не показва класически системни характеристики на метаболитния синдром. Аблацията на GPR3 не причинява системна хипергликемия, хиперинсулинемия, дислипидемия, увреждане на черния дроб или промяна на основните метаболитни маркери при условия на гладуване. Както се отразява от тестовете GTT и ITT, 12-месечните мишки GPR3 KO са непоносими към глюкоза, но остават чувствителни към инсулин, съвместими със състояние на по-ниско използване на енергия.
В заключение, както е обобщено на фиг. 6, настоящите открития установяват връзка между свързаните с възрастта промени в термогенезата и наддаването на тегло чрез рецептора сирак GPR3. Мишките, които нямат GPR3, показват закъснял фенотип със затлъстяване поради нарушена термогенна функция на iBAT. Следователно GPR3 може да служи като нова фармакологична цел при разработването на подходяща терапевтична интервенция за лечение на затлъстяване при застаряващото население.
Обобщение на промените в фенотипа при мишки с дефицит на GPR3.
- Нова функция за мишки с дефицит от стария ензим NEP развиват затлъстяване със закъснение
- Структурни и функционални промени в бъбреците на индуцирани с високо съдържание на мазнини диети, затлъстели мишки, американски
- PRIME PubMed Kefir предотвратява натрупването на излишни мазнини при индуцирани от диета затлъстели мишки
- Предоперативна ендоскопия на горната част на стомашно-чревния тракт при пациенти със затлъстяване, подложени на бариатрична хирургия
- Признаци на затлъстели морски свинчета