Лизинът играе важна роля в усвояването и използването на протеини, хранителния баланс, подобряването на функцията на нервната система, подобряването на функцията на имунната система, предотвратяването на остеопороза и други системи (Behr-Roussel et al., 2000).
Свързани термини:
- Аминокиселина
- Ензим
- Пептид
- Протеин
- ДНК
- Аргинин
- Хистон
- Хистон Н3
- Ацетилиране
- Метилиране
Изтеглете като PDF
За тази страница
Мутации в хистонов лизин метилтрансферази и деметилази
Сара Уейрих, Алберт Йелч, в Енциклопедия на рака (трето издание), 2019
Резюме
Мезилирането на лизин е важна посттранслационна модификация на хистонови и нехистонови протеини с ключова роля в канцерогенезата. Напоследък при различни тумори са идентифицирани повтарящи се соматични мутации в протеин лизин метилтрансферази (ПКМТ) и лизин деметилази (KDM). Тези мутации могат да причинят загуба на функция и ефекти на печалба от функцията, когато мутацията променя критичните ензимни свойства или взаимодействието с регулаторните протеини. Тук описваме ролите на избрани ПКМТ и КДМ при рак, като се фокусираме върху ефектите от соматични мутации на рак. Изследването на ефекта на соматичните мутации на рака помага да се разбере ролята на ПКМТ и KDM в канцерогенезата и да се разработят индивидуални терапии за рак.
Херпес симплекс вирус
Марет Роси, д-р Брадли Джейкъбс, MPH, ABOIM, по интегративна медицина (четвърто издание), 2018 г.
Хранене
Лизин и аргинин
Лизинът е основна аминокиселина, която не се произвежда естествено от организма. Много клинични изпитвания съобщават, че богатите на лизин диети и лизиновите добавки намаляват рецидивите, тежестта и периода на зарастване на вирусите на херпес симплекс. Обратно, изглежда, че аргининът е антагонист на лизина. Griffith et al. демонстрира в проучване in vitro, че вирусът на херпес симплекс използва аргинин за репликация. 25 Miller et al. наблюдава, че лизинът се конкурира с аргинин за чревна абсорбция, транспорт до клетки и реабсорбция в бъбречните каналчета и разгражда аргинина чрез активиране на аргиназата. 26,27 Следователно се препоръчва да се избягват храни, богати на аргинин, като ядки, зърнени храни, шоколад и рафинирани захари и увеличен прием на богата на лизин диета от месо, риба и млечни продукти. 28 Съотношението аргинин и лизин на избрани храни е представено под 30 (вж. Таблица 20.2 за хранителни съображения при херпес симплекс инфекция).
Синтез на аминокиселини ☆
Лизин
Синтезът на лизин започва с кондензация на аспартатен полуалдехид и пируват, за да се образува цикличен междинен продукт, който се редуцира с NADPH, за да се образува тетрахидродипиколинат ( Фигура 5, втори ред). В Е. coli тетрахидродипиколинатът се сукцинилира от сукцинил-CoA, азотът се добавя чрез глутамат-зависимо трансаминиране и блокиращата група се отстранява, за да се получи LL-диаминопимелат. Епимеразата превръща LL-диаминопимелат в мезо-диаминопимелат, който се декарбоксилира, за да образува лизин. При някои организми тетрахидродипиколинатът се превръща директно в мезо-диаминопимелат, а при грам-положителните организми блокиращият агент е ацетилова група. Единствената известна трансаминаза е и четвъртият ензим на синтеза на аргинин. Делецията на гена за този ензим няма ефект върху растежа, което предполага излишни ензими за трансаминазната реакция.
Регулирането на синтеза на лизин е сложно, което е подходящо предвид броя на важните междинни съединения, които се синтезират. Лизинът кинетично контролира аспартокиназа III и първата осъществена реакция на синтез на лизин - кондензацията на пируват с аспарагинов полуалдехид. Гените на лизин-специфичния път не са свързани. ArgP активира транскрипцията на пет от деветте ензима, които превръщат аспартата в лизин, а лизинът предотвратява това активиране. LysR, комплексиран с диаминопимелат, активира транскрипцията на диаминопимелат декарбоксилаза, която е последният ензим по пътя. Диаминопимелатното гладуване регулира първата извършена стъпка на синтез на лизин по неизвестен механизъм.
Рак, имунология и възпаление и инфекциозна болест
5.08.2.6.1 Лизин деметилази
Метиловите следи от лизин се отстраняват от семейството на лизин деметилазата (KDM) ензими по зависим от последователността начин. KDM са разделени на две подсемейства, лизин-специфичните деметилази (LSD1/KDM1) и Jumonji C (JmjC) -домейн-съдържащите деметилази (KDMs2–7). Лизин-специфичната деметилазна фамилия от ензими е зависима от флавин, докато ензимите, съдържащи JmjC домейн, зависят от Fe (II) и 2-оксоглутарат. Съобщава се, че съдържащият домейн 6 на Jumonji 6 (JmjD6) има активност на деметилиране на аргинин; тази дейност обаче е предмет на противоречиви доклади. 7 Понастоящем има три KDM1 инхибитори в процес на клинични изпитвания ( маса 1 ).
Маса 1 . Обобщение на одобрените епигенетични регулатори и в клинични изпитвания
| Белиностат | HDAC/пан-HDAC | Одобрена | Периферен Т-клетъчен лимфом |
| Панобиностат | HDAC/пан-HDAC | Одобрена | Множествена миелома |
| Прациностат | HDAC/клас I, II, IV | Одобрена | AML, Т-клетъчен лимфом |
| Ромидепсин | HDACS, зависим от HDAC/Zn | Одобрена | Кожен Т-клетъчен лимфом |
| Вориностат | HDAC/пан-HDAC | Одобрена | Кожен Т-клетъчен лимфом |
| Ентиностат | HDAC/клас I, III | Фаза II/III | Множество ракови заболявания |
| Гивиностат | HDAC/клас I, II | Фаза II | |
| Моцетиностат | HDAC/пан-HDAC | Фаза II | Лимфом, левкемия |
| Квизиностат | HDAC/пан-HDAC | Фаза II | Левкемия, MLL, лимфом, солидни злокачествени заболявания |
| Ресминостат | HDAC | Фаза II | HCC |
| Тацединалин | HDAC/HDAC1, HDAC2 | Фаза II | Множествена миелома |
| Tazemetostat | HMT/EZH2 | Фаза II | Лимфом, солидни тумори |
| Валпроева киселина | HDAC/пан-HDAC | Фаза II | Множество ракови заболявания |
| ACY-1215 | HDAC/HDAC6 | Фаза I/II | Множествена миелома |
| AR-42 | HDAC/пан-HDAC | Фаза I/II | MLL, лимфом, левкемия |
| ORY-1001 | KDM/KDM1A | Фаза I/II | AML |
| OTX015 | Bromodomain/BET | Фаза I/II | Глиобластом |
| Транилципромин | KDM/KDM1A | Фаза I/II | AML |
| ABBV-075 | Bromodomain | Фаза I | Разширени ракови заболявания |
| Абексиностат | HDAC/пан-HDAC | Фаза I | В-клетъчен лимфом |
| БЕЙ-1238097 | Bromodomain/BET | Фаза I | Новообразувания |
| BMS-986158 | Bromodomain/BET | Фаза I | Солидни тумори |
| CPI-0610 | Bromodomain/BET | Фаза I | Лимфом |
| CPI-1205 | HMT/EZH2 | Фаза I | В-клетъчен лимфом |
| CUDC-907 | HDAC/клас I, IIB | Фаза I | Лимфом, множествен миелом, солидни тумори |
| GSK525762 | Bromodomain/BDR4 | Фаза 1 | Хематологично злокачествено заболяване, карцином на средната линия на NUT |
| GSK2816126 | HMT/EZH2 | Фаза I | В-клетъчен лимфом, фоликуларен лимфом |
| GSK2879552 | KDM/KDM1A | Фаза I | AML |
| Pinometostat | HMT/DOT1L | Фаза I | Левкемия |
| TEN-010 | Bromodomain/BET | Фаза I | ОМЛ и солидни тумори |
ФЕРМЕНТАЦИЯ (ПРОМИШЛЕНА) | Производство на аминокиселини
Производство на l-лизин
Лизинът представлява най-бързо растящият аминокиселинен сегмент. По-голямата част от зърнените храни, консумирани в света, имат недостиг на аминокиселината, l-лизин. Това е съществена съставка за растежа на животните и е важна част от промишлеността за фураж за милиарди долари. Добавката на лизин превръща зърнените култури в балансирана храна или фураж за животни, включително птици, свине и други животни. В допълнение към храната за животни, лизинът се използва във фармацевтични продукти, хранителни добавки и козметика. Смята се, че глобалният пазар на l-лизин се е увеличил почти 20 пъти през последните 20 години и няколко компании като Ajinomoto Co. Inc. и Archer Daniels Midland Co. в момента разширяват своите мощности със силни инвестиции в Бразилия, Китай и Съединените щати.
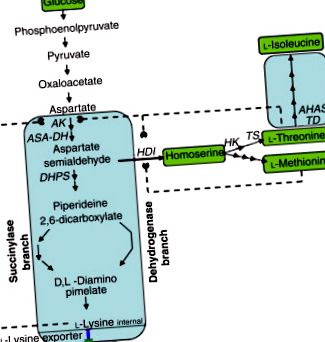
Фигура 2. Биосинтетичен път към l-лизин, l -треонин и l-изолевцин в C. glutamicum. АК, аспартатни кинази; ASA-DH, аспартат-полуалдехид дехидрогеназа; HDI, хомосерин дехидрогеназа; HK, хомосерин киназа; TS, треонин синтетаза; TD, треонин дехидратаза; AHAS, синтаза на ацетохидрокси киселина.
Много работа е свършена за ауксотрофни и регулаторни мутанти на свръхпродуциращи щамове глутамат за производството на лизин. Чрез генетично отстраняване на хомосерин дехидрогеназа (HDI), произвеждащият глутамат щам Corynebacterium от див тип се превръща в мутант, свръхпродуциращ лизин, който не може да расте, освен ако в средата не се добавят метионин и треонин. Докато добавката треонин се поддържа ниска, вътреклетъчната концентрация на треонин е ограничаваща и инхибирането на АК с обратна връзка се заобикаля, което води до екскреция на над 70 g l -1 лизин в културни течности. При някои щамове добавянето на метионин и изолевцин към средата води до увеличаване на свръхпроизводството на лизин. Изборът за устойчивост на S-2-аминоетилцистеин (AEC; тиализин) блокира инхибирането на обратната връзка на АК. Други антиметаболити, полезни за дерегулация на АК, включват смес от а-кетобутират и аспартат хидроксамат. Левцин ауксотрофията може да увеличи производството на лизин. Известно е, че титрите на l-лизин достигат до 170 g l -1 .
Екскрецията на лизин от C. glutamicum се осъществява чрез активен транспорт, достигащ концентрация от няколко 100 mM във външната среда. Лизинът, катион, трябва да се екскретира срещу градиента на мембранния потенциал (отвън е положителен) и екскрецията е медиирана от носител. Системата зависи от движещата сила на електрона, а не от аденозин трифосфат.
Възстановяването на щам на базата на генома се използва за подобряване на скоростта на производство на лизин на C. glutamicum чрез сравняване на високопродуктивен щам (скорост на производство малко по-малко от 2 g l −1 h −1) и щам от див тип. Сравнението на 16 гена от производствения щам, кодиращи ензимите на пътя от глюкоза до лизин, разкри мутации в пет от гените. Въвеждането на три от тези мутации (hom, lysC и pyc, кодиращи съответно HDI, AK и пируват карбоксилаза) в дивия тип създаде нов щам, който произвежда 80 gl -1 за 27 часа, при скорост 3 gl -1 h −1. Допълнително увеличение (15%) в производството на 1-лизин се наблюдава чрез въвеждането на мутация в гена на 6-фосфоглюконат дехидрогеназа (gnd). Ензимният анализ разкрива, че мутантният ензим е по-малко чувствителен от ензима от див тип към алостерично инхибиране от вътреклетъчни метаболити. Анализът на метаболитния поток, основан на изотопи, демонстрира, че мутацията на gnd води до 8% увеличение на въглеродния поток през пентозофосфатния път по време на производството на l-лизин. И накрая, чрез въвеждане на мутацията на mqo (малат: хинон оксидоредуктаза), беше възможно да се увеличи както скоростта на производство, така и титърът на l-лизин до 95 g l -1 чрез периодично хранена култура.
С използването на системно метаболитно инженерство, 12 дефинирани геном-базирани промени в гени, кодиращи централни метаболитни ензими, пренасочват основните въглеродни потоци по желание към оптималното използване на l-лизиновия път, прогнозирано чрез силико моделиране. Проектираният щам C. glutamicum успя да произведе лизин с висок добив от .55 g на грам глюкоза, титър от 120 g L -1 лизин и производителност от 4.0 g l -1 ч h -1 в култура, хранена на партиди.
Възникващи епигенетични терапии - бромодомен лиганди
Дейвид С. Хюингс,. Stuart J. Conway, в Epigenetic Cancer Therapy, 2015
Известно е, че ацетилирането на лизин играе важна роля в процеси, свързани с рака. Следователно, има голям интерес към разработването на инхибитори на ензимите, които добавят ацетилова група към ε-азотния атом на лизин, лизин/хистон ацетилтрансферази и ензимите, които премахват тези групи, лизин/хистон деацетилази. Бромодомените са протеинови модули, които се свързват с („разпознават“) N-ε-ацетил-1-лизин (ацетил лизин) и улесняват сглобяването на мултипротеинови скелета чрез посредничество между протеин-протеинови взаимодействия. Едва сравнително наскоро бромодомените се разглеждат като терапевтично важни цели, но последващият напредък в развитието на подобни на лекарството бромодомен лиганди е бърз. Тук е описан напредъкът в развитието на BET (бромодомен и екстратерминални) бромодомен лиганди и тяхното приложение в биологични системи, които са от значение за рака. В допълнение се обсъжда напредъкът в идентифицирането на не-BET бромодомен лиганди.
Кофактори
7.19.4.2.1 Биосинтез LTQ
Схема 7. Механизъм на биосинтеза на LTQ.
Синтетични методи VI - ензимни и полу-ензимни
7.12.2.1 l -AAO
l - Лизин оксидазата (EC 1.4.3.14) катализира окисляването на ω-амино групата на l-лизин. Този ензим е използван в система с два ензима с едно гърне за синтеза на няколко неестествени циклични аминокиселини от съответните линейни прекурсори. 15 l-лизин оксидаза (алтернативно l - или d -AAO също може да се използва в този етап) първоначално се използва за превръщане на диаминокиселината 1 в съответната а-кето аминокиселина 2, който претърпява спонтанна циклизация in situ до иминокиселината 3 (Фигура 2). Добавянето на втори ензим, а именно N-метил-1-аминокиселинна дехидрогеназа (NMAADH), доведе до намаляване на имина, за да се получи цикличната аминокиселина 4 с добър добив и с отлична оптична чистота. Цялостен процес на дерацемизация също се провежда, като се използват рацемични аналози на 1 като изходен материал във връзка с d -AAO и NMAADH.
Фигура 2. Използване на 1-лизин оксидаза в комбинация с N-метиламинокиселина дехидрогеназа за превръщането на (R)-1 в циклична аминокиселина (R)-4.
Ензимът лизин циклодеаминаза, който катализира окислителната циклизация на l-лизин до l-пипеколова киселина, е идентифициран в генния клъстер на рапамицин. Клонирането на гена и последващото свръхекспресия и пречистване на ензима (Фигура 3) дават биокатализатор, който е в състояние да конвертира l-лизин 5 в l-пипеколова киселина 6. Въпреки това, ензимът показва много по-ниска активност към 1 -орнитин от 1-лизин (13 тМ -1 мин -1) и d-лизин не е активен. Механизмът на ензима беше изследван чрез изследване на изискванията за ензимен кофактор и маркиране на изотопния субстрат. 16.
Фигура 3. Превръщане на l-лизин 5 в l-пипеколова киселина 6 като се използва лизин циклодеаминаза, получена от Streptomyces hygroscopicus.