Резюме
Заден план
Изпитванията за заразност и тестването на токсичност при гризачи са важни предпоставки за използването на съединения при човека. Опитите при плъхове и мишки обаче са скъпи и има етични съображения. Galleria mellonella (по-голям восъчен молец) ларвите са потенциална алтернатива. Оценихме използването на тези насекоми при изпитвания за заразност и тестове за токсичност.
Констатации
Използвайки четири бактериални вида (два Грам-отрицателни и два Грам-положителни), ние оценихме ефикасността на четири антибиотици срещу инфекции в Galleria и сравнихме антибиотичната чувствителност с тази при хората. Като цяло намираме добра корелация. По същия начин ние оценихме 11 съединения (първоначално тествани сляпо) за тяхната токсичност в Galleria и сравнихме това с опити за токсичност при мишки и плъхове. Отново открихме добра връзка между токсичността в Galleria и тази при гризачите.
Заключение
В нашите ръце открихме това G. mellonella ларвите могат да се използват в опити за заразност и тестване на токсичност и че тези анализи представляват евтина и лесно изпълнима алтернатива на изпитването при гризачи.
Заден план
6 седмици) на ниска цена и без необходимост от специализирано оборудване; освен това те обикновено не са обект на етични съображения. Ларвите на Galleria са големи, достигайки 250-300 mm дължина на петия етап, достатъчно за интраперитонеално инжектиране на тествани съединения. Освен това имунната система на насекомите е функционално и структурно подобна на вродената имунна система на бозайниците [7, 8].
Galleria mellonella ларвите са използвани за първи път за оценка на антибиотичната ефективност срещу Acinetobacter baumannii [9]. Цефотаксим, тетрациклин, гентамицин и меропенем бяха изследвани срещу системно A. baumannii инфекция. Гентамицин и меропенем, които A. baumannii е податлив на, значително удължава оцеляването на заразените ларви, докато оцеляването на заразените, но нелекувани ларви и ларви, третирани с цефотаксим и тетрациклин, на които бактериите са устойчиви, е по-малко от 25% за 5 дни. Моделът бързо спечели интерес с редица академични групи, които го използваха като стандартен модел за тестване. G. mellonella ларвите са използвани за изследване на нововъзникващи патогени [10] и нови лечения за персистиращи патогени [3].
Целта на настоящата работа беше да се оцени ефективността на G. mellonella при изпитвания за чувствителност към антибиотици и да се изследва дали те също могат да бъдат рутинно използвани при тестове за остра токсичност. По-конкретно, за изпитванията за ефикасност на антибиотиците искахме да установим дали терапевтичните дози, установени в ларвите на восъчния молец, корелират с дозите, препоръчани за хуманна употреба, а за тестването на токсичността искахме да определим дали LD50 стойностите, установени за ларвите на восъчен молец, съответстват на стойностите установени при гризачи.
Методи
Бактериални щамове и среди
Избрахме два Грам-положителни и два Грам-отрицателни бактериални щама, които са от клинично значение за тези проучвания; това бяха: Ешерихия коли (ATCC 25922), Mycobacterium smegmatis (ATCC 700084), Pseudomonas aeruginosa (ATCC 15692) и Стафилококус ауреус (ATCC 29213) и са получени от колекцията култури на Агенцията за защита на здравето (Public Health England, Porton Down, UK). Те бяха култивирани от глицеринови запаси и държани на подходяща среда върху агарови плочи [среда Middlebrook (BD Difco 7H9) за М. смегматис, LB (LMM0202, Formedium) за всички останали] преди растеж в LB бульон аеробно при 37 ° C. Културите бяха субкултивирани поне два пъти, преди да бъдат използвани в анализите.
Съединения
Ампицилин, ципрофлоксацин, рифампицин и тетрациклин за тестване на антибиотичната ефикасност са получени от Sigma Chemicals. За тестване на токсичността на съединения, доставени от Inspiralis Ltd., източници бяха: ципрофлоксацин (Fluka), етопозид, новобиоцин, амсакрин, NaCl, тетрациклин, DMSO, хлорохин, стрептомицин и ATP (Sigma), хлорамфеникол (Duchea Biochemie), доксорубимицин и глюкоза (Fisher Chemicals) (Таблица 1). Поради проблеми с неразтворимостта, амсакринът се доставя с 8 mg/ml в 50% DMSO във вода; доксурубицин се доставя с 5,5 mg/ml в 50% DMSO във вода. За изпитвания за токсичност първоначално всички съединения бяха предоставени в номерирани епруветки без имена на съединения, за да се избегне отклонение. Идентичността на съединенията беше разкрита едва когато процедурата за тестване приключи и данните от G. mellonella беше сравнен с наличните със съединенията страници с данни за безопасност на материалите (MSDS).
Отглеждане на насекоми
Колония от G. mellonella е получена от Центъра за ентомология на Джон Инс (първоначално произведена от Livefood UK Ltd.). Колонията се държи на тъмно при 37 ° C в големи чаши на Петри (140 mm, стерилин), пълни с изкуствена храна. Изкуствената храна се състои от 300 ml мед (Sainsbury's Honey, Clear), 400 ml глицерол (G5516, Sigma Chemicals), 200 g мляко на прах (сушено обезмаслено мляко на прах, Marvel), 200 g пълнозърнесто брашно (Strong Stoneground 100% пълнозърнесто брашно, Sainsbury's), 100 g дрожди на прах (103753, Merck), 100 g пшеничен зародиш (Neal's Yard Wholefoods Natural Wheatgerm) и 400 g трици (Neal's Yard Wholefoods Natural Wheat Bran). Първо сухите и мокрите съставки се смесват отделно и след това смесите се комбинират. Диетата се смесва с гранули от пчелен восък в съотношение 2: 1. Неизползваната храна се съхранява при 4 ° C. Храната се подменяла поне веднъж седмично, освен ако не се оставяло достатъчно, за да се хранят ларвите, като в този случай в контейнерите се добавяли повече храна.
G. mellonella инжекционна процедура
Пет до десет ларви (по 250–320 mg всяка) бяха избрани на случаен принцип за всяка стъпка от процедурата. Всички ларви с потъмняване на кутикулата бяха изхвърлени. Тестваните съединения се инжектират в хемокоела в DMSO или PBS буфер през последния ляв пролег (спринцовка Hamilton 701N, обем 10 μl, размер на иглата 26 s, конусен връх) [10], освен ако не е посочено друго. Ларвите бяха поставени върху медицински тъкани (Kimtech), за да спрат изтичането на хемолимфата. Ларвите се инкубират на тъмно в продължение на 5 дни и смъртността се отчита ежедневно.
Определяне на инфекциозната доза бактерии
Инфекциозната доза бактерии беше определена чрез инжектиране на групи от пет ларви с бактериална суспензия при: 5 × 10 4 колониеобразуващи единици (cfu) на инжекция, 5 × 10 5 cfu, 5 × 10 6 cfu и 5 × 10 7 cfu. Ларвите се инкубират в продължение на 5 дни. Инфекциозната доза се определя като такава, която причинява имунен отговор, разпознаваем по потъмняването на кутикулата [10]. В G. mellonella имунният отговор на ларвите води до образуването на меланинови плаки около бактериите, имобилизирани от клетките на имунната система. Тези плаки изглеждат тъмни през кутикулата. Инфекциозна доза бактерии е тази, която причинява 60–80% леталност в рамките на 48 часа, но не и 100% леталност в рамките на 24 часа. Ларвите са инкубирани при 37 ° C, тъй като бактериалната вирулентност се променя с температурата и експериментът е предназначен да имитира инфекция при хора.
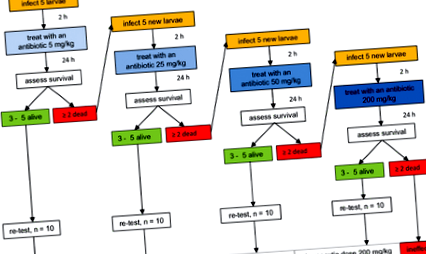
Тестване на антибиотична ефикасност
Блок-схема, представляваща последователни стъпки в теста за ефикасност на антибиотика. Прилага се начална доза от 5 mg/kg телесно тегло и насекомите се оценяват за оцеляване. Ако смъртността е под 40%, на съединението се определя най-ниската терапевтична доза. Ако смъртността е над 40%, се тества по-висока доза, докато се установи терапевтична доза
Процедура за изпитване на токсичност
Блок-схема, представляваща последователни стъпки в теста за остра токсичност. Прилага се начална доза от 5 mg/kg телесно тегло и насекомите се оценяват за смъртност. Ако смъртността е над 40%, на съединението е определен най-високият клас на токсичност. Ако смъртността е под 40%, дозата се тества отново и тестването продължава, докато се установи токсична доза
Резултати и дискусия
Уча дизайн
И изпитванията за ефикасност на антибиотиците, и тестовете за токсичност се основават на насоките на OECD за тестване на токсичност при мишки и плъхове [15]. Насоките са адаптирани за употреба с G. mellonella тъй като те са статистически стабилен метод и позволяват рационализиран работен поток с ясна начална и крайна точка.
Антибиотична ефикасност
Първоначално беше определена подходящата инфекциозна доза бактерии за всеки бактериален вид. Инфекциозна доза е тази, която причинява имунен отговор, наблюдаван като потъмняване на кутикулата и 60–80% леталност в рамките на 48 часа, но не и 100% леталност в рамките на 24 часа. Това беше определено като 5 × 10 6 cfu в 10 µl за Е. coli, М. смегматис и S. aureus, и 5 × 10 4 cfu в 10 µl за P. aeruginosa.
Ефикасността на четири антибиотика: ампицилин, ципрофлоксацин, тетрациклин и рифампицин, в G. mellonella ларвите бяха оценени спрямо четири бактериални патогена: Грам-положителни М. смегматис и S. aureus, и Грам-отрицателни Е. coli и P. aeruginosa. За всеки бактериален щам имаше поне един антибиотик, който е показан при лечението на инфекция, причинена от този щам, и поне един, за който се прогнозира, че няма да изчисти инфекцията, за да потвърди, че антибиотичното действие, а не имунитетът на насекомите, е отговорен за възстановяване.
Тестовете за ефикасност на антибиотиците бяха проведени, както е описано в раздел „Методи“. Терапевтичната доза на антибиотик беше определена, когато антибиотикът спаси смъртността, причинена от бактериалната инфекция. Когато дори най-високата доза от антибиотика не изчиства инфекцията, антибиотикът се счита за неефективен срещу тези бактерии. Резултатите са обобщени в таблица 2. Има четири възможни резултата от теста за антибиотик: „(1) прогнозна доза от антибиотик изчиства бактериална инфекция, (2) доза, различна от предвидената доза, изчиства инфекция, (3) антибиотик прогнозиран за неефективен е неефективен, (4) антибиотикът, предвиден за неефективен, изчиства бактериалната инфекция. В повечето случаи антибиотиците се извършват приблизително както е предсказано, или лечение на инфекция в рамките на предвидената доза, или неефективност срещу устойчив щам.
Тези проучвания за ефикасност на антибиотиците се основават на съществуваща литература [2]. G. mellonella ларвите са били използвани преди това за изследване на бактериална вирулентност и податливост към антибиотици и нашето проучване потвърди, че ларвите са подходящ гостоприемник за проучвания за ефективност на антибиотиците. Освен това установихме, че антибиотичната терапевтична доза, установена през G. mellonella често съвпада с дозите, препоръчани за употреба при хора.
Нашите експерименти подкрепят предложението, че може да се направи тестване за антибиотична ефикасност G. mellonella и терапевтичните дози, препоръчани за хуманна употреба, могат да бъдат превърнати в дози в ларвите на восъчния молец. В повечето случаи точната доза, препоръчана за клинично лечение на системна инфекция, може да бъде изчислена за телесното тегло на ларвите и може да изчисти инфекцията. Такава корелация е възможна, тъй като често механизмите на микробната вирулентност не са специфични за гостоприемника. Там, където прогнозите не съвпадат с резултатите, има различни потенциални обяснения, напр. разлики в имунните отговори при различни организми и др. Предишни проучвания показват, че гъбичният патоген Candida albicans използва същия репертоар от ефектори, участващи в гъбична вирулентност и преход от дрожди към хифа, срещу насекоми и бозайници [4]. По същия начин бактериалният патоген P. aeruginosa използва подобен набор от вирулентни гени за преодоляване на имунната система на ларвите и мишките на восъчен молец [6] и ларвите могат да бъдат използвани за идентифициране на фактори на вирулентност, необходими за инфекция при бозайници.
Изследване за токсичност
11 съединения бяха предоставени от Inspiralis Ltd. за тестване на тяхната токсичност през G. mellonella ларви. Първоначално съединенията бяха тествани на сляпо, т.е. те бяха доставени в номерирани епруветки и едва след приключване на процедурата за изпитване номерата бяха свързани с имената на съединенията. Целта на този подход беше да се избегне пристрастие, т.е. присвояване на по-ниски токсични дози на известни токсични съединения и по-високи на по-безопасни съединения.
Насекомите (5–10 ларви) се инжектират с 10 µl съединение в най-задния пролег. В процедурите се използва интраперитонеална инжекция за стриктен контрол на количеството токсично съединение или бактериален патоген, на което са били изложени ларвите. Алтернативни подходи, неприложени в това проучване, използват процедури за хранене [16] или контактна експозиция [17]. Количественото определяне на експозицията на съединение е по-малко точно за такива процедури, но понякога е по-подходящ метод, когато е известен начинът на експозиция. Например, токсичността на пестицидите при тестване на насекоми обикновено включва проучвания за хранене [18], тъй като това е нормалният път на излагане.
Насекомите първо се инжектират с ниски дози (5 mg/kg телесно тегло) от съединенията и смъртността се записва ежедневно в продължение на 5 дни. Ако не се наблюдава смъртност, нови групи ларви се инжектират със съединения при 50 mg/kg телесно тегло и смъртността се записва всеки ден отново в продължение на 5 дни. Когато смъртността се наблюдава при 60% или повече от ларвите, съединението се тества отново при същата концентрация, за да се потвърди токсичността. Когато се наблюдава смъртност под 60%, съединенията се тестват впоследствие при 125, 300 и 2000 mg/kg телесно тегло. На всяко съединение е присвоена LD50 стойност (Таблица 3) и стойностите са сравнени с данните за токсичност, налични в страниците за безопасност. Не са тествани съединения над 2000 mg/kg телесно тегло в съответствие с насоките на OECD [15]. Такива високи концентрации на съединения създават проблеми с разтворимостта и не се препоръчват в насоките като ненужни и неетични. Като цяло, съединения без индикация за токсичност при 2000 mg/kg телесно тегло се считат за нетоксични.
Сравнение на изпитванията за токсичност през 2007 г G. mellonella с изследвания върху гризачи
Има три възможни резултата от сравнението на токсичността при ларвите на восъчния молец и при гризачите. Първо, токсичността може да бъде еднаква или много подобна. На второ място токсичните дози в G. mellonella могат да бъдат по-високи от тези при гризачи и накрая токсичните дози в G. mellonella може да бъде по-ниска от дозите за гризачи. Нашата стандартна среда за инжектиране, 50% DMSO във вода, беше смъртоносна за восъчни молци в доза, еквивалентна на 100 mg/kg телесно тегло (4 μl инжекция на изходен разтвор или повече от 2 μl чист DMSO на инжекция). Всички съединения, токсични над 100 mg/kg телесно тегло, трябваше да бъдат тествани повторно в модифицирана инжекционна среда с намалено количество DMSO (
Заключение
В обобщение, нашите експерименти подкрепят това предложение, че антибиотичната ефикасност може да бъде тествана in vivo през Galleria mellonella ларви. Установихме, че дозите, препоръчани за употреба при хора, могат да бъдат ефективни при системни инфекции в ларвите и че острата токсичност на съединенията в ларвите на восъчен молец корелира с токсичността при мишки и плъхове. G. mellonella е организъм, който може лесно да бъде приет при различни тестове. Той не може напълно да замести моделите на бозайници, но е много по-евтин и може да осигури статистическата стабилност, която липсват сегашните модели на животни.
- Глицинът възстановява анаболния отговор на левцин в миши модел на остро американско възпаление
- Обезпокояващи нови отговори в Самоубийството на Model
- Ефекти от диета с високо съдържание на мазнини върху чревната микробиомна дисбиоза в миши модел на болестта в Персийския залив
- Може ли Helix DNA тестване наистина да определи перфектно вашата диета и тренировка
- Голяма долина YMCA