Съществуват сериозни доказателства от проучвания върху животни и хора, които показват, че киселата външна микросреда (локална среда) на клетки, свързани с тумори, играе важна роля в прогресията и миграцията на раковите заболявания. В действителност, при модел на плъх, системното буфериране, което намалява киселинните нива на рН, намалява както прогресията на рака, така и резистентността към лекарства. Д-р Хироми Вада в Японското общество за възпаление и метаболизъм при рак и неговите колеги разследват ефекта на алкална диета върху туморната микросреда и нейния потенциал да повиши ефикасността на противораковото лечение.
Въздействието на диетата
Предполага се, че алкалната диета може да донесе ползи за конвенционалното лечение на рак, въз основа на способността му да променя рН на микросредата на тумора. Алкалните храни включват плодове, зеленчуци, бобови растения, ядки и семена. Понастоящем обаче липсват солидни клинични доказателства, доказващи връзка между диетата и развитието на рака и прогресията.
По-конкретно, проспективните кохортни проучвания, при които са наблюдавани групи индивиди през периоди от време, не успяват да демонстрират връзка между диетичната консумация на плодове и зеленчуци и профилактиката на рака. Въпреки това, наблюденията на проучвания за контрол на случаи предполагат някои интересни асоциации. Тези несъответствия в резултатите могат да се дължат на методологични различия и объркващи променливи между проучванията, като недостатъчното проследяване на пациентите.
Алкална диета и напреднал недребноклетъчен рак на белия дроб (NSCLC)
За да се разбере по-добре връзката между алкалната диета и рака, д-р Хироми Уада от Японското общество за възпаление и метаболизъм при рак и колеги проведоха ретроспективна оценка на единадесет пациенти, диагностицирани или с напреднал стадий, или с рецидивиращ NSCLC с епидермален растежен фактор рецептор (EGFR ) мутация - т.е. ДНК мутация в гените, кодиращи този протеин, която е важна за клетъчното делене и оцеляването.
Пациентите са били лекувани с инхибитор на тирозин киназа (TKI), протеин, който е насочен към мутиралия EGF-рецептор и също е бил насочен към консумация на диета, богата на алкални храни.
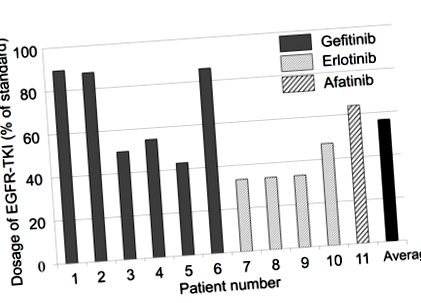
Съответствието на пациентите с алкална диета е потвърдено чрез анализ на рН на урината. Екипът установи, че в някои случаи лечението с TKI е намалено до почти половината от стандартната доза за лечение (Фигура 1). В сравнение с подобни проучвания, получената преживяемост без прогресия (PFS; определена като продължителността на времето по време и след лечението, че пациентът все още има заболяването, но без влошаване) се е увеличила от 13 месеца на 19 месеца. Освен това общата преживяемост се е увеличила от 22,8 месеца на 28,5 месеца.
Докато д-р Уада и колегите му признават, че в това проучване не е имало пряка сравнителна група, констатациите, разгледани със съществуващата литература, подкрепят важното им предложение, че комбинирането на алкална диета с по-ниска доза лечение с EGFR-TKI може да намали токсичните странични ефекти от лечението, като същевременно се разширява PFS на пациентите.
Фигура 1. Дозировка на EGFR-TKI (от Anticancer Research, 2017, 37, 5141–45).
Алкализираща терапия и етап IV Метастатичен или рецидивиращ рак на панкреаса
Ракът на панкреаса е силно агресивен и е свързан с изключително лоши резултати, дори когато се лекува с комбинирани схеми на химиотерапия. В друго клинично проучване д-р Уада и колегите му допълват химиотерапията на напреднал рак на панкреаса, като предписват алкална диета, включваща минимум 400 грама на ден плодове и зеленчуци, заедно с пълно изключване на месо и млечни продукти и ежедневна консумация на перорален разтвор на натриев бикарбонат. Резултатите от проучването, измерени при 28 участващи пациенти, са рН на урината и смъртност.
След алкализираща терапия средното рН на урината е значително по-високо, отколкото при започване на проучването, и изследователският екип установява, че пациентите с по-високо рН на урината (т.е. по-алкални) имат по-висока обща преживяемост (OS) от тези с по-ниска ( по-кисела) рН на урината. Тези пациенти са имали честота на ОС от 16,1 месеца в сравнение с само 4,7 месеца за пациенти с по-кисела урина (Фигура 2А). По същия начин пациентите, които са имали по-голяма разлика в рН на урината (> 1) от терапия преди и след алкализиране, също са имали по-голяма ОС. В тези случаи операционната система е била 16,1 месеца в сравнение с 4,3 (Фигура 2Б).
Вътрешно и извънклетъчно pH: Ефекти върху туморната физиология и патология
Като цяло раковите клетки показват промяна към алкалност във вътреклетъчната среда. С други думи, цитоплазмата в раковите клетки е алкална (pH> 7) и съответната извънклетъчна среда е кисела.
Алкализирането в раковите клетки е ключово за инициирането на злокачествено заболяване и прогресирането на тумора, като някои изследователи съобщават за асоциации с ключови туморни процеси, включително индукция на мултирезистентност и инхибиране на програмирана клетъчна смърт (апоптоза).
Транспортерът на натрий/водород (изоформа 1) NHE1
NHE1 е отговорен за поддържането на киселинно-алкалния баланс в нормалните клетки. С типично („зададена точка“) ниво от 6,9–7,1, този транспортер е до голяма степен неактивен в стабилно състояние. Въпреки това, в трансформирани клетки, NHE1 транспортерът има променена зададена точка и остава активен в диапазона на рН 7.2–7.7. Следователно, това води до алкална среда в клетките и кисела среда, непосредствено заобикаляща клетките.
Теорията за алкализиране се основава на промяна на pH на околната среда около туморните клетки, така че повишаването на pH на киселинната среда да бъде близо до това на вътрешността на туморните клетки (pH 7.2–7.7) предотвратява транспортното действие на NHE1 и предотвратява самоуправляваното разпространение на раковите клетки.
NHE1: Пролиферация на тумори и метастази
Други изследователи са потвърдили връзката между NHE1, пролиферацията на тумори и повишеното вътрешно клетъчно pH чрез блокиране на клетъчната пролиферация или действието на транспортера и определяне на вътреклетъчното pH.
Освен това, алкалната вътрешна среда, която е резултат от действието на транспортера NHE1, насърчава производството на фактори, които от своя страна индуцират ангиогенеза, образуването на нови кръвоносни съдове, което е необходимо за разпространението на метастатични тумори. Освен това, киселинното външно pH насърчава действията на редица фактори, които подпомагат пролиферацията и мобилизацията на туморни клетки.
Един от най-значимите аспекти на действието на NHE1 е, че той не се нуждае от растежен фактор, който да стимулира неговото действие. Това означава, че промяната в междуклетъчното pH е всичко, което е необходимо, за да се предизвикат условията, които водят до клетъчна пролиферация.
Алкализиране и ефект върху имунотерапиите на рака
В допълнение към химиотерапиите, терапиите с антитела също се използват като терапии в някои лечения на рак. Лечение за аденокарцином на езофагогастралния възел, Nivolumab, се използва заедно с алкализиране при един възрастен пациент. Д-р Уада и колеги съобщават за положителни констатации в това проучване на случая, където пациентът е консумирал алкална диета в комбинация с перорален натриев бикарбонат. Те показаха, че туморните маркери се връщат към нормални нива от изключително високи стойности преди лечението и освен това, компютърна томография на 12 месеца след лечението идентифицира свиване на езофагогастриалния тумор и метастази в черния дроб.
Д-р Уада и неговата група отбелязват, че този казус, първият по рода си, подчертава потенциалната връзка между алкализирането на туморната микросреда и положителните резултати от терапията с антитела в случаи, които не показват полза от множество други терапии.
Фигура 2. Асоциация между общата преживяемост на напреднали пациенти с рак на панкреаса и pH на урината (A) или ΔpH на урината (B)
(от Anticancer Research, 2020, 40, 873–80 ’).
Резистентност към химиотерапия и диета
Известно е, че вътрешното (цитоплазматично) рН на повечето видове рак е алкално и някои изследователи са показали, че това е централен аспект на химиотерапевтичната резистентност. По-конкретно, в алкална среда е показано, че някои химиотерапевтични лекарства присъстват в туморните клетки при по-ниски концентрации при алкални условия, отколкото при киселинни (по-ниско рН) условия.
Това означава, че когато NHE1 е активен и междуклетъчното рН се повиши, химиотерапията е значително по-малко ефективна и туморните клетки стават устойчиви на действието на лекарствата. Тъй като всички ракови клетки не се убиват от лечението - често в повечето ситуации - вътрешното рН на останалите клетки се увеличава допълнително и клетките стават по-устойчиви на лекарствата. Лекарствата не могат да предизвикат апоптоза и туморът напредва.
В някои тестове, използващи култивирани клетъчни линии, е доказано, че резистентността към ключови химиотерапевтични лекарства се увеличава почти 2000 пъти в отговор на повишено междуклетъчно рН от 0,44.
Д-р Уада и колеги твърдят, че благоприятните резултати, които са наблюдавали при пациенти с агресивен рак в късен стадий, които често стават устойчиви на химиотерапия, подкрепят концепцията им, че алкализирането на туморната микросреда чрез манипулиране на диетата и консумацията на перорален разтвор на натриев бикарбонат води до намалено рН във вътрешната клетъчна среда. В крайна сметка тази манипулация на рН в локалната туморна среда може да увеличи чувствителността на туморните клетки към химиотерапевтични агенти.
Бъдещето
Д-р Уада и колеги обсъждат ограниченията на досегашната им работа, необходими от естеството на лечението на рак в късен стадий. Въпреки това, техните открития, свързани с алкализиране (постигнато чрез диета и, в някои случаи, добавки с перорален натриев бикарбонат) при пациенти с късен стадий или метастатични тумори показват подобрени резултати за пациентите. Те включват OS, PFS, редукция на тумори и метастатици и подобрена чувствителност на туморите към химиотерапевтични и базирани на антитела лекарства. В един случай д-р Уада и неговият екип дори съобщават за подобрени резултати с алкална терапия при пациент с мултирезистентен тумор.
В допълнение към впечатляващите си клинични открития, д-р Уада и неговият екип представят ясен механизъм за патологията и физиологията на раковите заболявания във връзка с кисела външна и алкална вътреклетъчна среда, като по този начин демонстрират как рН балансът води до клетъчна пролиферация, ангиогенеза и формиране на метастатични тумори.
Д-р Уада и неговият екип също се интересуват от областта на психичното благосъстояние и развитието и развитието на рака, като се застъпват за това, че потискането на свръхактивирането на оста хипоталамус-хипофиза, централната система за реакция на стреса в организма, преди лечението на рака, носи осезаеми ползи за пациента . Емоциите на човека имат пряк ефект върху хипофизата, което води до производството на хормони, свързани със стреса, нарушавайки хормоните на тялото и потискайки имунния отговор. Като такъв, д-р Уада също се застъпва за терапевтичен подход, целящ да сведе до минимум стреса и да увеличи ползите от раковите интервенции.
Справка
https://doi.org/10.33548/SCIENTIA483
Запознайте се с изследователя
Д-р Хироми Уада, д-р, д-р
Професор почетен
Отделение по гръдна хирургия
Факултет по медицина
Университета в Киото
Япония
Д-р Хироми Уада е завършил Медицинския факултет на Университета Киото, Япония, като доктор по медицина. След това работи в Института за изследване на гръдната болест и Института за гранични медицински науки към университета в Киото, преди да стане професор в катедрата по гръдна хирургия, която също е в университета в Киото. В момента д-р Уада е почетен професор в университета в Киото, директор на клиника Карасума Вада и представител на Японското общество за възпаление и метаболизъм при рак.
КОНТАКТ
Д-р Хиромаса Морикава, д-р, д-р
Клиника Карасума Вада
Киото
Япония
Д-р Хиромаса Морикава получи докторска степен през 2001 г. в Медицинския факултет на университета в Киото, Япония. След като работи като гръден хирург, той получава докторска степен за изследванията си върху имунологията на Т-клетките, проведени в лабораторията на д-р Шимон Сакагучи. След като работи като асистент там, той се премества в Karolinska Institutet в Швеция, като работи в компютърната медицина и имунология в лабораторията на д-р Jesper Tegner като стипендиант на Vinnmer-Marie Curie. В момента работи в клиника Карасума Вада в Япония и е член на борда на Японската асоциация за гръдна хирургия.
КОНТАКТ
Д-р Рео Хамагучи, д-р
Японско общество за възпаление и метаболизъм при рак
Киото
Япония
Д-р Рео Хамагучи е завършил Медицинския факултет на университета Каназава и в момента се обучава в аспирантура в Медицинския факултет на Токийския университет. Той е дипломиран интернист в Японското общество по вътрешни болести, специалист по гръдна медицина и сертифициран онколог. Д-р Хамагучи е и главен лекар в медицинската клиника Mirai в Миогадани, Токио. През кариерата си е работил като пулмолог при лечението на пациенти с общи вътрешни болести, както и с рак. В момента той учи под наблюдението на д-р Уада и лекува пациенти с рак чрез подобряване на диетата и повишаване на имунитета предвид възпалението и метаболизма на рака.
КОНТАКТ
Д-р Ryoko Narui, д-р
Японско общество за възпаление и метаболизъм при рак
Киото
Япония
КОНТАКТ
Лиценз на Creative Commons
(CC BY 4.0)
Това произведение е лицензирано под Creative Commons Attribution 4.0 International License.
Какво означава това?
Дял: Можете да копирате и разпространявате материала във всеки носител или формат
Адаптирайте: Можете да променяте и надграждате материала за всякакви цели, дори търговски.
Кредит: Трябва да дадете подходящ кредит, да предоставите връзка към лиценза и да посочите дали са направени промени.
- Промените в диетата могат да подобрят свързаните с еректилната дисфункция уролози
- Диетичните модели в ранна детска възраст са свързани с детската диета и резултатите от теглото на 6 години - PubMed
- Граници Потенциалната роля на комбинираната фармакотерапия за подобряване на резултатите от педиатрията
- Диетичен прием и качество на диетата при деца, лекувани от рак - PubMed
- Електронна книга) ABCD Диетична книга A-Z Ръководство за най-добрите антиракови храни - Beat Cancer Beat Cancer