Майкъл Нейтън ВанСон
От отделите по биология на рака, * хирургия, † и медицинска патология, § Университет Вандербилт, Нешвил, Тенеси; и катедрата по хирургия, ‡ Католическия университет в Корея, болница „Св. Мери“, Сеул, Корея
В Кю Ли
От отделите по биология на рака, * хирургия, † и медицинска патология, § Университет Вандербилт, Нешвил, Тенеси; и катедрата по хирургия, ‡ Католическия университет в Корея, болница „Сейнт Мери“, Сеул, Корея
Мери Кей Вашингтон
От отделите по биология на рака, * хирургия, † и медицинска патология, § Университет Вандербилт, Нешвил, Тенеси; и катедрата по хирургия, ‡ Католическия университет в Корея, болница „Св. Мери“, Сеул, Корея
Лин Матрисиан
От отделите по биология на рака, * хирургия, † и медицинска патология, § Университет Вандербилт, Нешвил, Тенеси; и катедрата по хирургия, ‡ Католическия университет в Корея, болница „Св. Мери“, Сеул, Корея
Дейвид Лий Гордън
От отделите по биология на рака, * хирургия, † и медицинска патология, § Университет Вандербилт, Нешвил, Тенеси; и катедрата по хирургия, ‡ Католическия университет в Корея, болница „Сейнт Мери“, Сеул, Корея
Резюме
Затлъстяването и неалкохолният стеатохепатит (NASH) се очертават като два независими рискови фактора за развитие на цироза и хепатоцелуларен карцином, различни от добре установените рискови фактори, включително вирусен хепатит и консумация на алкохол. 1, 2, 3 Безалкохолната мастна чернодробна болест (NAFLD) може да е резултат от диета с високо съдържание на мазнини, липса на упражнения, инфекция с хепатит, диабет тип II или комбинация от тези фактори. NAFLD обикновено се свързва с централно затлъстяване, инсулинова резистентност и хиперлипидемия и се характеризира клинично с метаболитния синдром. 4, 5 Затлъстяването е клинично свързано с повишено разпространение на някои злокачествени заболявания, включително рак на дебелото черво и рак на гърдата. 6, 7 NASH, свързан със затлъстяването, е признат рисков фактор за развитието на първичен хепатоцелуларен карцином. 2, 8 Наскоро, малко проучване на случая идентифицира хепатоцелуларен карцином при подгрупа пациенти с NAFLD при липса на цироза, подкрепяйки NAFLD като пермисивна среда за развитието на хепатоцелуларен карцином. Освен това, тъй като системното заболяване представлява основната причина за смъртност от рак, нарастващата честота на затлъстяване, NAFLD и NASH вероятно ще окаже огромно влияние върху свързаните с рака смъртни случаи в Съединените щати.
При хората чернодробната стеатоза представлява ранен обратим стадий на заболяването, който се хистологично характеризира с натрупване на триглицериди в хепатоцитите. 10, 11 Хистологично, широкият термин NALFD може да включва самостоятелно стеатоза или може да включва прогресивни промени, свързани с неалкохолен стеатохепатит като възпаление, балониране на хепатоцити, некроза, хиалин на Mallory’s и дори фиброза. 11, 12, 13 NASH може да бъде окончателно диагностициран само чрез чернодробна биопсия, но се подозира при пациенти със затлъстяване и/или синдроми на инсулинова резистентност, придружени от повишени серумни нива на аминотрансфераза. 14, 15 Доказано е, че естествените генетични мутации като гена на лептин (ob/ob), генетично модифицирани мишки, диетични модели на околната среда и токсини като етанол увеличават усвояването на чернодробните мазнини, което води до стеатоза и стеатохепатит. 16, 17
Подобрените миши модели, които потвърждават човешкото заболяване, са важни за разбирането на микроекологичните фактори, които допринасят за промоцията на тумора в черния дроб. Предполага се чрез използването на генетични, както и диетични модели на мишки, че свързаната със затлъстяването чернодробна стеатоза може да увеличи чувствителността на черния дроб към злокачествено заболяване. 18, 19, 20 Разпознато е, че освен диети с високо съдържание на мазнини, консумация на алкохол, възпалителни цитокини, оксидативен стрес, промени в извънклетъчния матрикс, както и вирусни медиатори, могат да участват в развитието на стеатохепатит при хората и могат да допринесат за риск фактори за хепатоцелуларен карцином. Например, промените във възпалителните цитокини и протеазите за ремоделиране на извънклетъчния матрикс са свързани с повишен метастатичен риск в множество моделни системи и органи. 21, 22, 23, 24, 25 Значителни стеатотични промени и/или стеатохепатит причиняват увеличаване на редица сигнални молекули, включително трансформиращ растежен фактор β и избрани матрични металопротеинази, които могат да бъдат важни за промоцията и растежа на тумора. 26, 27, 28
Микроекологичните ефекти на индуцирана с високо съдържание на мазнини чернодробна стеатоза върху туморния растеж в нашите данни показват, че ранната неусложнена стеатоза на чернодробната микросреда увеличава броя на метастатичните огнища и натоварването на тумора в експериментален миши модел на метастази на колоректален рак в черния дроб. Ние демонстрираме, че промените в стеатотичния черен дроб създават по-податлива микросреда за метастази в сравнение с нормалния черен дроб. В допълнение, мултифокалната дисплазия на черния дроб се развива при продължителна консумация на диета с високо съдържание на мазнини, съобразена с прогресивни хистологични промени, аналогични на NASH в този миши модел.
Материали и методи
Изследване на животни и диета
C57bl/6J мъжки мишки са получени от изследователските лаборатории на Джаксън (Bar Harbor, ME) на възраст 8 седмици и са настанени в акредитирана лаборатория за животни. При получаване мишките бяха разделени в подходящи клетки и хранени или с 13,5% мазнина „обикновена“ диета (RD, 5001, LabDiet: 13,5% калории от мазнини, 58% от въглехидрати и 28,5% от протеини) или хранени с 42% мазнина, диета с високо съдържание на мазнини/западен стил (HF, TD.88137, Harlan Teklad (Северна Америка): 42% калории от мазнини, 42,7% от въглехидрати и 15,2% от протеини) ad libitum. Броят на мишките в определени часови точки на диетата е както следва: на 1 месец (3RD, 3HF), 3 месец (3RD, 3HF), 7 месец (4RD, 5HF), 9 месец (3RD, 2HF), 14 месец (2RD, 3HF) и 20 месеца (3HF). По време на жертвоприношението всички мишки бяха претеглени, черният дроб беше отстранен и претеглен, а пробите от всеки черен дроб бяха или замразени в Tissue-Tek OCT съединение (Sakura), фиксирани в буфериран формалин, консервиран в RNAlater (Qiagen, Валенсия, Калифорния) ), хомогенизиран в RIPA буфер (10 mmol/L Tris pH 7,5, 150 mmol/L NaCl, 0,1% SDS, 0,5% дезоксихолат, 1% Triton) с добавяне на пълна таблетка за коктейл Mini протеазен инхибитор (Roche Diagnostics, Indianapolis, IN ) за анализ на протеини или бързо замразени в течен азот за съхранение. Всички проби, които не са използвани веднага, се съхраняват при -80 ° C.
Хистология
Количествено определяне на ORO
Изображенията от ORO оцветени секции бяха калибрирани с помощта на софтуер за анализ MetaMorph и прагът беше зададен според относителния диапазон на интензивността на оцветяването. Прагът се поддържа постоянен за всички изображения и се изчислява процентна площ на прага за всяко изображение. Бяха получени осем изображения за всяка проба и беше осреднена процентната площ, за да се даде относителното ниво на оцветяване за тази проба. След това нивото на оцветяване с ORO за проби от западна диета и редовна диета се начертава във времето с помощта на GraphPad и статистическата значимост се изчислява с помощта на еднопосочен дисперсионен анализ.
Експериментални метастази в черния дроб
Резултати
Индукция на стеатоза при мишки чрез диета с високо съдържание на мазнини
Мишките се поддържат на съответните им диети, докато не бъдат жертвани в определени часови точки от 1, 3, 7, 9, 14 и 20 месеца на диета. Стеатозата в кохортите се оценява чрез брутен външен вид на черния дроб, чернодробно тегло, чернодробно тегло като процент от телесното тегло и оцветяване с ORO за натрупване на липиди.
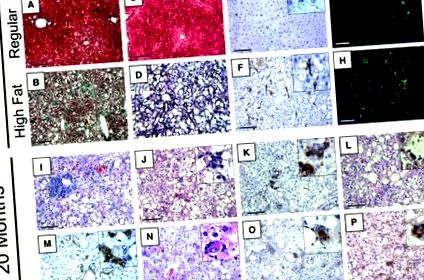
Чернодробните звездни клетки обикновено се свързват с фиброзни фенотипи и повишено отлагане на колаген в черния дроб. Увеличен брой звездни клетки е открит в черния дроб след 14-месечна консумация на диета с високо съдържание на мазнини, в сравнение с редовната диета, както се определя от имунохистохимията за αSMA или имунофлуоресценцията за GFAP (Фигура 2, E и F, и G и H, съответно) . Средният индекс на относително оцветяване на 14 месеца по време на диета се е увеличил между редовната диета и диетата с високо съдържание на мазнини както за αSMA от 20 ± 7 на 111 ± 46; P (Фигура 2, I – P). До 20 месеца на диета широко се наблюдава хронична възпалителна клетъчна инфилтрация, свързана с порталните триади (Фигура 2I). По това време имаше също лобуларно възпаление и асоцииране на CD45 положителни клетки около хепатоцитите (Фигура 2, J и K). Високото съдържание на мазнини затруднява идентифицирането на балониращите хепатоцити, но те са отбелязани на 14 месеца, както и на 20 месеца (Фигура 2L). Дуктуларната реакция на жлъчката е разкрита чрез имунохистохимия на цитокератин 19 (Фигура 2М). В допълнение, розови включвания, сравними с хиалина на Mallory, бяха наблюдавани в H&E секции (Фигура 2N), което беше допълнително потвърдено чрез имунохистологично оцветяване за убиквитин (Фигура 2O), както и за цитокератин 8 (Фигура 2P). Както убиквитинът, така и цитокератинът 8 са отбелязани като положителни показатели за патологични включвания, съответстващи на телата на Mallory. 30, 31, 32 Резултатите, наблюдавани в нашия модел на мишка, са подобни на типичните хистологични характеристики, наблюдавани при хора, диагностицирани с късен стадий на NAFLD и NASH, включително етапи, често свързани с предциротични усложнения. 11, 12
Прогресия към първична дисплазия
Общото и хистологично изследване на черния дроб от мишки, хранени с високомаслена диета в продължение на 9, 14 и 20 месеца, разкрива множество атипични възли, както и фокални маси в черния дроб. Хистологичният анализ открива диспластични характеристики в тези възли. Спонтанни диспластични тумори бяха открити в нашите експерименти още 9 месеца при мишка, поддържаща диета с високо съдържание на мазнини (Фигура 3А), но не бяха наблюдавани при контролни мишки, поддържани на редовна диета по едно и също време. Имаше откриваеми диспластични лезии при 1/2 мишки на 9 месеца, 3/3 мишки на 14 месеца и 3/3 мишки на 20 месеца при мишки, поддържани на диета с високо съдържание на мазнини. За разлика от това, нито една от мишките (0/3 на 9 месеца и 0/2 на 14 месеца), поддържани на редовна диета, не е наблюдавана с груба или микроскопична анормална дисплазия. Увеличение на броя на диспластичните огнища, корелирани с времето на диетата и множество тумори са наблюдавани при мишки на диета с високо съдържание на мазнини в продължение на 14 и 20 месеца (Фигура 3, В и С) .
Продължителната консумация на диета с високо съдържание на мазнини води до образуване на диспластичен тумор. Диспластични туморни възли са идентифицирани в черния дроб с високо съдържание на мазнини още на 9-месечна диета (A: 1/2 мишки). Груби изображения на черен дроб, поддържан на диета с високо съдържание на мазнини в продължение на 14 месеца (Б.: 3/3 мишки) и 20 месеца (° С: 3/3 мишки) съответно показват множество диспластични възли, видими на чернодробната повърхност, докато не са открити дисплазии при мишки, поддържани на редовна диета в продължение на 9 или 14 месеца (0/3, 0/2 мишки), дори след микроскопски секционен анализ. Хистологичният анализ на чернодробните секции разкрива два различни вида диспластични възли, както твърди, така и немазни (D, E, F) или като тумори, съдържащи големи капчици липид (G, H, I). Хистологичните срезове бяха оцветени с трихром (D, G), както и H&E (E, F, H, I) за анализ. Увеличението с висока мощност на H&E оцветени секции показва клетъчния контекст на двата вида тумори (F, I). Скала = 10 mm (A, Б., ° С); 1 мм (д, Е., G, З.); и 50 μm в (F, I).
Серийните секции на черния дроб бяха оцветени с трихром, както и H&E, за да се подобри откриването и идентифицирането на туморни възли на повърхността и в рамките на чернодробния паренхим. Хистологично възлите показват или твърда диспластична морфология (Фигура 3, D-F), или диспластична морфология, свързана с липидни и протеинови глобули (Фигура 3, G-I). Увеличението с висока мощност демонстрира хистологията на клетъчните разлики между двата вида диспластични тумори (Фигура 3, F и I). Беше отбелязано, че тези дисплазии са неинвазивни, както е определено чрез патологична оценка и не е извършено допълнително тестване, за да се определи степента на молекулярна трансформация в тези клетки. Не са открити тумори в нито един основен орган извън черния дроб, включително белите дробове, сърцето, епидидималната мастна тъкан, червата или мезентерията.
Повишени метастази в колоректалния черен дроб в миши модел
Дисплазията, наблюдавана в болния черен дроб на мишки, поддържана на продължителна диета с високо съдържание на мазнини, предполага, че тази микросреда е благоприятна за образуването на тумори. След това попитахме дали чернодробната стеатоза, без изразената възпалителна клетъчна инфилтрация и други хистологични характеристики, свързани с късен стадий на NAFLD, може да е благоприятна за установяването на метастази от отдалечени места. Черният дроб представлява най-важното място за метастази в колоректалния рак.
За да се оцени дали стеатотичният черен дроб осигурява предимство на пролиферативен растеж за клетките MC38, извършихме фосфо-хистонов Н3 имунооцветяване (Фигура 5, А и В). Пролиферативният индекс показва сходни нива на пролиферация между метастатични тумори в обикновения и високомасления черен дроб (P (Фигура 5, C и D). Няма забележима разлика в броя на апоптотичните клетки в туморите на диета с високо съдържание на мазнини или редовен диетичен черен дроб. Въпреки това, имаше области с плътно положително разцепени клетки, оцветени с каспаза-3, съседни на тумори в диетите с високо съдържание на мазнини (6/6, фигура 5D), което не се наблюдава при обикновения диетичен черен дроб (0/8, Тези зони на плътни апоптотични клетки до туморни възли в диети с високо съдържание на мазнини също показват голям брой инфилтриращи възпалителни клетки, както се определя чрез оцветяване с анти-неутрофилни антитела (Фигура 5F). Ко-имунофлуоресценция разкрива, че неутрофилите (червено) се е инфилтрирало в същата зона като разцепените каспаза-3 (зелени) -положителни клетки, но представлява отделни клетъчни популации (Фигура 5Н). от редовни диетични мишки (Фигура 5, E и G). Освен това, макрофагите (червени) бяха открити в туморните възли, както и в нетуморната чернодробна тъкан както от обикновена диета, така и от диетични мишки с високо съдържание на мазнини (Фигура 5, I и J). Спекулираме, че инфилтриращите възпалителни клетки могат да допринесат за клетъчната апоптоза в перитуморните области на метастатични лезии в стеатотичната, но не и в нормалната чернодробна микросреда.
Дискусия
NAFLD обхваща спектър от чернодробни заболявания и сложни метаболитни нарушения, които в крайна сметка могат да доведат до краен стадий на чернодробна дисфункция и цироза, усложнена от злокачествено заболяване. По-специално, мишият модел, описан в това проучване, потвърждава констатациите на чернодробно заболяване при човека с клинично значимата индукция на високо съдържание на мазнини при чернодробно заболяване. Доказахме, че консумацията на диета с 42% съдържание на мазнини води до натрупване на липиди в хепатоцитите на мишките. Други проучвания съобщават за същия генетичен щам на мишките и същата диета, използвана в нашето проучване, също води до повишена висцерална мастна маса, серумен инсулин и нива на серумен лептин, още 8 седмици на диета. 33 Натрупването на липиди в нашия модел на мишка стана забележимо в зона 1 на 3 месеца от диетата и в крайна сметка зае 75% от хепатоцитите до 7 месеца на диета. В допълнение, продължителната консумация на диета с високо съдържание на мазнини в нашия модел на мишка води до развитието на функции, сравними с човешкото състояние на NASH. Тези характеристики включват фиброза, повишено активиране на звездни клетки, възпаление, дегенерация на хепатоцелуларен балон, жлъчно-дуктуларна реакция и дори образуване на патологични включвания.
Епидемията от затлъстяване и NAFLD има много клинични последици. Нашите данни показват, че диета, състояща се от 42% калории от мазнини, води до стеатотична микросреда в миши черен дроб, която е благоприятна за установяване на метастатични тумори и евентуално развитие на първични диспластични възли в условията на хронично заболяване. Ние демонстрираме, че сигналите от стеатотичната микросреда гостоприемник вероятно поставят началото на развитието на тумора дори в началните обратими и лечими стадии на мастна чернодробна болест. Тъй като стеатозата прогресира, за да прояви възпалителен компонент, чувствителността към установяване на тумор се увеличава. Индуцираната от храната NAFLD, наложена върху каквато и да е предразположеност за наследствен или друг ненаследствен рак, може допълнително да понесе още по-голям риск за развитието на чернодробни неоплазии, независимо дали първични или метастатични. Този модел изглежда добра система, при която потенциалните терапевтични агенти могат да бъдат тествани и да доведат до по-добро разбиране на механизмите, свързани с прогресията на безалкохолната мастна чернодробна болест.
Благодарности
Благодарим на д-р Стейси Хуперт от катедрата по клетъчна биология и биология на развитието на университета Вандербилт за любезната техническа помощ с имунооцветяването CK19.
Бележки под линия
Адресирайте заявки за повторно отпечатване до D. Lee Gorden, 1313 21 st. Ave. S., 801 Оксфорд Хаус, медицински център на Университета Вандербилт, Нешвил, TN 37212. E-mail: [email protected].
Подкрепено с безвъзмездни средства от Американското общество за борба с рака # PF-05-167-01-CSM (M.V.S.); Център за рак на Vanderbilt Ingram P50CA095103 (в подкрепа на Имунохистохимичното основно съоръжение). Основните услуги, извършвани чрез Центъра за изследване на храносмилателната болест на Университетския медицински център на Вандербилт, са подкрепени с гранта на NIH P30DK058404 (M.K.W.). D.L.G. беше подкрепена отчасти от грант номер P50CA095103 от Националния институт по рака и K08 DK70708-01 грант от Националния здравен институт. Допълнителна подкрепа беше от гранта на NIH R01CA060867 (L.M.) и от университета Vanderbilt Discovery Grant.
Съдържанието е отговорност единствено на авторите и не представлява непременно официалните възгледи на ACS, NCI или NIH.
- Диетата с високо съдържание на мазнини предизвиква чернодробна стеатоза и ранна дисрегулация на метаболизма на желязо при плъхове
- Чернодробни транскриптомни отговори при мишки, изложени на диета с арсен и различни мазнини - PubMed
- Протеинът на вируса на хепатит С и претоварването с желязо предизвикват чернодробна стеатоза чрез разгънатия протеин
- Вече мога да нося високи токчета! 3 дебели пилета на диета за отслабване
- Хепатит В вирус X протеин предизвиква чернодробна стеатоза чрез засилване на изразяването на чернодробните мазнини