Юджун Цай
Институт за сърдечно-съдови изследвания Aab, Медицински департамент, Университет в Рочестър, 601 Elmwood Ave, Рочестър, NY 14642, САЩ
Джиан-Донг Ли
b Център за възпаление, имунитет и инфекция и Департамент по биология, Университет на Джорджия, Атланта, Джорджия 30303, САЩ
Чен Ян
Институт за сърдечно-съдови изследвания Aab, Медицински департамент, Университет в Рочестър, 601 Elmwood Ave, Рочестър, NY 14642, САЩ
Резюме
Въведение
Атеросклерозата е основният причинител на миокарден инфаркт и инсулт, водещите причини за заболеваемост и смъртност в развитите страни. Отлагането на холестерол в артериалната стена играе критична роля при атеросклерозата [1; 2; 3]. Повишените плазмени липиди, особено липопротеините с ниска плътност (LDL), са важен рисков фактор за атеросклероза [1; 4], а клиничната полза от статините при лечение на атеросклероза зависи главно от ефекта на понижаване на холестерола [5]. LDL може да премине през ендотела на съдовата стена и да пребивава в суб-ендотелното пространство, където LDL може да бъде окислително модифициран, за да стане окислен LDL (ox-LDL). вол-LDL е основният задействащ фактор на ендотелната дисфункция и съдово възпаление, играейки ключова роля в развитието и прогресирането на атеросклерозата [2; 6]. Почистващият рецептор като лектиноподобен окислен LDL рецептор-1 (LOX-1) е основен вол-LDL рецептор [6; 7]. LOX-1 се експресира при ниски нива в здрави съдови клетки и се регулира нагоре от много про-атерогенни стимули и неговия агонист вол-LDL [6; 7]. Макрофагите в субендотелното пространство поглъщат вол-LDL, превръщат се в пенообразни клетки и предизвикват образуване на мастни ивици, което представлява основни патологични характеристики в ранния етап на атерогенезата [2; 6].
Материали и методи
Животни
Всички животни са били използвани в съответствие с насоките на Националния институт по здравеопазване и Американската сърдечна асоциация за грижи и използване на лабораторни животни. Процедурите са извършени в съответствие с експериментални протоколи, одобрени от Университетския комитет по животинските ресурси към университета в Рочестър. Мъжки нокаутиращи мишки C57BL/6J ApoE (Jackson Laboratories) на възраст от 8 седмици са били хранени с нормална диета с чау или диета с високо съдържание на мазнини, съдържаща 1,25% холестерол (Research Diets D12108C) в продължение на 16 седмици. Винпоцетин (5 mg/kg телесно тегло) или същия обем на носителя се прилага чрез i.p. маршрут веднъж през ден в продължение на 16 седмици, както беше описано по-рано [14].
Оценка на атеросклеротична лезия
Кръвно налягане, измерване на серумен холестерол
Кръвното налягане се измерва с помощта на неинвазивна процедура за маншет и Visitech BP-2000 система за анализ на кръвното налягане, както е описано по-горе [16]. Холестеролът на серумния LDL и HDL се измерва с помощта на HDL и LDL/VLDL холестеролен тест (Abcam) в съответствие с инструкциите на производителя.
Клетъчна култура
Миши RAW264.7 макрофаги клетъчна линия (ATCC, Rockville, MD) бяха отгледани в модифицирана среда на орел на Dulbecco (DMEM), съдържаща 10% фетален говежди серум (FBS) в овлажнен инкубатор (37 ° C, 5% CO2).
РНК изолация и RT-PCR
Общата клетъчна РНК беше изолирана от RAW264.7 клетки, използвайки RNeasy Mini Kit (Qiagen), съгласно инструкциите на производителя. cDNA се синтезира чрез обратна транскрипция, използвайки комплект за обратна транскрипция Taqman (Applied Biosystems), следвайки инструкциите на производителя. PCR в реално време се извършва с помощта на iQ ™ SYBR Green supermix (BIO-RAD) с праймери LOX-1: 5′-CAAGATGAAGCCTGCGAATGA (напред) и 5′-ACCTGGCGTAATTGTGTCCAC (обратно). Относителните количества на иРНК са получени чрез нормализиране с глицералдехид-3-фосфат дехидрогеназа (GAPDH).
Имунофлуоресцентно оцветяване
Имунооцветяването се извършва, както е описано по-рано [14]. Накратко, замразените секции бяха фиксирани с 4% параформалдехид и проникнати в 0.2% Triton X-100. Секциите бяха блокирани с блокиращ разтвор на Dako без серум (M0841, Dako) и инкубирани с първично антитяло. Основните антитела са MAC-2 (CL8942AP, Cedarlane) и LOX-1 (sc-11653, Santa Cruz). След това срезовете бяха инкубирани с конюгирани с флуоресценция вторични антитела. Ядрената беше оцветена с DAPI. Изображенията са заснети с флуоресцентен микроскоп Olympus (BX-51). Олио-червената O положителна зона, LOX-1 експресията и Mac-2 положителната зона бяха количествено определени с помощта на софтуера Image-Pro 6.2 (Media Cybernetics).
Натрупване на Ox-LDL
За измерване на поглъщане и натрупване на белязан с флуоресценция вол-LDL (Dil-ox-LDL), RAW264.7 клетки бяха предварително обработени с различни дози винпоцетин в продължение на 24 часа в DMEM, съдържащ 0.1% FBS, след това заредени с 10 μg/ml Dil-ox -LDL (Biomedical Technologies, Inc.) за допълнителни 4 часа. След това клетките се промиват с PBS и се фиксират с формалин. Ядрената е оцветена с DAPI. Снимките са направени с флуоресцентен микроскоп BX-51 Olympus. За да се измери редовното поемане и натрупване на вол-LDL, клетките се третират с винпоцетин, както е описано по-горе, след това се зареждат с 50 μg/ml вол-LDL (Biomedical Technologies, Inc.) за 24 часа. След това клетките се измиват, фиксират и оцветяват с масло-червен О разтвор. Интензитетите на оцветяването Dil-oxLDL и маслото в червено O бяха изчислени количествено с помощта на софтуера Image-Pro 6.2 (Media Cybernetics) и бяха изследвани пет полета за всяка проба.
Статистически анализ
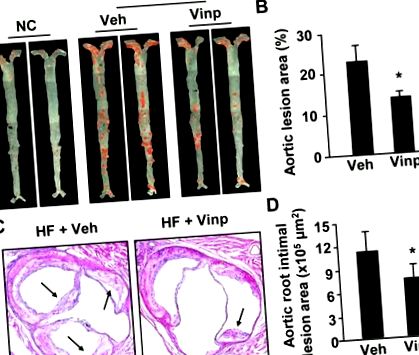
Количествените резултати се изразяват като средна стойност ± SEM или средна стойност ± SD, както е посочено. Всички показани резултати бяха потвърдени от поне три независими експеримента. Данните бяха анализирани чрез еднопосочна ANOVA. * P-стойности Фигура 1, има забележимо намаляване на общите аортни атеросклеротични лезии при мишки, хранени с диета с високо съдържание на мазнини, в сравнение с нормалната диета с чау (Фиг. 1А и В). Лечението с винпоцетин значително намалява зоните, оцветени с маслено червено О (фиг. 1А и Б). В допълнение, ние оценихме областта на интимната лезия на аортния синус чрез хистологични анализи и установихме, че винпоцетинът също намалява интимни лезии на аортния синус (Фиг. 1С и D). Тези данни предполагат, че винпоцетинът подобрява образуването на атеросклеротична лезия.
Ефекти на винпоцетина върху образуването на атеросклеротични лезии. (A) Представителни изображения на лице на масленочервена оцветена аорта от ApoE нокаутиращи мишки, хранени с нормална чау (NC) или диета с високо съдържание на мазнини (HF) в продължение на 16 седмици с ip инжекция от 5 mg/kg/ден винпоцетин (Vinp) или физиологичен разтвор (Veh). (Б) Количествени данни, показващи процента на атеросклеротична лезия в цялата аорта. (В) Представителни изображения на аортния синус, оцветен с H&E от мишки, хранени с диета с високо съдържание на мазнини и инжектирани с винпоцетин или носител. (D) Количествени данни за показване на зоните на интимни лезии в аортния корен. Стойностите са средни стойности ± SEM (n = 7 както за винпоцетин, така и за групи носители). * P Таблица 1). Важното е, че лечението с винпоцетин също намалява смъртността от 27% на 8% (Таблица 1). Защитните ефекти на винпоцетин не се дължат на промяна на липидния метаболизъм, тъй като плазмените нива на HLD, LDL и VLDL не се променят от винпоцетин (Таблица 1). Диета с високо съдържание на мазнини предизвиква повишаване на кръвното налягане при ApoE -/- мишки (Таблица 1), подобно на предишни съобщени открития [18; 19]. Винпоцетин потиска повишаването на кръвното налягане, което е в съответствие с вазодилататорния ефект, който има винпоцетин [20]. Кръвното налягане обаче не отчита развитието на атеросклероза при ApoE -/- мишки [19]. По този начин антиатерогенният ефект на винпоцетин вероятно се медиира от действието му върху стените на съдовете.
маса 1
Серумен холестерол, кръвно налягане, телесно тегло и смъртност