Кореспонденция на: д-р Мирослав Сниетура, доктор по патология на тумора, Мемориален център за рак на Мария Склодовска-Кюри и Институт по онкология, клон Гливице, ул. Wybrzeze Armii Krajowej 15, 44-101 Gliwice, Полша. ten.aruteins@kerim
Телефон: + 48-32-2789408 Факс: + 48-32-2789415
Резюме
ЦЕЛ: Да се демонстрира присъствието и биологичната активност на човешкия папиломен вирус (HPV) в тъканите на рак на стомаха (GAC).
МЕТОДИ: В проучването са включени 84 хирургично лекувани пациенти със стомашен аденокарцином, независимо от клиничния стадий на заболяването. Наличието на HPV ДНК с високо онкогенни рискови типове във формалин-фиксирани, вложени в парафин туморни проби беше определено с помощта на количествен анализ на полимеразна верижна реакция. По време на изолирането на ДНК се прилага строг протокол за предотвратяване на кръстосано и екологично замърсяване и се прилага амплификация, както и потвърждаване на биологичната активност на вируса в туморните клетки. Изследването използва теста за висок риск в реално време за HPV, който открива ДНК на 14 HPV подтипа, за които се счита, че имат висок онкогенен потенциал. Свръхекспресията на протеина p16 INK4a, оценена имунохистохимично, се счита за потвърждение на HPV инфекцията.
РЕЗУЛТАТИ: Сред 89 пациенти, първоначално включени в изследваната група, са получени диагностични резултати за 84 индивида. В пет случая или хистопатологичният материал е бил твърде оскъден, за да изолира необходимото количество ДНК, или изолираната ДНК е значително разградена, което е довело до неуспех на усилването на вътрешния контрол в рамките на предварително зададения брой от 35 цикъла. Тези пациенти бяха изключени от допълнителен анализ. Амплификацията на HPV ДНК е демонстрирана в нито една от 84-те тъканни проби; по този начин се счита, че всички случаи имат отрицателен ДНК статус на силно онкогенни подтипове на HPV. Имунохистохимичното оцветяване осигурява диагностични резултати за всички изследвани тъканни проби и изключва натрупването на протеин p16 INK4a в туморни клетки, като по този начин потвърждава липсата на активна HPV инфекция при всички индивиди.
ЗАКЛЮЧЕНИЕ: Изследването не потвърждава наличието или биологичната активност на HPV в туморните тъкани. По този начин връзката между GAC и HPV инфекцията в средноевропейското население изглежда съмнителна.
Основен съвет: Изследването има за цел да демонстрира присъствието и биологичната активност на човешкия папиломен вирус (HPV) в раковите тъкани на стомаха. Геномите на 14 HPV подтипа с висок онкогенен потенциал бяха оценени с помощта на количествена полимеразна верижна реакция в 84 туморни проби. Приложен е строг протокол за предотвратяване на замърсяването на пробите и потвърждаване на биологичната активност на вируса в туморните клетки. Изследването не потвърждава нито наличието на генома на HPV, нито вирусна активност в изследваните туморни тъкани.
ВЪВЕДЕНИЕ
Настоящото проучване имаше за цел да оцени присъствието на HPV ДНК в GAC тъканите, използвайки метода на количествена полимеразна верижна реакция (PCR) и да индиректно потвърди активна инфекция чрез демонстрация на свръхекспресия на протеин p16 INK4a, използвайки имунохистохимичния метод.
МАТЕРИАЛИ И МЕТОДИ
В проучването са участвали 89 последователни пациенти, лекувани хирургично за GAC от 2007 до 2013 г., независимо от клиничния стадий на заболяването. Критериите за включване бяха както следва: възраст> 18 години и потвърден стомашен аденокарцином. Критериите за изключване включват следното: предишна диагноза злокачествен карцином и предишна противоракова терапия (лъчетерапия, химиотерапия) за GAC. Изследвани са парафинови блокове на туморната тъкан, хистопатологична и клинична документация, позволяващи определяне на основното местоположение на лезията, хистологичен тип на тумора, хистопатологично класиране и клинично стадиране по скалата pTNM. Клиничните и хистопатологичните характеристики на пациентите, включени в проучването, са представени в таблица Таблица1 1 .
маса 1
Клинични и хистопатологични характеристики на изследваната група
| Особеност | Стойност | |
| Пол | Женски пол | 38 |
| Мъжки пол | 46 | |
| Обща сума | 84 | |
| Възраст | Медиана | 64 г. |
| Обхват | 18-85 г. | |
| Етническа принадлежност | Кавказки | 84 |
| Други | 0 | |
| Хистопатологичен тип | Аденокарцином | 84 |
| Чревен тип | 13 | |
| Лигавичен тип | 17 | |
| Тип пръстен с пръстен | 5 | |
| Хистопатологично класиране | G1 | 3 |
| G2 | 35 | |
| G3 | 46 | |
| Клинично стадиране по pTNM скала | т | Т1-7, Т2-16, Т3-51, Т4-10 |
| н | N0-23, N1-28, N2-19, N3-11, Nx-3 | |
| М | M0-62, M1-20, Mx-2 | |
Изолирането на геномната ДНК асептично от парафиновите тъканни блокове беше потвърдено с помощта на апарат Maxwell AS2000 и комплект за пречистване на ДНК Maxwell 16 FFPE Plus LEV (Promega Corporation, Medison, WI, САЩ). Чистотата на получените изолати и концентрацията на ДНК се измерват с помощта на спектрофотометър NanoDrop 2000 (Thermo Fisher Scientific, Inc. Waltham, MA, САЩ). Наличието на HPV ДНК с високо онкогенни рискови типове е потвърдено с помощта на количествен PCR (Q-PCR) анализ. Изследването използва RealTime HPV тест с висок риск (Abbott Laboratories, Abbott Park, IL, САЩ), за да открие ДНК на 14 HPV подтипа, за които се счита, че имат висок онкогенен риск. Полезността на теста при оценката на HPV състоянието във фиксирани с формалин, вложени в парафин тъканни проби е демонстрирана другаде [8,10].
Наличните в търговската мрежа отрицателни и положителни контроли (RealTime High Risk HPV Control Kit, Abbott Laboratories, Abbott Park, IL, САЩ) също бяха включени във всеки цикъл, за да се провери дали стъпките за обработка на пробата, усилване и откриване са извършени правилно. Отрицателната контрола се формулира с ДНК, съдържаща β-глобиновата последователност и поли-dA: dT като ДНК носител. Положителната контрола съдържа HPV16, HPV18, HPV58 и β-глобин последователности и ДНК носител.
Възможната биологична активност на вируса беше потвърдена имунохистохимично въз основа на натрупването на протеина p16 INK4a, причинено от инхибиране на гена на ретинобластома (pRB) от вирусния онкопротеин Е7.
Определянето на свръхекспресията на протеин р16 INK4a беше завършено на парафинови секции с дебелина 3 μm, след тяхното обезпаразитяване и рехидратация. Процедурата за извличане на антигена се извършва в разтвор за извличане на антигени (Mtm Laboratories Inc., Хайделберг, Германия) (100 mmol/L Tris, 10 mmol/L EDTA (рН 9.0), 15 mmol/L натриев азид). Наличието на р16 INK4a протеин в изследваните тъкани е установено с помощта на миши анти-човешки р16 INK4a моноклонални антитела, клон E6H4 (Mtm Laboratories Inc., Хайделберг, Германия) в готова за употреба концентрация и е визуализирано с помощта на HRP/DAB + система (Dako Дания A/S, Glostrup, Дания). Контрастното оцветяване е завършено с използване на хематоксилин според Meyer. Всяка партида беше допълнена с положителна контрола под формата на част от плоскоклетъчен карцином на сливица с известен, положителен HPV статус (демонстриращ силна и еднородна цветна реакция) и отрицателни контроли, при които първичното антитяло беше заменено с TBS буфер.
Интензивността на цитоплазмената имунохистохимична реакция беше оценена под светлинен микроскоп BX41 (Olympus Corporation, Токио, Япония) при увеличения от 100 х и 200 х, използвайки полуколичествена тристепенна скала: пълна липса на експресия на р16 INK4a в туморната тъкан; фокално оцветяване в отделени клетки; и умерена или силна цветна реакция, включваща повечето ракови клетки. Само умерена или силна цветна реакция се счита за положителен резултат.
Етично съображение
Настоящото проучване е проведено в съответствие с насоките на Декларацията от Хелзинки и нейните последващи изменения и е получено информирано съгласие от всички пациенти.
РЕЗУЛТАТИ
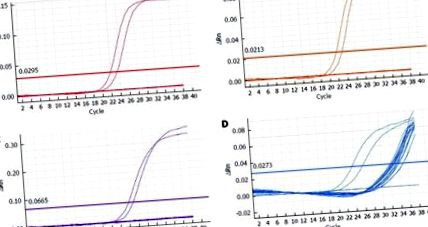
Сред първоначално включените в проучването 89 пациенти са получени диагностични резултати за 84 проби. В пет случая или хистопатологичният материал е недостатъчен за изолиране на необходимото количество ДНК, или изолираната ДНК е значително разградена, което води до неуспех на усилването на вътрешния контрол в рамките на предварително зададения брой от 35 цикъла. Тези пациенти бяха изключени от допълнителен анализ. Усилването на високорисковата HPV ДНК е демонстрирано в нито една от 84-те тъканни проби; по този начин всички случаи се считат за отрицателни (Фигура (Фигура1 1).
Представителна подгрупа от количествени полимеразни верижни амплификационни схеми за 55 пациенти, включително неинформативни случаи. A: Човешки папиломен вирус (HPV) тип 16; B: HPV тип 18; С: Един или повече подтипове от групата на 31, 33, 35, 39, 45, 51, 52, 56, 58, 59, 66, 68; D: Вътрешен контрол (β-глобин). Двете най-леви криви съответстват на положителните контроли, хоризонталната линия съответства на ΔRn праг. ΔRn: Величината на генерирания флуоресцентен сигнал.
Имунохистохимичното оцветяване осигурява диагностични резултати за всички изследвани проби и изключва натрупването на р16 INK4a протеин, потвърждавайки липсата на активна HPV инфекция при всички индивиди. В 80 случая се наблюдава пълна липса на оцветяване със специфичното анти-р16 INK4a антитяло. В останалите четири случая се наблюдава фокална, слабо изразена реакция в съседния епител, в единичен тумор или в стромални клетки; (всички тези модели на изразяване бяха класифицирани като отрицателни резултати) (Фигура (Фигура2 2).
Представителни резултати от имунооцветяване за протеин p16INK4a. A: Отрицателно имунооцветяване при стомашен аденокарцином G3; Б: Положителен за човешкия папиломен вирус плоскоклетъчен карцином на орофаринкса като положителен контрол. Скала: 200 μm.
ДИСКУСИЯ
Друг отличителен атрибут на настоящото изследване е прилагането на количествена PCR, която обхваща повече от 93% от подтиповете на високоонкогенно-рискови вируси, включително HPV16, HPV18 и дванадесет по-слабо разпространени подтипа. Аналитичните параметри на този анализ бяха точно описани [12] и полезността на HPV откриването във фиксирани с формалин, вложени в парафин тъканни проби беше демонстрирана в предишните ни проучвания [8,10] и от независими изследователи [32]. Резултатите, получени в проучването, не успяха да открият наличието на генома на HPV в GAC, което предполага, че честотата на високо онкогенно-рисков HPV в GAC тъкан е много ниска; следователно потенциалното участие на вируса в разработването на GAC е силно съмнително.
В заключение се подозира, че инфекциозни агенти като HPV играят причинно-следствена роля при различни злокачествени заболявания на човека. Настоящото проучване обаче не успя да потвърди наличието на генома на HPV, както и каквато и да е вирусна биологична активност в GAC тъканите. Следователно, всяка роля на вируса в патогенезата на GAC, поне в кавказкото население в Близкия Източна Европа, е съмнителна.
КОМЕНТАРИ
Заден план
Въпреки значителния напредък, постигнат в разбирането на епидемиологията, патологията и патогенезата на карциномите на храносмилателния тракт, ракът на стомаха остава третата водеща причина за смъртност от рак и при двата пола в световен мащаб. Най-високите нива на смъртност се наблюдават в развиващите се страни от Източна Азия и Централна и Източна Европа. Сред факторите, които могат да доведат до развитие на рак на стомаха, най-значими са следните: диета, богата на сушени и пушени месни продукти с ниско съдържание на антиоксиданти, тютюнопушене и консумация на алкохол и продължителна инфекция от бактерията, наречена Helicobacter pylori.
Изследователски граници
Някои видове човешки папиломен вирус (HPV) са доказани рискови фактори за неопластична трансформация при рак на маточната шийка, анален, орален или фарингеален, което предполага роля на вируса в патогенезата на рака на други части на храносмилателния тракт, включително рак на стомаха.
Иновации и пробиви
Предишни публикации, използващи различни техники за откриване на HPV, показват противоречиви резултати и са били ограничени главно до азиатското население. В настоящото проучване използвахме уникалната комбинация от откриване на вирусна ДНК, използвайки количествена полимеразна верижна реакция (PCR), която може да открие 14 онкогенни подтипа на вируса, и потвърждение на туморната клетъчна инфекция чрез демонстриране на промените в клетъчния метаболизъм, причинени от HPV. Използвайки този комбиниран подход, бихме могли да премахнем фалшиво положителните резултати, произтичащи от присъствието на HPV в храносмилателния тракт, без да инфектираме тъканите му. Това проучване е първото от Средна и Източна Европа, характеризиращо се с една от най-високите честоти на смъртност и смъртност. Получените резултати не потвърждават нито наличието на вирус, нито биологичната му активност в изследваните тъкани на рак на стомаха.
Приложения
Потенциалното участие на HPV в развитието на рак на стомаха, поне сред населението на Средна и Източна Европа, е силно съмнително.
Терминология
HPV представляват голяма група относително малки вируси, които съдържат ДНК като генетичен материал и могат да заразят епителните тъкани на бозайници, включително хората. Повечето HPV са доброкачествени и причиняват кожни или генитални брадавици, но подгрупа, известна като високо онкогенни подтипове, е отговорна за развитието на няколко ракови заболявания, включително рак на маточната шийка, анален и фарингеален.
Партньорска проверка
В това проучване авторите изследват наличието на високорискови HPV и експресията на p16 INK4a в кохорта от 84 стомашни ракови тъкани, използвайки RT-PCR и IHC анализ. Авторът не успя да открие HPV и p16 INK4a експресия във всички проби. Поради това те твърдят, че присъствието и ролята на високорисковите HPV в патогенезата на стомашния аденокарцином в европейска популация не са очевидни. Това изследване е интересно и е в обхвата на списанието.
Бележки под линия
С подкрепата на гранта за вътрешни изследвания на Мемориалния център за рак на Мария Склодовска-Кюри и Института по онкология, клон Гливице
P- Рецензенти: Al Moustafa AE, Duerksen-Hughes P S- Редактор: Ma YJ L- Редактор: A E- Редактор: Wang CH
- Пълнотекстови COVID-19 с хранителни вещества Връзката за възпаление и ролята на храненето в потенциал
- Хранителни вещества Без пълен текст Централната роля на желязото в човешкото хранене от народното до съвременното
- Потенциални причини за рак на панкреаса; Рискови фактори CTCA
- Ролята на храненето при пациенти с рак
- Плоскоклетъчен папилом на пикочния мехур, ендоскопски имитиращ рак