Кореспонденция на: д-р Лора I Козен-Бинкер, катедра по молекулярна и клетъчна биология, Училище по дентална медицина Henry M Goldman, Бостънски университет, 72 East Concord Street - Evans Building - стая 408, Бостън, Масачузетс 02118, САЩ. ude.ub@bcil
Телефон: + 1-617-4141084 Факс: + 1-617-4141041
Резюме
Основен съвет: В зависимост от времето и продължителността, стресът може да доведе до полезни или вредни последици. По отношение на екзокринния панкреас, предишен остър краткосрочен стрес намалява тежестта на експериментално индуцирания панкреатит. Тази защита се предоставя от различни протеини на топлинен шок (HSP), включително HSP27, HSP60 и HSP70. И обратно, хроничният стрес увеличава чувствителността на екзокринния панкреас, утежняващ епизодите на панкреатит. Тези влошаващи се ефекти се медиират главно от тумор некрозис фактор алфа.
ВЪВЕДЕНИЕ
Острият панкреатит е възпалително разстройство на панкреаса с обща смъртност приблизително 5% [1]. Етиологията на панкреатита варира, като камъните в жлъчката представляват по-голямата част от всички случаи, последвани от алкохол. Други причини за панкреатит включват травма, исхемия, механична обструкция, инфекции, автоимунни, наследствени и лекарства [2].
Основните събития, възникващи в ацинарната клетка на панкреаса, които инициират и разпространяват остър панкреатит, включват инхибиране на секрецията, вътреклетъчно активиране на протеази и генериране на възпалителни медиатори [3]. Тези клетъчни събития могат да бъдат свързани с ацинарните морфологични промени (задържане на ензимното съдържание, образуване на големи вакуоли, съдържащи както храносмилателни ензими, така и лизозомни хидролази и некроза), които се наблюдават в добре установения in vivo експериментален модел на индуциран от супрафизиологичен церулеин панкреатит [4], както и при човешки остър панкреатит [5]. Хемокините, освободени от увредени клетки на панкреаса, привличат възпалителни клетки, чието системно действие в крайна сметка определя тежестта на заболяването. В действителност, тежките форми на панкреатит могат да доведат до синдром на системна възпалителна реакция и синдром на мултиорганна дисфункция, характеризиращ се с прогресираща физиологична недостатъчност на няколко взаимозависими органни системи [6].
Стресът може да се определи като „застрашена хомеостаза“, а стресорите могат да включват физически или психически сили или комбинации от двете. Реакцията на индивид към даден стресор включва стимулиране на пътища в мозъка, водещи до активиране на оста хипоталамус-хипофиза-надбъбречна жлеза и централния симпатиков отток [7]. Това може да доведе до висцерална свръхчувствителност чрез освобождаване на различни вещества, като вещество Р и свързан с калцитонин ген пептид от аферентни нервни влакна [8].
Основният източник на инервация на панкреаса идва както от блуждаещите нерви, така и от ганглиозния комплекс на целиакия. Цефалният сегмент се инервира от десния целиакиен комплекс и чернодробния и мезентериалния плексус, идващи от десния вагус. Селезенният сегмент се инервира от левия целиакия и спланхничната нервна мрежа. С изключение на мрежата от стомашно-дуоденални клонове, по-голямата част от нервите навлизат в жлезата от нейната периферия и се концентрират в цефалния сегмент, който показва важен брой ганглиозни клетки. Тези характеристики на макроскопичната инервация намаляват значително и прогресивно към сегмента на далака [9,10].
Въпреки че е добре установено, че предишен остър краткосрочен стрес намалява тежестта на експериментално индуцирания панкреатит [11-17], влошаващите ефекти на хроничния стрес върху екзокринния панкреас са получили относително малко внимание [18-20]. Този преглед ще се фокусира върху влиянието както на остър, краткосрочен, така и на хроничен стрес при остър панкреатит.
ОСТРИ СТРЕС
Предшестващият остър краткосрочен стрес е добре известен индуктор на клетъчна защита срещу множество патологични състояния, включително бъбречна исхемия, сърдечна исхемия, мозъчна исхемия, ентероколит и панкреатит [11-17,21-25]. Излагането на организмите на първоначален сублетален стрес води до синтез на протеини на топлинен шок (HSP) и осигурява защита срещу допълнителен стрес [26]. HSP включват силно консервирано семейство протеини с молекулни размери, вариращи от 10 до 110 kDa. Тези молекулярни шаперони участват в синтеза, сгъването, транспортирането и разграждането на протеините и могат да бъдат предизвикани от стресови състояния като инфекция, възпаление, хипоксия, глад, топлинен шок, потапяне във вода и оксидативен стрес [27-29].
Други индуцирани от панкреатит модели показват някои разлики с по-горе споменатата хиперстимулация на секретагог. По този начин хипертермията предпазва от последващ остър панкреатит, индуциран от L-аргинин при плъхове чрез увеличаване на панкреатичната експресия на HSP70 и HPS27 и фосфорилиране на HSP27, но без промяна на нивата на HSP60 [15,43]. Както се наблюдава в модела на церулейн, трансгенните мишки, свръхекспресиращи HSP72, не проявяват защита за индуциран от L-аргинин остър панкреатит [37]. Свръхекспресията на HSP72 обаче не ускорява възстановяването на тъканни наранявания при животни, третирани с L-аргинин [37]. Въпреки че потапянето в гореща и студена вода индуцира съответно панкреаса HSP72 и HSP60, само потапянето в студена вода леко предпазва плъховете от индуциран от натриев таурахолат остър панкреатит, сочейки трансцендентността на субклетъчното преразпределение на катепсин В в този модел на некрохеморагичен панкреатит [13].
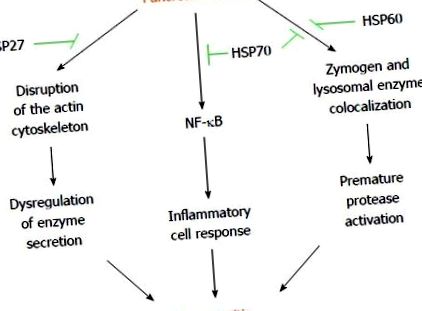
Независимо от това, предишният остър краткосрочен стрес предпазва от панкреатит чрез отделни HSP, които изглежда оказват своите благоприятни ефекти по различни пътища (Фигура (Фигура 1 1)).
Хипотетичните механизми, залегнали в основата на остър-кратък стрес, предпазват от панкреатит. Панкреатичните обиди могат да провокират дисрегулация на ензимната секреция, преждевременно активиране на протеазата и възпалителен ацинарен отговор, които водят до развитие на панкреатит. Различни стресови фактори като хипертермия, хипотермия, хипоксия, изчерпване на енергията и химикали, могат да предизвикат протеини на топлинен шок на панкреаса (HSP) чрез предварително излагане на остър кратък стрес. Различните HSP избягват нарушаването на актиновия цитоскелет, колокализацията на зимоген/лизозомния ензим и активирането на провъзпалителния ядрен фактор-каппа бета (NF-κB), причинено от панкреатичната инсулт. Тези медиирани от HSP ефекти изглежда отговорни за защитата срещу панкреатит. Конкретният път, инхибиран от всеки HSP, е изобразен в зелено.
ХРОНИЧЕН СТРЕС
Доказано е, че хроничният стрес увеличава податливостта на различни органи на плъхове, като тънките черва, дебелото черво и мозъка, към възпалителни заболявания [8,20,44-46], както и да влошава атеросклеротичните лезии при мишки [47].
Въпреки че оксидативният стрес и възпаление се появяват в панкреаса по време на ранния стадий на модел на остър панкреатит, предизвикан от супрамаксимален церулеин, нито оксидативният стрес, нито възпалителната инсулт сами по себе си причиняват характерните промени на острия панкреатит [48]. Хроничният стрес обаче оставя екзокринния панкреас податлив на панкреатит чрез субмаксимална церулеинова стимулация [20]. Панкреатичната тъкан от плъхове, хронично изложени на ограничение, показва измерими нива на фактора на възпалителния цитокинов тумор некроза α (TNF-α), както и нисък, но откриваем левкоцитен инфилтрат и миелопероксидазна активност [20], което предполага левкоцити като възможен източник на TNF -α индуциран от хроничен стрес. Интересното е, че ин витро инкубация на мишки панкреатични ацини с активирани от phorbol-12-miristate-13-acetate неутрофили или макрофаги директно индуцират вътреклетъчно трипсиногенно активиране и клетъчна смърт, като се активира протеаза и некроза, медиирана от секретиран от левкоцити TNF-α в катепсин- В и калций-зависим начин [49].
TNF-α има важна роля в различни биологични функции, включително клетъчна пролиферация, клетъчна диференциация, оцеляване, апоптоза и некроза [50] и при свързани със стреса възпалителни разстройства [45-47,51]. От дълго време е известно, че TNF-α участва в възпалителната каскада, която разпространява панкреатит [52]. Независимо от това, значението му в генезиса на тази изтощаваща болест едва наскоро привлече вниманието на изследователското разследване [20,49].
Секрецията на TNF-α от няколко стресови стимулации е демонстрирана in vitro при много видове клетки, включително ацинарни клетки на панкреаса [53-60], и in vivo в различни тъкани [47,51,61-63]. Нашата лаборатория показа, че in vitro условията за хипоксия-реоксигенация също индуцират секреция на TNF-α от ацинарни клетки [20]. Тези състояния са съпътстващи с процеси на исхемия-реперфузия, които могат да бъдат резултат от микроциркулаторни нарушения, генерирани от стрес [64]. Всъщност локалният кръвен поток на панкреаса се намалява от стрес [65]. Следователно, алтернативна вазоконстрикция и вазодилатация, водеща до тъканна исхемия и реперфузия, може да отразява друг предполагаем локален произход на хроничен стрес, получен от TNF-a, открит в панкреатичната тъкан. Това се подкрепя от увеличените нива на индуцируем фактор 1 алфа (HIF-1α) на транскрипционен фактор, наблюдаван при експериментално стресирани плъхове [20]. HIF-1α се индуцира от хипоксични състояния и участва в различни възпалителни процеси, като дерматит, ревматоиден артрит [66], а също и панкреатит [67].
Различни доклади оценяват отговора на ацинарните клетки на панкреаса към екзогенен TNF-α, показвайки нарушаване на типичното нишковидно разпределение на актина [20,68]. Подобно преразпределение на актина от апикални към базолатерални мембрани се наблюдава при ацини на панкреаса, надстимулирани с CCK [69]. Докато TNF-a сам по себе си не стимулира секрецията на амилаза в човешкия панкреас [70] или в изолирани ацини на панкреаса на плъх [20,68], той със сигурност инхибира субмаксималната CCK-стимулирана секреция на амилаза [20]. Въпреки че е необходимо, инхибирането на секрецията на панкреатичен ензим само по себе си не е достатъчно, за да предизвика панкреатит [3]. Независимо от това, TNF-α също активира панкреатичния ацинарен ядрен фактор-кВ (NF-кВ), ключов транскрипционен регулатор на експресията на възпалителни молекули [20,68,71,72]. Последователно ацинарните клетки на панкреаса на плъхове, третирани с високи дози екзогенен TNF-α, показват значително увеличение на производството на цитокини интерлевкин (IL) -1β, IL-4, IL-6, IL-10, както и TNF-α [73].
Обобщавайки тази тема, хроничният стрес се явява като рисков фактор за развитие на панкреатит чрез сенсибилизиране на екзокринната панкреаса чрез TNF-α, който изглежда оказва своите вредни ефекти по различни пътища (Фигура (Фигура2 2)).
Хипотетичните механизми, участващи в хроничния стрес, сенсибилизират към панкреатит. Хроничният стрес компрометира екзокринния панкреас, като генерира исхемия и реперфузионни процеси, както и привлича левкоцити към панкреатичния паренхим. Исхемията и реперфузията предизвикват условия на хипоксия и реоксигениране, които генерират интрапанкреатични реактивни кислородни видове (ROS), отговорни за производството на ацинарен тумор некротичен фактор-алфа (TNF-α). TNF-α, освободен от панкреатичните ацинарни клетки и левкоцитния инфилтрат, въздейства върху панкреатичните ацинарни клетки, предизвиквайки разрушаване на актиновия цитоскелет (преразпределение от апикална към базолатерална мембрана), протеин киназа С делта (PKCδ) - и PKC епсилон (PKCε) - медииран активиране на транскрипционния фактор ядрен фактор-каппа бета (NF-кВ) и повишаване на нивата на активен трипсин. Дисрегулация на ензимната секреция, индукция на възпалителен ацинарен отговор и преждевременно активиране на интраацинарна протеаза, свързано с тези патологични пътища, повишават чувствителността на екзокринния панкреас към панкреатични инсулти и увеличават риска от развитие на панкреатит.
ЗАКЛЮЧЕНИЕ
В зависимост от времето и продължителността, стресът може да доведе до благоприятни или вредни последици за екзокринния панкреас. Предшестващият остър краткосрочен стрес може да бъде полезен за високорискови процедури като ендоскопска ретроградна холангиопанкреатография. Обратно, управлението на хроничен стрес изглежда критично за пациенти с риск от панкреатит. Независимо от това, механизмите, залегнали в основата на защитата от предишен остър краткосрочен стрес, както и тежестта от хроничен стрес, трябва да бъдат допълнително проучени.
Бележки под линия
Поддържа се от KB и Associates, представляващи Certification International (United Kingdom) Limited
P- Рецензенти: Bauer P, Cosen-Binker L S- Редактор: Ma YJ L- Редактор: A E- Редактор: Liu XM