Тип на статията: Изследователска статия
Принадлежности: [a] Amen Clinics, Inc., Коста Меса, Калифорния, САЩ | [b] UC Irvine, Ървайн, Калифорния, САЩ | [c] Университет Джонс Хопкинс, Балтимор, MD, САЩ | [d] Университет и болница на Томас Джеферсън, Филаделфия, Пенсилвания, САЩ
Кореспонденция: [*] Кореспонденция на: Даниел Г. Амен, д-р, Amen Clinics, Inc., Коста Меса, Калифорния 92626, САЩ. Имейл: [имейл защитен] .
Ключови думи: Церебрална перфузия, затлъстяване, ОФЕКТ
Вестник: Journal of Alzheimer's Disease, vol. 77, бр. 3, стр. 1331-1337, 2020
Резюме
Заден план:
Докато е доказано, че затлъстяването е рисков фактор за болестта на Алцхаймер, потенциалните механизми, лежащи в основата на този риск, могат да бъдат изяснени с по-добро разбиране на основната физиология при затлъстели хора.
Обективен:
За да се идентифицират моделите на церебрална перфузионна аномалия при възрастни като функция от индекса на телесна маса (BMI), определени категории тегло, включително наднормено тегло или статус на затлъстяване.
Методи:
Голяма психиатрична кохорта от 35 442 сканирания на мозъка при 17 721 възрастни (средна възраст 40,8 ± 16,2 години, обхват 18–94 години) беше изобразена с SPECT по време на сканиране на изходно ниво и концентрация, последното направено след като всеки участник завърши Connors Continuous Performance Test II. ANOVA е направено, за да се идентифицират моделите на перфузионни аномалии в тази кохорта в обозначенията на ИТМ с поднормено тегло (резултати от ИТМ:
По време на зряла възраст по-високият ИТМ корелира с намалена перфузия както на сканиране на SPECT на мозъка в покой, така и на концентрация. Те се наблюдават на практика във всички мозъчни региони, включително тези, повлияни от патология на AD, като хипокампуса.
Заключение:
По-големият ИТМ се свързва с церебрална перфузия, намалява както при почивка, така и при концентрация на SPECT сканиране през зряла възраст.
ВЪВЕДЕНИЕ
Докато болестта на Алцхаймер (AD) е призната за най-честата причина за деменция от десетилетия [1], факторите на начина на живот все повече се признават като модификатори на риска за AD. По-специално затлъстяването в средната възраст е идентифицирано като рисков фактор за бъдеща деменция [2]. Такава връзка е важен фокус за намаляване на потенциалния риск, особено като се има предвид липсата на налични в момента ефективни лечения за БА. Въпреки това, естеството на тази връзка между наднорменото тегло или затлъстяването и риска от AD остава неизвестен. Опитите за по-добро разбиране на този въпрос при хората са използвали невровизуализацията като ключов инструмент. Предишна работа показа, че загубата на обем на мозъка, свързана с наднорменото тегло и затлъстяването, може да се припокрива в същите региони, насочени към патологията на AD, като хипокампуса [3]. Тези промени са демонстрирани дори при когнитивно нормални индивиди, както и при хора с леко когнитивно увреждане и AD [4, 5].
Регионалният мозъчен кръвен поток също се използва за проследяване на свързани със затлъстяването мозъчни аномалии. Например, едно вокселно базирано еднофотонно излъчване на компютърна томография (SPECT) показва хипоперфузия, свързана с индекса на телесна маса (ИТМ) [6] при пенсионирани играчи на Националната футболна лига. Смята се, че затлъстяването насърчава хипоперфузията чрез насърчаване на хипертрофично вътрешно ремоделиране на церебралната васкулатура [7]. Структурни промени в мозъка също са докладвани при успешни диети [8]. Загубата на тегло също е показана в систематичен преглед, свързан със затихване на когнитивния спад [9].
Функционалното невроизображение остава важен ресурс при идентифицирането на потенциалните рискови фактори за деменция [10], както и свързаните с възрастта промени [11]. Преди това използвахме функционално невроизображение SPECT, за да прегледаме и идентифицираме модели на аномалии, свързани с диагностиката на травматично мозъчно увреждане [12, 13], класификация на депресията срещу деменция [14], влияния, свързани с марихуаната в мозъка [15], омега-3 свързаните с мастни киселини подобрени церебрални кръвни потоци [16], свързаните с пола разлики в мозъка [17] и стареенето на мозъка [18]. Тази работа е извършена с количествен подход в интересуващи региони със знания за психиатричните съпътстващи заболявания за използване при многопроменливо статистическо моделиране. Целта на настоящата работа е да идентифицира потенциални аномалии на мозъчната перфузия при възрастни, свързани с наднормено тегло или затлъстяване.
МАТЕРИАЛИ И МЕТОДИ
Субекти
Субектите бяха взети от множество клонове на клиниките Amen, както е описано в предишната работа [19]. Одобрението на IRB за ретроспективен анализ на неидентифицирани клинични и SPECT данни за сканиране е предоставено от акредитиран институционален съвет за преглед, IntegReview (IRB # 004; http://www.integreview.com/). Критериите за включване бяха разширени, за да обхванат най-голям брой субекти за анализ за модели на ИТМ през целия живот и в различни психиатрични и неврологични диагнози. Някои пациенти са имали повече от една диагноза. Демографията на предмета е подробно описана в таблица 1.
маса 1
Демография на предмета (общо н = 17721; 35442 сканирания)
| Променливи | Статистика (χ ± σ, |
| Обхват, процент (н)) | |
| Възраст | 40,8 ± 16,2, Възраст 18–94 |
| Възрастова група (възрастни/гериатрични) | 90,9 (33558) /9,1 (3345) |
| Пол мъж жена) | 60,6 (18925) /39,4 (12296) |
| Индекс на телесна маса | 25,2 ± 6,2, (10,9–82,9) |
| Хранителни разстройства | 2,7 (481) |
| Всички причиняват деменция | 6,2 (1151) |
| (Включително AD) | |
| ADHD | 51,1 (9055) |
| Голяма депресия | 17,5 (3107) |
| Биполярно разстройство | 7,4 (1313) |
| Генерализирано тревожно разстройство | 56,5 (10006) |
| Травматично нараняване на мозъка | 43,5 (7700) |
| Шизофрения | 2,4 (427) |
| Нарушение на употребата на алкохол | 5,8 (1034) |
| Нарушение на употребата на канабис | 3,8 (682) |
Образ на мозъчен SPECT
Статистически анализ
Всички статистически анализи бяха проведени с помощта на SPSS (Версия 26, IBM, Armonk, NY). Първо, връзката между ИТМ като функция от поднорменото тегло (ИТМ РЕЗУЛТАТИ
Резултатите от ANOVA са подробно описани в Допълнителен материал 1 за изходна перфузия и Допълнителен материал 2 за перфузионна концентрация.
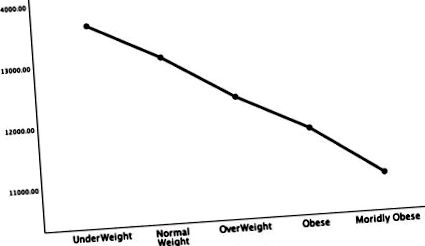
Фигури 1–5 подробно описват резултатите от ANOVA на изходната перфузия на всички участници като функция на влошаване на наднорменото тегло и затлъстяването в няколко области от ключово значение за АД: темпорални лобове (фиг. 1), теменни лобове (фиг. 2), хипокампус (фиг. 3), заден цингулат (фиг. 4) и прекунеус (фиг. 5).
Фиг. 1.
Области на свързана със затлъстяването хипоперфузия в мозъчни региони, уязвими към болестта на Алцхаймер: темпорални лобове.
Фиг. 2.
Области на свързана със затлъстяването хипоперфузия в мозъчни региони, уязвими към болестта на Алцхаймер: теменни лобове.
Фиг. 3.
Области на свързана със затлъстяването хипоперфузия в мозъчни региони, уязвими към болестта на Алцхаймер: хипокампус.
Фиг. 4.
Области на свързана със затлъстяването хипоперфузия в мозъчни региони, уязвими към болестта на Алцхаймер: заден цингулат.
Фиг. 5.
Области на свързана със затлъстяването хипоперфузия в мозъчни региони, уязвими към болестта на Алцхаймер: прекунеус.
Във всяка фигура оста y изразява очакваната перфузия като брой/пиксел, а оста x показва категориите тегло според BMI. Обобщавайки тези данни, най-забележителният модел във почти всички мозъчни региони е спадът в церебралната перфузия при прогресия от поднормено тегло към нормално, наднормено тегло и след това до категории затлъстяване. Този модел е съгласуван независимо дали се сравняват изходни сканирания или сканиране на концентрация при теглови групи. Няма региони, които показват повишена перфузия във връзка с по-висок ИТМ.
Фигура 6 показва прогресивното намаляване на изходната перфузия в покой в сравнение с трима различни мъже на същата възраст с нормален, с наднормено тегло и затлъстяване ИТМ.
Фиг. 6.
Тази цифра показва триизмерни изображения на резидентната перфузия, осреднени за нормалния ИТМ (ИТМ = 23), наднорменото тегло (ИТМ = 29) и мъжете със затлъстяване (ИТМ = 37), всеки на 40-годишна възраст.
Таблица 2 показва частичните корелации между ИТМ и изходната перфузия, съобразена с възрастта, пола и съпътстващите заболявания, включително съпътстващите заболявания на психиатрията.
Таблица 2
Частични корелации на ИТМ и начална перфузия на мозъка в региони, уязвими към болестта на Алцхаймер
| Мозъчни региони | ИТМ | |
| Базова линия | Корелация | –0,218 |
| _Temporal_Lobe | ||
| Значимост (2 опашки) | ДИСКУСИЯ |
Интервенциите за подобряване на здравето на мозъка се извеждат предимно от проучвания за превенция на AD. Едно проучване, наречено Финландско проучване за гериатрична интервенция за предотвратяване на когнитивно увреждане и увреждане (FINGER), използва многостранен подход за контрол на съдовите рискови фактори, включително управление на теглото, за подобряване на скоростта на обработка и глобалното познание [26]. Друго рандомизирано контролирано проучване при 120 възрастни среден живот показва, че аеробната физическа активност подобрява обема на хипокампа в сравнение с групата за пасивно разтягане [29]. Моделите на здравеопазването на мозъка включват внимание към физическата активност, управлението на теглото и лечението на психиатрични разстройства, които повишават риска от АД, като депресия [30]. В този контекст изобразяването на церебрална перфузия може да осигури биомаркер за оценка дали програмите за отслабване в средата на живота подобряват този показател и бъдещия риск за АД.
Влиянието на затлъстяването върху мозъчната перфузия остава статистически значимо въпреки приспособяването към психиатрични разстройства. Този резултат предполага, че основните ефекти на психиатричните разстройства и затлъстяването върху мозъка са независими. Връзката на затлъстяването в мозъчната физиология може да възникне чрез няколко механизма. Единият е чрез невровъзпаление и неговото влияние върху перфузията. Затлъстяването е известно системно провъзпалително състояние [31]. Невроинфламацията е свързана с церебрална хипоперфузия чрез пътища, които включват TREM-2 [32], биомаркер за невроинфламация, също отбелязан в AD [33]. По този начин, хроничното затлъстяване и свързаното с него системно възпаление предизвикват в резултат невро възпаление и хипоперфузия. Промените в нивата на половите хормони при затлъстяване могат също да доведат до промени в церебралната перфузия. Бъдещите изследвания могат допълнително да изследват специфични фактори, свързани с тези механизми.
По-рано показахме, че депресията и деменцията имат различими модели на перфузионни аномалии при SPECT невроизобразяване [14]. Изследване на мозъчен SPECT при късно настъпила шизофрения показва двустранна постцентрална хирусна перфузия; същото проучване показва намалена церебрална перфузия в прецентралния и долния фронтален гирис [34]. Шизофренията и алкохолната зависимост също са свързани независимо с по-ниски обеми на хипокампала [35, 36]. Травматичното мозъчно увреждане също е свързано с ниска церебрална перфузия [12], но в кохорта от пенсионирани национални футболисти, страдащи от хронични повтарящи се мозъчни сътресения, ИТМ също независимо свързани с долната церебрална перфузия [6].
Като цяло открихме силен набор от връзки между наднорменото тегло и затлъстяването и мозъчната хипоперфузия в голяма кохорта за възрастни, обхващаща млади възрастни до късен живот. Устойчивостта на тези аномалии, въпреки че се приспособява към демографските и психиатрични фактори, допълнително подчертава необходимостта от справяне със затлъстяването като цел за интервенции, предназначени за подобряване на мозъчната функция, независимо дали са инициативи за превенция на AD или опити за оптимизиране на познанието при по-младите популации. Подобна работа ще бъде от решаващо значение за подобряване на резултатите от тези групи.
- Затлъстяването повишава кръвното налягане, ремоделирането на мозъчните съдове и тежестта на инсулта в
- Връзка на пулса в покой с телесния състав и затлъстяването сред младите възрастни в Индия -
- Метаболитното здраве е по-тясно свързано с намаляване на белодробната функция, отколкото затлъстяването
- Преобладаване на наднорменото тегло и затлъстяването при възрастни в избрани държави 2015 Statista
- Броят на недохранените хора намалява в Индия; затлъстяване при възрастни във възход. Световните новини на ООН,