Резюме
Коремното затлъстяване е основен рисков фактор за инсулинова резистентност, диабет тип 2 и сърдечно-съдови заболявания. Диетичните мазнини предизвикват инсулинова резистентност при хора и гризачи. Настоящото проучване изследва дали добавка хлорогенова киселина/хром III спасява затлъстяването и инсулиновата резистентност, причинени от хранене с високо съдържание на мазнини на мъжки мишки C57BL/6 J в продължение на 7 седмици. Прилагането на перорална дневна доза от тази добавка през последните 3 седмици на хранене обърна повишеното телесно тегло, предизвикано от диета, и инсулинова резистентност, оценено чрез хипергликемия, глюкозна непоносимост и инсулинова непоносимост. Индиректният анализ на калориметрията разкрива, че този ефект се медиира поне частично, чрез увеличаване на енергийните разходи и спонтанната локомоторна активност. Тези открития подчертават важната роля, която хлорогеновата киселина и хромът играят за поддържане на метаболизма на глюкозата и инсулиновия отговор при мишки, хранени с диета с високо съдържание на мазнини.
Заден план
Разпространението на висцералното затлъстяване непрекъснато се увеличава в световен мащаб. В момента по-голямата част от американците са с наднормено тегло и близо 35% са със затлъстяване [1, 2]. Тъй като коремното затлъстяване представлява повишен риск от развитие на диабет тип 2 и мастна чернодробна болест, които се разпространяват с епидемия [3], стана наложително да се разработят средства, които лесно да бъдат въведени в нашето ежедневие, за да се борим ефективно с разпространението на това болест.
Коремното затлъстяване обикновено се свързва с периферна инсулинова резистентност, отличителен белег на метаболитния синдром и свързаните с него заболявания. Периферната инсулинова резистентност е многофакторна и се проявява с хиперинсулинемия и произволна хипергликемия в допълнение към непоносимост към глюкоза и инсулин [4]. Причинно-следствената връзка между затлъстяването и инсулиновата резистентност е обект на интензивно разследване. Широко прието е, че увеличаването на калоричната тежест насърчава съхранението на липидите в бялата мастна тъкан (WAT), причинявайки висцерално затлъстяване, последвано от инсулинова резистентност. Индуцираната с диета инсулинова резистентност се медиира от няколко механизма, включително освобождаването на получени от WAT мастни киселини и адипокини, които притъпяват инсулиновата сигнализация и причиняват извънматочна липотоксичност и системно провъзпалително състояние [5]. Това също намалява освобождаването на адипонектин от WAT, събитие, което допринася за състоянието на инсулинова резистентност, причинено от приема на високо съдържание на мазнини [6].
Взаимно няколко лаборатории, включително нашата, са докладвали за метаболитните и сърдечно-съдовите ползи от ограничаването на калориите и упражненията при хора и модели на метаболитен синдром при плъхове [7–9]. Въпреки това изобилието от хранителни продукти и по-предпочитаният заседнал начин на живот превърнаха загубата на тегло в постоянно предизвикателство за жителите на индустриализирания свят. През последните години са разработени голям брой напитки и храни, съдържащи безкалорични или нискокалорични (например изкуствени или несмилаеми) подсладители. Те обаче не успяха да контролират ефективно загубата на телесно тегло поради сложни системи за обратна връзка с тялото, които в крайна сметка могат да стимулират апетита за храна и прекомерния прием на калории [10, 11].
Полифенолите, съдържащи естествени продукти, оказват антидиабетно действие [12]. Кафето съдържа най-високата концентрация на полифеноли сред другите напитки [13]. Хлорогеновата киселина (CGA) е фенолен метаболит, извлечен от някои растителни видове, като напр Coffea Canephora Pierre (известен като зелено кафе на зърна). CGA има много биологични свойства (т.е. антиоксидант) [14] и сенсибилизиращи инсулина дейности [15]. Той също така намалява хипергликемията чрез няколко механизма [16]. Те включват стимулиране на глюкагон-подобен пептид 1-медиирана секреция на инсулин [17] и активиране на AMP-зависима киназа за насърчаване на транслокацията на глюкозен транспортер 4 към плазмената мембрана за усвояване на глюкоза [18].
И все пак, повишената консумация на кафе само може да бъде противодействаща при някои индивиди, тъй като кофеинът може да причини лишаване от сън, което от своя страна причинява затлъстяване и инсулинова резистентност [19–21]. По този начин кафето е допълнено с CGA и хром III (CrIII), бързо абсорбираща се хромова форма с противовъзпалителен ефект [22], за да се изследва дали тази формула CGA/Cr обръща метаболитните аномалии, индуцирани от диета с високо съдържание на мазнини в C57BL/6 J (BL6) мишки, животински модел, който реагира метаболитно на хранителни мазнини като хората [23]. Тук демонстрираме, че допълването на диетата с ежедневно орално измерване на CGA/Cr в продължение на 3 седмици обръща предизвиканото от диетата затлъстяване, хипергликемия и инсулинова резистентност и че това се медиира поне отчасти чрез увеличаване на енергийните разходи и предизвикване на спонтанна физическа активност.
Методи
Животни и хранене
Мъжки мишки C57BL/6 J (BL6) (на възраст 3 месеца) бяха хранени ad libitum или стандартна редовна диета (RD), произвеждаща 12: 66: 22% калории от мазнини: въглехидрати: протеин, или диета с високо съдържание на мазнини (HF), произвеждаща 45: 35: 20% калории от мазнини: въглехидрати: протеин (D12451, изследвания Диети, Ню Брънзуик, Ню Джърси). Съставът на мастните киселини при HF диета беше 36: 45: 19% наситени (SFA): мононенаситени (MUFA): полиненаситени мастни киселини (омега-6 PUFA). Мишките бяха държани в 12-часов цикъл на тъмно/светло и Институционалният комитет за грижи и използване на животните одобри всички процедури.
Лечение
Мишките бяха хранени с HF или RD в продължение на 7 седмици. През последните 3 седмици на хранене, RD-хранените мишки бяха третирани само с вода, докато HF-хранените мишки бяха третирани с вода, CGA/Cr добавка или само с CGA. Добавката CGA/Cr съдържа основен кофеин [0,1 mg/мишка/ден кофеин (Boresha International Inc.), 0,1 mg/мишка/ден витамин С (Sigma-Aldrich, Сейнт Луис, Мисури) и 5,13 mg/мишка/ден фруктоза (Sigma-Aldrich)] в допълнение към 2,3 μg/мишка/ден хромов диникоцистеинат (Cr) (Inter Health, Benecia, CA) [24] и 0,21 mg/мишка/ден безкофеинова фенол-хлорогенова киселина, съдържаща 3-O-кофеилхинова киселина (3-CQA), 4-CQA и 5-CQA (Naturex SA, Авиньон, Франция) [25]. Хромът беше отстранен от добавката, обозначена като CGA самостоятелно. Дозите са подобни на тези, използвани при хора, коригирани до 40 g телесно тегло/мишка. Мишките са гладували ежедневно в продължение на един час, преди да бъдат подложени на 1500 h еднократно дневно орално измерване на 0,5 ml вода, CGA или CGA/Cr, като се използва захранваща тръба. Подходът на гладно и използване на 0,5 ml е създаден, за да се избегнат стремежите.
Интраперитонеален тест за инсулинов толеранс
Както беше описано по-рано [26], мишките са гладували в продължение на 7 часа, започвайки от 700 часа. Човешки инсулин Novolin (Novo Nordisk NDC 0169-1833-11) се прилага интраперитонеално (IP) при 0.75 U/kg телесно тегло на будни мишки. Кръвната глюкоза се измерва от опашната вена чрез отрязване на опашката при 0–180 минути след инжектиране след инсулин. Нивата на глюкоза са изразени като процент към нивата на гладно.
Тест за толерантност към перитонеална глюкоза
Както беше описано по-рано [26], мишките бяха на гладно цяла нощ (от 1700 до 800 часа на следващия ден) и глюкозата се прилага IP при 1,5 g/kg BW (50% разтвор на декстроза) за събуждане на мишки. Нивото на глюкоза в кръвта (mg/dl) беше измерено от вената на опашката при 0–120 минути след инжектиране на глюкоза.
Непряк калориметричен анализ
Непряката калориметрия и приемът на храна бяха оценени в индивидуално затворени клетки (система CLAMS, Columbus Instrument, Columbus, OH) мишки, будни в края на периода на лечение (н = 4/група), в продължение на 3-дневен период след като се аклиматизира за 2 дни, както е описано [27]. Мишките имаха достъп до храна и вода ad libitum. Спонтанната локомоторна активност се измерва с оптичен лъч, измерващ хоризонтално и вертикално движение (ос XYZ). Консумацията на кислород (VO2) и производството на CO2 (VCO2) се вземат на проби на всеки 30 минути. Данните бяха представени като средни ± SEM на светлинни (600-1800 h) и тъмни (1800 h-600 h) цикли.
Статистически анализ
Използвайки софтуера GraphPad Prism 4, данните бяха анализирани с еднопосочен дисперсионен анализ (ANOVA) с корекция на Bonferroni във всички фигури, с изключение на данните на фиг. 1, които бяха анализирани чрез студентски t-тест. P Фиг. 1
Резултати
Добавките CGA/Chromium III и CGA обръщат затлъстяването, предизвикано от диета
Както показва Фиг. 2, храненето на мишки с богата на мазнини диета (HF) в продължение на 4 седмици води до увеличаване на телесното тегло спрямо мишките, хранени с редовна диета (RD) (тъмни кръгове спрямо бели квадратчета). Добавката с CGA/Cr (сиви кръгове) и CGA (излюпени кръгове) предотвратява по-нататъшното увеличаване на телесното тегло и вместо това го намалява значително в рамките на 2 седмици, докато достигне ниво, сравнимо с това, което се поддържа при нормална нормална диета за 7 седмици (фиг., сиви и излюпени кръгове спрямо бели квадрати).
Ефект на добавката CGA/Chromium III върху телесното тегло. Мъжки мишки BL6 (на възраст 3 месеца) са били хранени редовно (RD) (квадрати) (н = 7 мишки) или диета с високо съдържание на мазнини (HF) (кръгове) (н = 23 мишки) за 1 месец. След това HF-хранени мишки бяха подложени (прекъсната вертикална линия) на обработка със сонда веднъж дневно в продължение на 3 седмици с всеки носител (вода) (черни кръгове, н = 7 мишки), CGA (излюпени кръгове, н = 8 мишки) или CGA/Chromium III (CGA/Cr) (сиви кръгове, н = 8 мишки). RD-хранени мишки (н = 7) е претърпял сонда само с вода. Мишките продължават да имат пълен достъп до същите диети по време на периода на лечение. Телесното тегло се измерва седмично през периода на лечение. Стойностите се изразяват като средна стойност ± SEM. *P † спрямо HF-вода
CGA/Chromium III добавка обърна всички метаболитни аномалии, предизвикани от диета с високо съдържание на мазнини
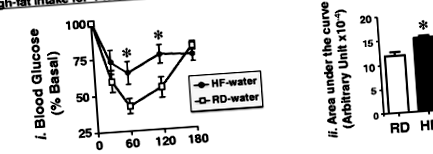
В допълнение към затлъстяването (фиг. 2), 4 седмици високочестотна диета причиняват инсулинова резистентност, както се вижда от повишена непоносимост към екзогенен инсулин спрямо мишки, хранени с RD (фиг. 1),i черни кръгове спрямо бели квадрати и фиг. 1,ii в придружаващата гистограма, изобразяваща площта под кривата (AUC): 14287 ± 458 в HF-вода (черна лента) срещу 11182 ± 691,9 произволни единици (au) в RD-вода (бяла лента); P Фиг. 3
CGA/Chromium III добавка Бордюри Диета-индуцирани метаболитни аномалии. Мишките се хранеха в продължение на 4 седмици с RD (квадрати) или HF (кръгове), преди да получат орален сондаж с вода (черни кръгове), CGA самостоятелно (излюпени кръгове) и CGA/Chromium III (CGA/Cr) (сиви кръгове), веднъж всеки ден, тъй като те продължават да се хранят със същата диета за допълнителни 3 седмици, както е в легендата към фиг. 2. В края на лечението мишки (н = 7-8 за всяко третиране на група за хранене) са били подложени на: а интраперитонеален инсулинов толеранс за оценка на изхвърлянето на глюкоза след 0–180 минути след инсулинова инжекция, б интраперитонеален тест за толерантност към глюкоза за изследване на изхвърлянето на глюкоза след 0–120 минути след инжектиране на глюкоза и (° С) хранени нива на глюкоза в кръвта. За (a-b), площта под кривата (AUC) беше измерена от всяка графика и представена в стълбовидните графики (панели ii) вдясно от всяка графика в (а) и (б). Стойностите се изразяват като средна стойност ± SEM. *P † срещу HF-вода (черни ленти) и § срещу HF-CGA (излюпени решетки)
Продължителната високочестотна диета причинява непоносимост към глюкоза спрямо храненето с RD [Фиг. 3б,i- черни кръгове спрямо бели квадрати и фиг. 3б,ii- AUC: 34706 ± 2906 в HF-вода (черна лента) срещу 24434 ± 1929 au в RD-вода (бяла лента); P Фиг. 4
Непряк калориметричен анализ. В края на периода на лечение мишките бяха поставени индивидуално в калориметрични клетки (н = 4/група за лечение) със свободен достъп до храна и вода в продължение на 2 дни, за да се аклиматизира, последвано от непряк калориметричен анализ за 24-часов период в продължение на 3 дни за измерване: а Прием на храна (храна g/мишка/ден), б Разходи за енергия (kcal/h/kg BW), и ° С Спонтанна локомоторна активност (събития/час) във всеки от светлинния (от 600 до 1800 часа) и тъмния (от 1800 до 600 часа - засенчен в сиво) цикъл. Стойностите се изразяват като средна стойност ± SEM за всеки интервал от време през последните 3 дни. * P † срещу HF-вода (черни ленти)
Дискусия
Затлъстяването е глобална епидемия и основен рисков фактор за метаболитни и сърдечно-съдови заболявания. Диетичните мазнини са ключов фактор за индуцирането на инсулинова резистентност при хора [28] и мишки [29]. Настоящите проучвания целят да определят ефекта на добавката CGA/Cr, съдържаща хлорогенова киселина, върху индуцираното от диетата наддаване на телесно тегло и инсулиновата резистентност при BL6 мишки. Тук показваме, че формулата CGA/Cr обръща наддаването на телесно тегло в допълнение към непоносимостта към инсулин и глюкоза при мишки, хранени с диета с високо съдържание на мазнини. Изглежда, че този ефект се опосредства, поне отчасти, чрез увеличаване на спонтанната локомоторна активност и енергийните разходи.
Трябва да се отбележи, че CGA/Cr не увеличава приема на храна, както би се очаквало от понижаващия глюкозата ефект на CrIII и от добавянето на фруктоза, ниско гликемичен въглехидрат, който не стимулира значително освобождаване на хормони на ситост като инсулин и лептин [37, 38]. Въпреки преобладаващите противоречия около отрицателния метаболитен ефект на фруктозата при хора и мишки [39], този въглехидрат не изглежда да регулира общите защитни ефекти на формулата CGA/Cr, използвана в нашите проучвания. Възможно е използваната ниска доза фруктоза (
0,125 mg/kg телесно тегло) ограничава неговия неблагоприятен метаболитен ефект, по-специално в присъствието на CGA, който може обратно да преодолее неговия отрицателен ефект [40].
Както се очаква, индиректният калориметричен анализ показва, че храненето с високо съдържание на мазнини намалява приема на храна, енергийните разходи и физическата активност в сравнение с мишките, хранени с редовна диета. Добавянето на CGA/Cr възстановява енергийния разход и физическата активност на HF-хранени мишки, без да влияе на приема на храна. Този термогенен ефект на CGA/Cr е вероятно да се дължи на CGA [30] и на кофеина [41]. Основните молекулярни механизми не са известни, но полифенолите индуцират CEACAM1 [42], протеин, който насърчава инсулиновата чувствителност, като медиира инсулиновия клирънс в черния дроб [43]. Наблюдавахме, че диетата с високо съдържание на мазнини намалява CEACAM1 и че трансгенната свръхекспресия на CEACAM1 в черния дроб предотвратява отрицателния ефект на диетата с високо съдържание на мазнини върху енергийните разходи и физическата активност при мишки [44]. По този начин е разумно да се предположи, че индуцирането на чернодробен CEACAM1 от полифеноли допринася за възстановяването на инсулиновата чувствителност, енергийните разходи и спонтанната локомоторна активност, причинени от CGA/Cr приложението. Възможно е също така прилагането на тази формулировка да увеличи спонтанната физическа активност и енергийните разходи (чрез активиране на симпатиковия нервен отток към мастната тъкан) и това от своя страна да стимулира инсулиновата чувствителност [27].
В обобщение, настоящите проучвания предоставят доказателства, че тази формула на базата на кофеин CGA/Chromium III ограничава неблагоприятния ефект на диетата с високо съдържание на мазнини върху телесното тегло и действието на инсулина при мишки. Като се има предвид, че метаболитният отговор на мишките BL6 на диета с високо съдържание на мазнини симулира този на хората, данните предполагат, че тази формула CGA/Chromium III може да служи като обещаваща хранителна добавка за улесняване на контрола на теглото с консумация на диета, обогатена с мазнини Необходими са повече изследвания, за да се изследват основните молекулни и клетъчни механизми. Независимо от това, настоящият доклад демонстрира важната роля на увеличения разход на енергия и физическата активност чрез ежедневна консумация на CGA/Chromium III за предотвратяване на наддаване на телесно тегло и инсулинова резистентност в отговор на приема на високо съдържание на мазнини.
Заключения
Тук идентифицираме състава на базата на кофеин CGA/Chromium III, който ограничава неблагоприятния ефект на диетата с високо съдържание на мазнини върху телесното тегло и действието на инсулина при мишки. Това отчасти се осъществява чрез запазване на енергийните разходи и спонтанната физическа активност.
- Упражнявайте стареенето, като играете важна роля за смъртността, затлъстяването и инсулиновата резистентност
- Cideb регулира индуцираното затлъстяване, чернодробната стеатоза и инсулиновата чувствителност чрез контрол
- Ефекти от хранителните добавки с женшен върху затлъстяването, предизвикано от диета с високо съдържание на мазнини, при мишки C57BL6 -
- ГМ соевото масло причинява по-малко затлъстяване и инсулинова резистентност, но е вредно за чернодробната функция Мишка
- Мишките с дефицит на глицерол-3-фосфат ацилтрансфераза-4 са защитени от индуциран от диета инсулин