Дейвид Л. Проктор
Катедра по химия и химическа биология, Лаборатория Бейкър, Университет Корнел, Итака, Ню Йорк 14853-1301
Х. Флойд Дейвис
Катедра по химия и химическа биология, Лаборатория Бейкър, Университет Корнел, Итака, Ню Йорк 14853-1301
Принос на автора: D.L.P. и H.F.D. проектира изследвания, извършва изследвания, анализира данни и пише статията.
Резюме
Реакцията Y + CH4 → HYCH3 → YCH2 + H2 се инициира чрез вмъкване на C – H, включваща 20 ± 3 kcal/mol бариера с потенциална енергия. Реакцията се изследва в кръстосани молекулярни лъчи при две различни условия с почти еднаква обща енергия. Единият експеримент се провежда при енергия на сблъсък 15,1 kcal/mol с един квант CH4 антисиметрично (ν3) разтягащо вибрационно възбуждане (8,63 kcal/mol), а другият при енергия на сблъсък 23,8 kcal/mol. Установено е, че напречното сечение на реакцията за C-H възбуден метан (σs) е поне коефициент 2,2 пъти по-голям от този за основния метан (σg) при същата обща енергия.
Концепциите за ранните и късните потенциални енергийни бариери направиха възможно рационализирането с прости, интуитивни термини на ролите на реактивната транслационна и вибрационна енергия при насърчаването на реакциите атом + диатомом (1). Наблюдението на специфичните за режима и връзката ефекти в реакциите на газова фаза, като Cl + CH4 → HCl + CH3 и Cl + H2O → HCl + OH, илюстрира, че динамиката на многоатомните системи, включващи множество вибрационни степени на свобода, също може да бъде силно чувствителна към вибрационното състояние на реагента (2, 3).
В неотдавнашно проучване Ян и колеги осигуриха първото директно сравнение на вибрационната енергия на реагента C – H с транслационната енергия на реагента при насърчаване на реакцията на абстракция на Cl + CHD3 → HCl + CD3 (4). Въпреки че C – H антисиметричното вибрационно възбуждане повишава реактивността, беше установено, че е малко по-малко ефективно от еквивалентно количество реактивна транслационна енергия. Възбуждането на огъване на CHD3, предизвикано от термично възбуждане, е малко по-ефективно за стимулиране на реакцията, отколкото еквивалентно количество транслационна енергия. За газообразни многоатомни системи различните форми на реактивна енергия може да не са еквивалентни при улесняването на преминаването през преходното състояние за пренос на атоми (2–5).
Активирането на въглеводородни C-H връзки от комплекси на преходни метали е тема от значителен текущ интерес (11, 12). Погледът върху факторите, контролиращи кинетиката и термодинамиката на тези процеси, е получен чрез теория на електронната структура (13). За съжаление, наличието на множество лиганди в комплексите на преходни метали затруднява теоретичните изчисления. Следователно, бяха положени значителни усилия за извършване на изчисления на моделни системи, включващи вмъкване на изолирани атоми на преходни метали в връзки C – H и C – C (14, 15). Интересното е, че неотдавнашната теоретична работа върху динамиката на дисоциативната адсорбция на метан върху повърхности Ir (111) (16) и Ni (111) (17) показва, че металната решетка претърпява реконструкция по време на реакция, като локален повърхностен метален атом претърпява значително ( 0,6 Å) изместване навън от повърхността. Разбирането на реактивността на изолирани атоми на преходни метали с метан може по този начин да даде представа за процеса на дисоциативна адсорбция.
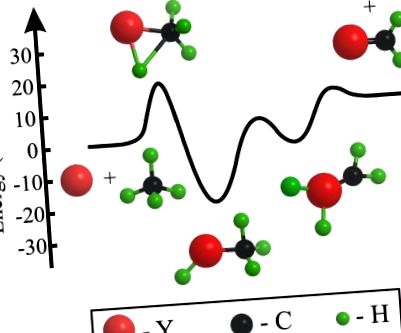
Схематична диаграма на енергийното ниво за реакция Y + CH4 → YCH2 + H2.
Резултати
Проведохме експерименти с реактивно разсейване на кръстосани молекулни лъчи между Y атоми и основно състояние CH4 при скорости на лъча, осигуряващи 23,8 ± 1,5 kcal/mol транслационна енергия и между Y и CH4 (ν3 = 1) при скорости на лъча, осигуряващи 15,1 ± 0,9 kcal/mol транслационни енергия. Фигура 2 показва общото разпределение на енергията на реактанта за двата комплекта експерименти. Вибрационната енергия във втория експеримент, осигурена от поглъщане на 3018 cm -1 фотон, произведен от инфрачервен оптичен параметричен осцилатор (OPO), прави общата енергия по същество идентична при всеки експеримент. Масово избраните разпределения по време на полет (TOF) на YCH2 реакционните продукти бяха записани под няколко лабораторни ъгъла спрямо гредите и за двата експеримента. Изчислените разпределения на TOF на базата на итеративно коригирани транслационни енергийни и ъглови разпределения на продукта на рамката на центъра на масата (CM) се приспособяват към данните чрез използване на пряка конволюция спрямо известни разпределения на скоростта на лъча и функции на инструмента.
Функция за разпределение на вероятностите за общата реактивна енергия в експериментите „OPO Off“ и „OPO On“. В експериментите OPO Off цялата реактивна енергия е транслационна; в OPO При експерименти, общата енергия на реагента включва 8,63 kcal/mol вибрационно възбуждане в вибрационния режим на антисиметрично разтягане (ν3) CH4.
Фигура 3 показва лабораторното ъглово разпределение на продуктите YCH2 при 23,8 kcal/mol енергия на сблъсък, както и разпределението на транслационната енергия на CM, използвано в приспособлението. Ъгловото разпределение на CM, T (θ), е изотропно, както се очаква за реакция, включваща комплекси с продължителност на живота, по-голяма от техните ротационни периоди. Фигура 4 показва разпределенията на TOF за продуктите YCH2. При тази енергия на сблъсък (т.е. над бариерата), реакцията на основното състояние CH4 води до образуване на YCH2 + H2, като транслационната енергия на продукта P (E) достига пик близо 3 kcal/mol и се простира до 11 kcal/mol, с 〈P (E)〉 = 3,6 kcal/mol. TOF и лабораторното ъглово разпределение за енергията на сблъсъка 15,1 kcal/mol с вибрационно възбуждане са подходящи, като се използва същото ъглово разпределение P (E) и CM и изглеждат подобни.
Лабораторно ъглово разпределение с маркиран ъгъл на разсейване на центъра на масата и разпределение на транслационното освобождаване на енергия на продукта, P (E) за Y + CH4 → YCH2 + H2 при Ecoll = 23,8 kcal/mol при изключен OPO. Данните в черно, пасват в червено и лентите за грешки са 90% доверителни интервали.
Лабораторно разпределение на времето на полет за продукти YCH2 при посочени лабораторни ъгли с изключен OPO. Запълнените кръгове означават експериментални данни и плътната линия се изчислява разпределение, като се използва P (E) от фиг. 2 и изотропно ъглово разпределение на центъра на масата T (θ). Данните в черно, пасват в червено и лентите за грешки са 90% доверителни интервали.
Установихме, че напречното сечение на реакцията се повишава рязко с реагираща енергия на сблъсък. Зависимостта на реактивния сигнал от енергията на сблъсъка поставя потенциалната енергийна бариера за реакция при 20 ± 3 kcal/mol. Несигурността в тази стойност е резултат предимно от разпространението на енергиите на сблъсъка за всеки експеримент и от наличието на възбудена спин орбита Y (2 D1/2), която се намира на 1,5 kcal/mol над земното състояние Y (2 D3/2), в атомния лъч. Данните за транслационното освобождаване на енергия на продукта поставят асимптотата на продукта YCH2 + H2 ≈11 kcal/mol над реагентите. Това е в съответствие с енергетиката на продукта, изчислена чрез използване на резултатите от скорошна теоретична работа, която поставя тази стойност близо 12 kcal/mol (19). По този начин стъпката за ограничаване на скоростта в реакцията съответства на преминаването на системата през първоначалната бариера за вмъкване на C – H.
При номинална средна енергия на сблъсък от 18,6 kcal/mol се наблюдава слаб продуктов сигнал за СН4 молекули в основно състояние. При енергия на сблъсък от 15,1 kcal/mol не се наблюдава реакция без OPO облъчване. Експериментите с нееластично разсейване показват, че при тази енергия на сблъсъка, нереактивно разпръснатите Y атоми са силно разпръснати напред в CM рамката, което показва появата на директно неупругосто разсейване без значително образуване на дълготрайни YCH4 комплекси. Очаква се отсъствието на образуване на комплекс при енергии на сблъсък под бариерата, тъй като неутралните σ-комплекси метал-алкан са свързани с не повече от 1-2 kcal/mol (20). При тази енергия на сблъсък, която е доста под преградата за вмъкване на C – H за молекулите на СН4 на земното вибрационно състояние, се наблюдава силен сигнал YCH2, когато молекулите CH4 се изпомпват оптически до нивото на C-H антисиметрично разтягане (ν3) непосредствено преди сблъсъка. Наблюдаваното ниво на сигнала YCH2 като функция на импулсната енергия на OPO (фиг. 5) показва, че преходът е лесно наситен поради тесната честотна лента на OPO. По този начин вибрационното възбуждане C – H отваря реакции на сблъскващи се двойки при енергии на сблъсъка, които бяха напълно нереактивни за невъзбуден метан.
Крива на насищане, показваща нивото на сигнала YCH2, записано под ъгъл на центъра на масата на лабораторията като функция от енергията на импулса OPO. Данните в черно, пасват в червено и лентите за грешки са 90% доверителни интервали.
Дискусия
При газо-повърхностно-дисоциативна адсорбция, реакции на абстракция на газова фаза (например Cl + CH4) и при вмъкване на метален атом в C-H връзка, първоначалното антисиметрично възбуждане в нормален режим в изолираната молекула на метан се делокализира за четири C – H връзки. Тази енергия трябва да се превърне в енергия, локализирана в координатите на реакцията по време на подхода, за да бъде реакцията успешна. Теоретичните изчисления ни позволиха да започнем да разбираме динамиката на тези процеси. В случай на дисоциативна адсорбция на метан, симетричното разтягане фундаментално адиабатно корелира с локализирано възбуждане на уникалната реагираща C-H връзка, насочена към повърхността (24, 25). Въпреки това, антисиметричното разтягане на възбуждането се локализира далеч от реактивната връзка в зрителската група CH3. Качествено подобно поведение е наблюдавано при теоретични изследвания на реакцията на газообразно абстрахиране Cl + CH3D (26).
Въз основа на настоящите резултати може да се изкуши да заключи, като заяви, че тъй като реакцията на вмъкване на Y + CH4 се засилва по-силно от реактивната вибрационна енергия, отколкото от еквивалентно количество транслационна енергия, тя представлява система, включваща „късно ”Потенциална енергийна бариера. При вибрационно неадиабатичен модел реактивното вибрационно възбуждане осигурява достъп до геометрии на преходни състояния с по-ниска енергия за реакция (7). Въпреки че това обяснение е привлекателно, забележителните тънкости, вече идентифицирани в реакции, включващи разнообразен набор от многоатомни системи, илюстрират, че прости концепции, основани на нашето разбиране за триатомните реакции, трябва да се прилагат с голямо внимание. При липса на допълнителни експерименти, включващи сравнения на други метали и други реактивни вибрационни режими и тъй като теоретичният анализ остава да бъде направен, обобщенията въз основа на нашето изследване биха били преждевременни. Ясно е, че комбинацията от експеримент и теория ще има огромна стойност при разгадаването на фундаменталната динамика, лежаща в основата на това как различните форми на реактивна енергия насърчават този важен клас химични реакции.
Експериментални методи
Експерименталният апарат използва източник на лазерно изпаряване, за да произведе лъч, съдържащ атоми Y в основно състояние в чист H2 или 20% H2 в He (30). Лъчът се колимира от 2-милиметров скимер и 1,7-мм × 1,7-милиметров квадрат, определящ отвор, усъвършенстван във времето с помощта на режещо колело на хеликоптера и кръстосан под прав ъгъл от единично обелен лъч, съдържащ 5% или 10% СН4 в H2 . За експерименти с оптично изпомпване изходът на импулсен теснолентов инфрачервен оптичен параметричен осцилатор е подреден така, че да пресича метановия лъч нагоре по веригата на сблъсъка. След бимолекулярна реакция някои от химичните продукти (YCH2) се отклоняват ≈25 cm към детектор, където се фотоионизират от изхода на F2 лазер при 157 nm, преминават през квадруполен филтър за маса и се откриват от динод/електронен множител комбинация. Въртящият се източник дава възможност за завъртане на двата лъча спрямо неподвижния детектор. Чрез измерване на разпределението на времето на пристигане на продуктите в детектора се определят лабораторните ъглови и кинетични енергийни разпределения за реакция или за нереактивни нееластични сблъсъци.
Благодарности.
Тази работа е подкрепена от Националната научна фондация Grant CHE-0316296.
- Сравнение на химичния състав и антиоксидантната способност на плодовете, цветята и кората на калината
- Преглед на електронните цигари на химичния състав и оценка на експозицията
- CARNATION Special Treatment Двуцветни гумени ръкавици за домашно ползване РАЗМЕР 8; Tak Shing Hong
- Оценете точността на научените тегла на характеристиките на тестовите данни - MATLAB
- Оценете точността на научените тегла на характеристиките на тестовите данни - MATLAB