Свързани данни
Резюме
Заден план:
Дефицитът на карнитин палмитоилтрансфераза II (CPT II) е важна причина за повтаряща се рабдомиолиза при деца и възрастни. Текущото лечение включва диетично ограничаване на мазнините, с увеличен прием на въглехидрати и ограничение на упражненията, за да се избегнат мускулни болки и рабдомиолиза.
Методи:
CPT II ензимен анализ, анализ на ДНК мутация, количествен анализ на ацилкарнитини в кръвта и култивирани фибробласти, органични киселини в урината, стандартизираното изследване за кратко състояние от 36 точки (SF-36) версия 2 и биоелектричен импеданс за състава на телесните мазнини. За всички пациенти е използвано диетично лечение с трихептаноин при 30% до 35% от общия дневен калориен прием.
Резултати:
Седем пациенти с дефицит на CPT II са проучени от 7 до 61 месеца на трихептаноинова (анаплеротична) диета. Пет са имали предишни епизоди на рабдомиолиза, изискващи хоспитализация и мускулни болки при натоварване преди диетата (двама по-млади пациенти не са имали рабдомиолиза). Докато са били на диета, само двама пациенти са изпитвали лека мускулна болка при упражнения. По време на кратки периоди на несъответствие, двама пациенти са имали рабдомиолиза с упражнения. Никой не е имал рабдомиолиза или хоспитализации по време на диета. Всички пациенти се върнаха към нормални физически дейности, включително напрегнати спортове. Ограничението за упражнения беше премахнато. По-рано анормални SF-36 физически композитни резултати се върнаха към нормалните нива, които се запазиха по време на терапията при всичките пет симптоматични пациенти.
Заключения:
Диетата с трихептаноин изглежда е ефективна терапия при дефицит на карнитин палмитоилтрансфераза II при възрастни.
ТЕРМИНОЛОГИЧЕН РЕЧНИК
МЕТОДИ
Диагностични методи.
CPT II ензимни анализи, 4 in vitro окисляване на палмитат, 5,6 ДНК анализ, 7,8 анализ на ацилкарнитин, 3 метаболити на плазмените мастни киселини (кетонни тела), 9 и измервания на протеини 10 бяха извършени за диагностични и мониторингови цели. Проучването за здравословно състояние от 36 елемента (SF-36) версия 2, 11 измервания на биоелектричен импеданс и серийни химични измервания на кръв и урина са получени за всеки пациент (за повече подробности вижте e-Методи на уеб сайта Neurology® на www.neurology.org).
Описания на пациентите.
В това проучване са включени седем пациенти с дефицит на CPT II, на възраст от 10 до 55 години. Три от тях (пациенти 3, 4 и 5) са братя и сестри. Други включват 55-годишна жена (пациент 1), 54-годишен мъж (пациент 2), 30-годишен мъж (пациент 6) и 14-годишно момче (пациент 7) . Кратки клинични обобщения и резултати от ензимни анализи и ДНК анализ са на разположение като допълнителен материал (вж. E-Пациенти).
Клиничен протокол.
Това проучване изисква доказателство за дефицит на CPT II чрез мутационен анализ или ензимни анализи от биопсии на мускули, фибробласти или пресни лимфоцити, преди пациентите да могат да бъдат включени. Всички пациенти са подписали информирано съгласие съгласно протокола за институционален преглед на Университетския медицински център Baylor 099-135, регистриран под Изследователското ново лекарство на САЩ по храните и лекарствата. 59 303.
Първоначално пациентите бяха оценени в продължение на 5 дни, когато бяха получени изходни клинични и лабораторни данни. Диетата с трихептаноин е започнала на втория ден с корекции на дозата според нуждите и ежедневни образователни сесии относно управлението на разстройството. След това пациентите бяха проследени от повторни клинични и лабораторни оценки приблизително на 2, 6, 12 и 18 месеца. След 18 месеца им беше даден избор да се върнат към конвенционалната терапия или да продължат диетата с трихептаноин за неопределено време. Тези пациенти избраха да удължат своето участие, в момента вариращо от 40 до 61 месеца, предоставяйки допълнителна информация за безопасност и ефикасност за диетата с трихептаноин.
Хранителните нужди се основаваха на препоръчителните насоки за дневна доза за всички пациенти. Средният дневен процент на състава от диетата по време на протокола беше следният: протеини 13,1%, въглехидрати 37,2% и мазнини 20%. Трихептаноин (8,3 kcal/g) представлява баланс от 30%. За възрастни и юноши дневната доза е 1 до 2 g/kg телесно тегло. За деца под 12 години дневната доза трихептаноин обикновено е 3 до 4 g/kg поради по-голямата им дневна калорична нужда. Всички пациенти консумираха това дневно количество масло в четири равни дози (три основни хранения и преди лягане). Трихептаноинът се смесва в предпочитани храни, като кисело мляко, пудинг или напитки. На всички пациенти се препоръчва да ограничат консумацията на прости захари, за да предотвратят неправомерно наддаване на тегло и да оптимизират окисляването на трихептаноина. Освен това, те бяха посъветвани да консумират маслото бавно за период от 20 до 30 минути, за да избегнат стомашен дискомфорт.
РЕЗУЛТАТИ
Диагностично тестване.
Получаването на диагнозата може да бъде изключително забавено (десетилетия). Нивата на серумна креатин фосфокиназа (CPK) и анализите на ацилкарнитин в кръвта са били ненормални само по време на епизодите на рабдомиолиза. Само ензимен анализ 4 и in vitro анализ на фибробласти 6 са последователно надеждни за диагностика (вж. E-Пациенти и e-Методи).
Отговор на диетичния трихептаноин.
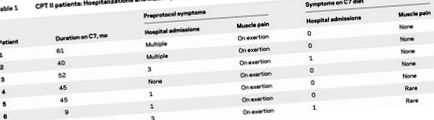
Трихептаноин се дава в четири равни дози (трите основни хранения и преди лягане) поради бързия метаболизъм на трихептаноина (3-4 часа), когато се прилага ентерално. 3 Нивата на пропионилкарнитин в кръвта, увеличени от Таблица 1, обобщават хоспитализациите за рабдомиолиза и мускулни болки при натоварване преди и след диета с трихептаноин. С изключение на пациент 4, всички са били хоспитализирани и са имали мускулни болки при натоварване, достатъчни да ограничат упражненията, преди да започнат диетата с трихептаноин. Предишното управление на диетата беше ниско съдържание на мазнини, повишени въглехидрати за всички пациенти. Тези, по-млади от 14 години, имаха допълнителна добавка MCT масло, която варираше от 6% до 10% от дневния калориен прием.
маса 1 Пациенти с CPT II: Хоспитализации и мускулни болки при натоварване, преди и след диетата с трихептаноин
След започване на диетата с трихептаноин, повечето пациенти изпитват известно подобрение в ежедневните дейности без дискомфорт до края на първата седмица. В рамките на 1 до 2 месеца настъпиха по-впечатляващи подобрения в толерантността към упражненията. За тези пациенти, които се придържат към диетата с трихептаноин, никой не е хоспитализиран с рабдомиолиза и само двама са имали лека мускулна болка при упражнения. И седемте пациенти имаха възможност да се състезават в отборни спортове (волейбол, баскетбол, гимнастика, плуване и таекуон до). По-възрастните пациенти (№ 1, 2 и 6) са участвали в плуване, аеробика, ски и туризъм. Тези дейности не бяха възможни при предишното им управление на диетата. Следователно ограничението на упражненията вече не беше необходимо. В опит да се предотврати мускулна болка, се препоръчва да се приеме доза трихептаноин 30 минути преди усилена физическа активност.
Въпреки това, двама пациенти (№ 3 и № 7) спряха приема на маслото за периоди от 1 до 2 седмици. И двамата се нуждаеха от хоспитализация след тежки физически упражнения. Всеки се върна към диетата с трихептаноин с подновена толерантност към упражненията.
SF-36 въпросници.
Те се прилагат на изходно ниво и при следващи посещения. Таблица 2 показва наличните последователни физически композитни резултати (PCS) за всеки пациент на изходно ниво и до 33 месеца след започване на диетата. Резултати от PCS за двамата относително асимптоматични пациенти, бр. 4 и 5, бяха нормални на изходно ниво и останаха нормални след 28 месеца лечение. По-възрастният им брат, пациент 3, беше постигнал нормален PCS резултат до 6 месеца, който също остана нормален. И тримата останаха без болка след 45 месеца (пациенти 4 и 5) и 52 месеца (пациент 3) на диета. Останалите четирима пациенти показват значително подобрение на резултатите от PCS от изходното ниво, вариращо от +1 SD (пациент 7) до до +3 SD (пациент 2), приближаващи или надминаващи нормалния резултат от 50 (таблица 2).
Таблица 2 Първоначални и последващи резултати SF-36 (PCS)
Мониторинг на безопасността.
Изглежда няма доказателства за токсичност от диетата с трихептаноин. Няма последователни отклонения в нито един от серийните лабораторни резултати, с изключение на вариациите в CPK, свързани с леко повишаване на аспартат аминотрансферазата (AST) и аланин аминотрансферазата (ALT), когато пациентите изпитват лек дискомфорт.
Липидните профили обикновено не са забележителни, с изключение на пациенти 1 и 2 (и двамата на възраст над 50 години), които са имали ненормални профили в началото и по време на диетата С7. За пациент 1 холестеролът беше повишен периодично и триглицеридите първоначално бяха повишени и по-късно се нормализираха. Липопротеинът с ниска плътност (LDL) е нормален в началото, но след това е необичаен. Пациент 2 е бил хиперхолестеролемичен по време на диетичния протокол и LDL е бил постоянно повишен. Нито един от останалите пациенти не е имал липидни аномалии, докато е приемал трихептаноин.
Кръвните химикали на изходно ниво и по време на диетата с трихептаноин са нормални за глюкоза, калий, въглероден диоксид, анионна междина, креатинин и албумин. Азотът на уреята в кръвта (BUN) е леко повишен, с периодичност, при пациенти 2, 3 и 5. Техните нива са само 18 до 23 mg/dL, в сравнение с референтния диапазон от 7 до 17 mg/dL. Нивата на креатинин никога не са били повишени във връзка с тези незначителни аномалии на BUN. По време на диетата нивата на AST и ALT са били нормални. Както се очакваше, AST беше леко повишен само във връзка с повишени нива на CPK. Имаше редица „субклинични“ повишения на CPK (не се усещаше мускулен дискомфорт). Само един пациент (№ 5) е имал ненормални нива при всяко посещение, вариращи от 166 до 537 IU/L (референтен диапазон 30-135 IU/L). Общият диапазон на всички стойности на CPK за тези пациенти по време на диетата е от 35 до 869 IU/L.
Нито един от пациентите не е имал хематологични отклонения по време на проучването.
Нивата на палмитоилкарнитин в кръвта рядко са били необичайни, а нивата на олеоилкарнитин са били само от време на време леко повишени, но не са диагностицирани за дефицит на CPT II. Количествените профили на екскреция на органична киселина с урината не показват постоянни отклонения (вж. Таблица e-1 за повече подробности).
ДИСКУСИЯ
Пациентите с дефицит на CPT II в детска или възрастна форма изпитват повтарящи се епизоди на силна мускулна болка, свързана с рабдомиолиза, придружена с екстремно повишаване на серумния CPK и миоглобинурия. Тези епизоди често се предизвикват от гладуване, инфекция или прекомерно упражнение. Както се съобщава в това и други проучвания, 1 диагнозата може да бъде трудна за установяване, често включваща десетилетия. Ензимният анализ за активност на CPT II от мускулни биопсии, фибробластни култури и лимфоцити е еднакво окончателен. Анализът на „често срещаната“ ДНК мутация, S113L, не винаги е бил надежден, нито анализът на ацилкарнитин или серумния CPK, както се вижда в резултатите при нашите пациенти, освен по време на епизоди на рабдомиолиза. Остатъчната активност на CPT II може да е отговорна за трудността при ранно разпознаване на това разстройство.
Терапията се фокусира върху намаляването на приема на мазнини с храната, като същевременно увеличава въглехидратите, главно за намаляване на анормалното натрупване както на дълговерижни ацил-коензим А (CoA), така и на междинни продукти на ацилкарнитин. По време на рабдомиолитична криза, прекомерната липолиза, свързана с миоглобинурия, е основната грижа. Острата терапия включва инфузия на глюкоза (често с инсулинова капка) за намаляване на липидната мобилизация и големи обеми течности и алкализиране, за да се засили бъбречната екскреция на миоглобина. Диетичното ограничаване на мазнините, дори и със заместване на средноверижни триглицериди с равномерно въглерод (MCT масло), макар и основателна обосновка, не е било успешно, тъй като се налага ограничаване на упражненията, мускулната болка при натоварване продължава и периодичните хоспитализации продължават да се случват.
Фигура Метаболитна съдба на хептаноат, получен от трихептаноин
Взаимодействие между черния дроб и мускулите за осигуряване на каталитични междинни продукти за цикъла на лимонената киселина (CAC). ATP = аденозин трифосфат; BHP = β-хидроксипентаноат; BKP = β-кетопентаноат; BKP-CoA = β-кетопентаноил-коензим А; CoA = коензим А.
Децата и възрастните с дефицит на CPT II са наясно с ежедневните си физически ограничения, за което свидетелстват периоди на мускулна слабост, болка и болки, свързани с леко до умерено физическо натоварване или заболявания.
С изключение на двете относително асимптоматични деца (пациенти 4 и 5), всеки пациент в това проучване е осъзнал повишена физическа издръжливост без мускулна умора или болка още на четвъртия ден от терапията. От началото и спазването на диетичната терапия, нито един от тях не се нуждае от хоспитализация за рабдомиолитични епизоди. Всички пациенти се върнаха към неограничени физически упражнения. Тези дейности включват баскетбол, волейбол, ски, аеробика и ежедневни протоколи за ежедневно плуване от олимпийски тип. В сравнение с техните изходни оценки, PCS от въпросника SF-36 за тези пет симптоматични пациенти се е подобрил до нормални нива още 2 месеца и е останал нормален до 33 месеца на диета (таблица 2).
Това проучване съобщава за успешно управление на дефицит на CPT II, използвайки анаплеротична диетична терапия с трихептаноин, за разлика от предишния опит на пациентите с диета с ниско съдържание на мазнини/високо въглехидрати. Освен това, няма данни за токсичност, неправомерно наддаване на тегло или ненормален състав на телесните мазнини, удължаващ до 61 месеца при нито един от пациентите. Нито един от тези пациенти не е имал повтарящи се епизоди на рабдомиолиза или е изисквал хоспитализация, докато е бил на диета. Ограничението на упражненията беше премахнато и резултатите от SF-36 показват връщане към нормалния начин на живот без болка в тялото.
ПРИЗНАНИЕ
Авторите благодарят на SASOL, GmbH (Witten, Германия) за дареното масло от трихептаноин, използвано в това проучване, и на J. Bezanson за помощта при анализа на SF-36. Авторите също така благодарят на персонала на Нашата детска къща в Медицинския център на Университета Бейлор за тяхното съдействие в тези разследвания.
Допълнителен материал
Бележки
Адресирайте кореспонденцията и заявките за повторно отпечатване до д-р Чарлз Р. Роу, Институт по метаболитни заболявания, Медицински център на университета Бейлор, ул. 3812 Elm, Далас, Тексас 75226 ude.htlaehrolyab@rselrahc
Подкрепено с безвъзмездни средства от Изследователската фондация на Медицинския център на Baylor University и грант на NIH DK069752 (H.B.).
Разкриване: Авторите не съобщават за разкриване.
Получено на 2 ноември 2007 г. Прието в окончателен вид на 10 април 2008 г.