Резюме
Цели/хипотеза
Диабетната кардиомиопатия (DCM) е често срещана при диабет тип 2. При DCM инсулиновата резистентност може да промени доставката и използването на сърдечния субстрат, което води до промени в метаболизма на миокарда и сърдечната функция. При плъхове излагането на прекомерна хранителна мазнина, предизвикващо диабетен фенотип тип 2, може да доведе до инсулинова резистентност на миокарда и сърдечни функционални промени, наподобяващи DCM.
Материали и методи
Плъховете са получавали диети с високо съдържание на мазнини (HFD) или с ниско съдържание на мазнини (LFD) в продължение на 7 седмици. Преди убийството се инжектира инсулин или физиологичен разтвор i.p. Контрактилната функция и инсулиновата сигнализация бяха оценени съответно в папиларните мускули и вентрикуларните лизати.
Резултати
Нивата на глюкоза в кръвта на гладно и след натоварване се повишават при HFD- спрямо LFD-плъхове (всички стр 2+ -индуцираното увеличаване на силата беше премахнато в HFD-мускулите. HFD намалява свързаната с инсулин IRS1-свързана фосфатидилинозитол 3′-киназна активност и фосфорилиране на протеин киназа В, гликоген синтаза киназа-3β, ендотелна азотна оксид синтаза и транскрипционни фактори на вилицата с 40–60% (всички стр 2+ претоварване. Сърдечната дисфункция е свързана с инсулинова резистентност на миокарда и фосфоламбаново хипофосфорилиране. Нашите данни показват, че инсулиновата резистентност на миокарда, резултат от излагане на прекомерна хранителна мазнина, може да допринесе за патогенезата на сърдечно-съдови заболявания, свързани с диабета.
Въведение
Диабетът тип 2 е свързан с висока честота на коронарна артериална болест и застойна сърдечна недостатъчност [1, 2]. Дори при асимптоматични пациенти с неусложнен диабет тип 2 се откриват хипертрофия и дисфункция на лявата камера [3, 4]. При липса на коронарна артериална болест и хипертония, миокардните аномалии се приписват на диабетната кардиомиопатия (DCM) [5]. Промените в енергийния метаболизъм на миокарда, вследствие на промененото снабдяване и използване на кардиомиоцитния субстрат, може да са в основата на развитието на DCM [6]. Ключов механизъм, допринасящ за дисметаболичните промени в миокарда, може да бъде нарушена сърдечна инсулинова сигнализация [6].
При инсулиноустойчиви и диабетици от тип 2 съществуват високи потоци на NEFA и триглицериди поради непотисната липолиза в мастната тъкан и свръхпроизводството на богати на триглицериди частици. Това прекомерно излагане на липиди, при наличие на нарушено усвояване на глюкозата, води до натрупване на триглицериди в немастните тъкани, включително миокарда. Неподходящото отлагане на триглицериди увеличава вътреклетъчния басейн на мастна ацил-КоА, като по този начин осигурява субстрат за неоксидативни метаболитни пътища, водещи до оксидативен стрес, клетъчна дисфункция и апоптоза [7]. При животински модели на липотоксичност е установена миокардна дисфункция, която е обърната чрез антистеатотично лечение [8]. Проучванията in vitro върху кардиомиоцити от мастни плъхове Zucker предполагат, че нарушената сърдечна инсулинова сигнализация може да е в основата на наблюдаваните аномалии [9]. Тези констатации са получени главно от проучвания в генетични модели на инсулинова резистентност и диабет тип 2 и следователно не е ясно дали подобни механизми действат при хора и животински модели на инсулинова резистентност, предизвикана от хранителни мазнини, което се смята за фундаментално в развитието на диабет тип 2 при човека.
Изследвахме дали дългосрочното излагане на нормални плъхове на диета с високо съдържание на мазнини (HFD), предизвикващо диабетен фенотип тип 2, води до дисфункция на миокарда и дали тези промени са свързани с ненормална миокардна инсулинова сигнализация.
Материали и методи
Животни
Диети
Експериментални диети са получени от Hope Farms (Woerden, Холандия; HFD: cat # 4148.02; LFD: cat # 4148.01). LFD се състои от 8 тегл.% Обща мазнина, 22 тегл.% Протеин и 60 тегл.% Въглехидрати; HFD съдържа 25 тегл.% мазнини, 32 тегл.% протеин и 25 тегл.% въглехидрати, както и повече палмитат (91,12 g/kg) и олеат (100,24 g/kg) в сравнение с LFD (29,12 и 32,08 g/kg, съответно ). В случая на HFD, 50,4% от приетите калории са получени от мазнини в сравнение с 16,4% за LFD.
In vitro съкратителна функция
Папиларните мускули са монтирани в суперфузионна вана и са свързани към преобразувател на сила за оценка на контрактилната функция [10]. Септалната артерия беше канюлирана и перфузирана при 60 cmH2O. Мускулът беше суперкондензиран и перфузиран от буфер, съдържащ (в mmol/l) 118 NaCl, 4,5 MgCl2, 4,5 KCl, 0,33 NaH2PO4, 25 NaHCO3, 1 CaCl2, 10 глюкоза и 0,01 аденозин, уравновесен с 95% O2 и 5% CO2 и поддържан при 27 ° С. Мускулите са крачени на 0,2 Hz и са измерени мускулните размери, за да се позволи нормализиране на развитата силаF dev) и максимална сила (F max) върху площта на напречното сечение на мускулите. Дължината на мускула беше определена на 95% от максималната дължина, определена от отношението сила-дължина, последвано от период на стабилизиране от 60 минути. Мускулите бяха подложени на протокол за потенциране, за да се определи F макс. Приложен е протокол за сила-честота за увеличаване на натоварването на мускулите и впоследствие възстановяване на силатаF rec), което се изразява като процент от първоначалната сила. И накрая, за да се проучи ефектът на Ca 2+ върху F разработчици, мускулите бяха изложени на 2 mmol/l извънклетъчен Ca 2+ .
Определяне на плазмата
Инсулинът беше измерен чрез RIA (INSIK-5; DiaSorin Biomedica, Saluggia, Италия), който показва 100% кръстосана реактивност с инсулин от плъхове. Плазмените нива на NEFA се определят с помощта на колориметричен комплект (WAKO NEFA-C; Wako Pure Chemical Industries, Осака, Япония). Концентрациите на серумен лептин са измерени чрез RIA (LEP-R61; Mediagnost, Reutlingen, Германия).
Сърдечен липиден анализ
Съдържанието на триглицериди във вентрикуларни лизати се определя, както е описано по-горе [11].
Хистология и електронна микроскопия
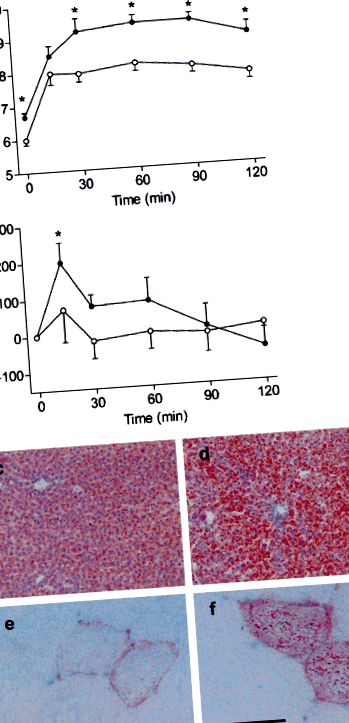
Замразените участъци от черния дроб, скелетните мускули и сърдечната вентрикуларна тъкан бяха оцветени с маслено-червено-О и оцветени с хематоксилин на Mayer. За електронна микроскопия ултратънките участъци на сърдечно-вентрикуларната тъкан бяха контрастирани с уранил ацетат и оловен цитрат на Рейнолдс.
Сърдечна инсулинова сигнализация
За да се определи инсулиновата сигнализация, вентрикуларната тъкан се хомогенизира с помощта на миксер ултратуракс [9]. Лизатите се центрофугират (15 минути; 14 000 оборота в минута; 4 ° С) и съдържанието на протеин се определя с помощта на BCA комплект (Pierce, Rockford, IL, USA).
Статистически анализ
Данните са изразени като средни стойности ± SD или средни стойности ± SE. Разликите между групите се определят от двупосочен несдвоен студент т-тест. A стр стойност на стр
Резултати
HFD индуцира затлъстял фенотип с нарушен глюкозен толеранс
Средно изходно телесно тегло при LFD- и HFD-плъхове (съответно 302 ± 4,6 и 301 ± 3,7 g) и общото средно наддаване на телесно тегло по време на диетичната интервенция (средно 49 ± 4 дни; 132 ± 31 и 131 ± 30 g, съответно) са подобни. На гладно (стр Таблица 1 Характеристики на плъхове след 7 седмици на диета с високо или ниско съдържание на мазнини
HFD храненето води до сърдечни структурни и функционални аномалии
Средното сърдечно тегло и съотношението сърдечно-телесно тегло на HFD-плъхове бяха увеличени в сравнение с LFD-животни (и двете стр Фиг. 2
Предавателни електронни микрографии на сърдечни секции на LFD- (а) и HFD-плъхове (б-д). Нормални митохондрии (м) с ясно видими кристали присъстват в LFD-кардиомиоцитите, докато дегенериралите митохондрии (стрелка) присъстват в HFD-клетки. По-голямо увеличение разкрива ламеларни структури, свързани с митохондриалните мембрани (символ на звезда)
Увеличения на базалния F dev и F макс. 1,7- (стр Фиг. 3
След повишено натоварване, F rec възлиза на 69,1 и 65,8% от изходното ниво F dev при инжектирани с физиологичен разтвор и инсулин LFD- животни, съответно (фиг. 3в), и 36,6 и 47,3% в съответните мускули от HFD-плъхове (и двете стр Концентрацията 2+ до 2 mmol/l предизвиква повишаване на F dev както в LFD-, така и в HFD-мускули от инжектирани с физиологичен разтвор плъхове (и двете стр 2+ -индуцирани F увеличаването на разработчиците е притъпено в мускулите от инжектирани с инсулин LFD-плъхове (стр 2+-претоварването беше премахнато в мускулите от HFD-плъхове (Фиг. 4а). Тези открития не са обяснени с разлики в нивата на експресия на саркоплазматичен ретикулум Са 2+ -циклиращи протеини RyR и SERCA2a (Фиг. 4b). Въпреки това, 43% намаление на съотношението на експресия на фосфорилиране/PLB на Ser16-PLB е наблюдавано в сърцата от инжектирани с инсулин HFD-плъховестр Фиг. 4
HFD намалява активирането на множество сигнални пътища за миокарден инсулин
Фосфорилиране на PKB/Akt и неговите субстрати
Инсулинът значително повишава фосфорилирането както на Thr308-, така и на Ser473-PKB/Akt в LFD-сърцата. PKB/Akt фосфорилирането в HFD-сърца е намалено с 64 (Thr308; стр Фиг. 5
Тирозин фосфорилиране на IRS1/IRS2 и свързаната с него активност PI3K
Инсулиновата стимулация доведе до 2,4-кратно увеличение на IRS1 фосфорилиране на тирозин в LFD-сърца (Фиг. 6а, b), докато нивата на тирозин фосфорилиран IRS1 бяха намалени с 57% в HFD-сърцата (стр Фиг. 6
Тирозин фосфорилиране на β-субединицата на инсулиновия рецептор
Индуцирано от тирозин фосфорилиране на β-субединицата на инсулиновия рецептор и в двете групи (фиг. 7а). Отговорът на инсулин при HFD- срещу LFD-плъхове обаче е намален с 50% (стр Фиг. 7
Дискусия
Плъхове, хранени с HFD, развиват диабетен фенотип тип 2, характеризиращ се с непоносимост към глюкоза и чернодробна, скелетна мускулатура и сърдечна стеатоза, но с наддаване на телесно тегло, подобно на това при контролите на LFD. Храненето с HFD доведе до лека сърдечна хипертрофия с по-високи изходни контрактилни сили, но значително намалено възстановяване след по-големи натоварвания. Също така се наблюдава притъпен отговор за усилване на силата към висок Са 2+ при инжектирани с инсулин HFD-папиларни мускули и сърдечни ултраструктурни аномалии са открити само в HFD-сърцето. Освен това, сърца от инжектирани с инсулин HFD-плъхове показват нарушена инсулинова сигнализация и PLB хипофосфорилиране.
Досега повечето проучвания, изследващи сърдечната липотоксичност, са били извършвани при генетично манипулирани гризачи, особено при липсващи или устойчиви на лептин животни [8, 13]. Следователно не е ясно дали натрупването на сърдечни липиди може да бъде индуцирано чрез обикновен хранителен прием на HFD при нормални животни. Нормалните плъхове, хранени с 60% HFD в продължение на 6 седмици, са имали само леко повишение на сърдечния триглицерид [7], докато 10-седмичен лептинов дефицит об/об мишки, хранени със стандартна чау, показват трикратно увеличение на съдържанието на триглицериди в сърцето в сравнение с контролите [13]. Открихме двукратно увеличение на сърдечното съдържание на триглицериди след 7 седмици HFD хранене при нормални плъхове, което показва, че хроничното излагане на високо съдържание на мазнини в храната наистина може да предизвика сърдечно натрупване на липиди и свързаните с това аномалии [14, 15].
Наблюдаваната сърдечна хипертрофия при HFD-плъхове може да се разглежда като първа стъпка в последователността на адаптивните реакции на сърцето към стрес, причинен от голям брой физиологични и патологични състояния [16]. Всъщност папиларните мускули от HFD-сърцата показват по-високи базални и максимални сили, но намалено възстановяване след по-голямо натоварване. Основният механизъм, свързващ HFD храненето с развитието на лека сърдечна хипертрофия, е неясен. От една страна, хиперинсулинемията е замесена в регулирането на сърдечния растеж [17]. Алтернативно, приносът на натрупването на триглицериди и устойчивата активация на протеин киназа С чрез триглицеридни метаболити към хипертрофичните промени в HFD-сърцата не може да бъде изключен [18]. И накрая, въпреки че повишеното с диета повишаване на кръвното налягане, допринасящо за сърдечната хипертрофия, не може да бъде напълно изключено, съществуването на съответна хипертония при нашите плъхове е по-малко вероятно, тъй като не е открита концентрична хипертрофия (данните не са показани). Други са показали, че промените в кръвното налягане при плъхове, на които е прилагана 74% маслена диета за 17 седмици, са незабележими [19].
Метаболитните промени в миокарда, т.е. повишено окисление на NEFA за сметка на усвояването и метаболизма на глюкозата, влияят върху сърдечния енергиен статус и като такива може да са допринесли за наблюдаваните функционални промени в HFD-мускулите [20]. Въпреки че сърдечният метаболизъм не е оценен, наблюдаваните сигнални дефекти, както и нарушената способност за възстановяване от по-големи натоварвания са показателни за нарушен метаболизъм на глюкозата в HFD-сърцата. Увеличеното предлагане на NEFA не само ще намали скоростта на метаболизма на глюкозата, но също така ще увеличи допълнително консумацията на кислород, както чрез разединяване на окислителното фосфорилиране [21], така и чрез индуциране на циклиране на NEFA във и извън триглицеридния басейн, напразен, енергоемък цикъл [22]. Малко вероятно е исхемията да отчете наблюдаваните промени, тъй като мускулният препарат непрекъснато е бил перфузиран с кислороден буфер [10]. В допълнение, високите нива на NEFA могат да повлияят на консумацията на енергия, свързана с връзката възбуждане-свиване, както и на други процеси, свързани с обработката на клетъчни Ca 2+ [23, 24]. Следователно, енергийният недостатък на преобладаващото използване на NEFA като миокарден енергиен субстрат може да доведе до намалена способност за възстановяване от предизвикателство за натоварване.
Асоциации между метаболитни аномалии на миокарда и дисфункция са докладвани от някои автори [24–27], но не и от други [28, 29]. Тези несъответствия могат да бъдат резултат от разликите в животинските модели и използваните методи за оценка на сърдечната функция, включително наличност на субстрат и наличие или отсъствие на миокардна исхемия. Инсулинът може да бъде важна връзка между метаболизма на миокарда и функцията [17, 30, 31]; обаче, данните за медиираните от инсулина ефекти и молекулярните аспекти на инсулиновата сигнализация до голяма степен липсват от гореспоменатите проучвания. Инсулинът подобрява сърдечната енергийна ефективност чрез пренасочване на използването на субстрата към глюкоза и на теория тези промени могат да повлияят благоприятно на миокардната функция, по-специално в хипертрофичното сърце и при исхемични състояния. Тези благоприятни ефекти на инсулина са показани както при животни [20], така и при хора [32].
HFD-папиларните мускули показват функционална инсулинова резистентност, което се отразява от липсата на положителна инотропия и нарушена защита срещу претоварване с Ca 2+. Променен контрактилен отговор на миокарда към инсулин е описан преди това при модели на диабет и сърдечна хипертрофия [33–37]. Промените в боравенето с кардиомиоцитите Ca 2+ в диабетни сърца, индуцирани от стрептозотоцин, са свързани с намалена експресия и активиране на SERCA2a, наред с други чрез взаимодействие с IRS1/2 [38, 39]. Не открихме ефект на инсулина върху асоциацията SERCA2a – IRS1/2 (данните не са показани) и, в съответствие с други проучвания при животински модели на инсулинова резистентност/диабет тип 2, не се наблюдават промени в експресията на SERCA2a и RyR, предизвикани от диета [40, 41]. Въпреки това, наблюдаваното намаляване на нивата на фосфорилиране на Ser16-PLB в HFD-сърца, инжектирани с инсулин, може да е допринесло за нарушената медиирана инсулинова защита срещу претоварване с Ca 2+, тъй като намаляването на фосфорилирането на Ser16-PLB увеличава инхибиращото действие на PLB върху SERCA2a дейност [42].
Намаленото активиране на PKB/Akt-медиирано сигнализиране в HFD-сърца може да доведе не само до намалено GLUT4-медиирано усвояване на глюкоза и синтез на гликоген [14], но и до неблагоприятни ефекти върху сърдечната функция. Намаленото фосфорилиране на eNOS може да увреди генерирането на азотен оксид и вазодилатацията, като по този начин се отразява неблагоприятно на сърдечната функция [49]. И накрая, тук за първи път докладваме за медиираното от инсулин фосфорилиране на форкхед транскрипционните фактори FOXO1/3 в сърцето. Фосфорилирането на форкхед транскрипционните фактори FOXO1/3 от PKB/Akt води до тяхното ядрено изключване и едновременна загуба на тяхната генна регулаторна функция [50]. Въпреки че in vitro проучванията включват FOXO протеини в контрола на клетъчния цикъл, клетъчното оцеляване и апоптозата, тяхната функция в сърцето ясно зависи от бъдещата идентификация на целевия ген.
Взети заедно, HFD индуцира диабет тип 2 при плъхове, сърдечна дисфункция и функционална и молекулярна миокардна инсулинова резистентност. Инсулинът оказва много различни ефекти, които заедно, пряко или косвено, могат да имат благоприятно въздействие върху сърцето. Все още остава да се докаже дали инсулинът може да повлияе на тези допълнителни действия независимо от неговите метаболитни ефекти. Интервенциите, насочени към подобряване на сърдечната инсулинова сигнализация, могат да представляват основен терапевтичен принос в битката срещу свързаните с диабета сърдечни заболявания.
- Характеристика на възпалението и инсулиновата резистентност при индуцирана от диета мъжка мишка C57BL6J
- Диета, свързана със сърдечно-съдови заболявания на клапата, ехокардиографски опит в клиниката Мейо -
- Енергийно гъстите диети са свързани с по-ниски разходи за диета в проучване на общността на възрастни французи - PubMed
- Диета за инсулинова терапия ОНЛАЙН (ноември 2020) Билети, вторник 24112020 в 13:00 Eventbrite
- Сърдечна структура и функция и инсулиновата резистентност при пациенти със затлъстяване със затлъстяване има надморие