Aprilianto E. Wiria
1 Катедра по паразитология, Медицински факултет, Университет на Индонезия, Джакарта, Индонезия,
2 Катедра по паразитология, Медицински център на Университета в Лайден, Лайден, Холандия,
Ерлияни Сартоно
2 Катедра по паразитология, Медицински център на Университета в Лайден, Лайден, Холандия,
Танявати Супали
1 Катедра по паразитология, Медицински факултет, Университет на Индонезия, Джакарта, Индонезия,
Мария Язданбахш
2 Катедра по паразитология, Медицински център на Университета в Лайден, Лайден, Холандия,
Асоциацията между метаболитен синдром и възпаление
Метаболитният синдром (MetS), нарушение на енергийното оползотворяване и съхранение, се проявява като група от състояния като хипертония, дислипидемия, коремно затлъстяване и променен метаболизъм на глюкозата, което увеличава риска от диабет тип 2 (T2D) и сърдечно-съдови заболявания ( ССЗ). Начин на живот, който се състои от преяждане, висококалоричен прием на храна и липса или нередовна физическа активност, е рисков фактор за развитие на MetS. Следователно лечението на MetS включва редовно физическо натоварване, модифициране на диетата за намаляване на теглото и/или кръвната глюкоза и използването на лекарства за понижаване на липидите.
Дали хелминтните инфекции са свързани с метаболитен синдром?
В страните с високи доходи (HIC) инфекциозните заболявания като хелминти (обикновено свързани с лоша хигиена или санитария) са сравнително добре контролирани в сравнение с развиващите се страни или с ниски до средни доходи (LMIC), особено селските райони на LMIC. Вместо това здравословните проблеми в HIC са често свързани с MetS. Има все повече доказателства, че подобренията в инфраструктурата и контрола на инфекциозните заболявания в LMIC, които често са последвани от спад на инфекциите (включително хелминтни инфекции), са успоредни с нарастващото разпространение на различни възпалителни заболявания като алергии и автоимунитети, както и на T2D и CVD [10].
Многобройни проучвания показват обратна връзка между хелминтни инфекции и възпалителни заболявания като алергии, автоимунитети и възпалителни заболявания на червата, но е важно да се появят нови доказателства, че хелминти изглежда също са свързани с по-ниска честота на MetS [10]. Изследване в Индия показва обратна връзка между лимфната филариаза и T2D [11], докато неотдавнашен доклад от селска общност в Китай, която преди е била ендемична за шистозомоза, показва, че миналата инфекция с Schistosoma japonicum е свързана с по-ниско разпространение на MetS [12]. Плазмената глюкоза на гладно, кръвната глюкоза след хранене, HbA1c и инсулиновата резистентност, както и нивото на триглицеридите и холестерола с ниска плътност, са обратно свързани със самоотчетената минала инфекция с S. japonicum. В подкрепа на това установихме също, че в Индонезия хелминтните инфекции са свързани с подобрена чувствителност към инсулин (Wiria et al., Статия, непубликувана).
В проучване в селските райони на Индонезия показахме, че чревните хелминтни инфекции при възрастни са отрицателно свързани с рискови фактори за ССЗ, като индекс на телесна маса (ИТМ), съотношение на талията до бедрата (WHR) и нива на липидите [13] . В същото проучване не открихме никаква връзка между текущите хелминтни инфекции и дебелината на каротидната интима (cIMT) [13]. Това може да не е изненадващо, тъй като cIMT на индивидите в тази област е бил много нисък в сравнение с лица на същата възраст, живеещи в HIC [14], което би затруднило откриването на някакъв полезен ефект. Нашата констатация се подкрепя от друго проучване, което изследва атеросклероза при трупове [15]. Авторите съобщават, че инфекцията с Opistorchis felineus е свързана с по-нисък общ серумен холестерол и е отрицателен предиктор за аортна атеросклероза.
Взети заедно, е изкушаващо да се предположи, че хелминтните инфекции могат да предпазят от MetS, като по този начин намаляват риска за последващо развитие на T2D и/или CVD.
Какъв е възможният механизъм зад връзката между хелминти и метаболитен синдром?
маса 1
| Щам на мишката | Инфекция/екстракт от хелминти | Констатации | Препратки |
| (A) ApoE -/- мишки или (B) произволно отглеждани TO мишки | S. mansoni инфекция | • Намален общ серумен холестерол (както в А, така и в В) и HDL и LDL холестерол (В). | [26] |
| • Намалено развитие на атеросклеротични лезии (A). | |||
| (C) ApoE -/- или (D) див тип (WT) мишки C57BL/6 | Яйца от S. mansoni, които са били замразени | • Намален общ серумен холестерол (C и D) и LDL (C). | [27] |
| • Няма ефект върху образуването на атеросклеротични лезии (C). | |||
| • Подобрени Th2 цитокинови отговори, без да се засягат Th1 цитокините (C). | |||
| • Повишен процент на макрофаги в перитонеалната кухина (C). | |||
| • Подобрена способност на макрофагите да поемат LDL, но не и ацетилиран LDL (D). | |||
| (E) ApoE -/- мишки или (F) TO мишки | S. mansoni инфекция, живи яйца S. mansoni, SEA и SmECS | • Патентна бисексуална инфекция с червеи намалява серумния холестерол (F) и чернодробните липиди (E и F). | [19] |
| • Еднополовата глистна инфекция не намалява значително серумния холестерол (E, F). | |||
| • Живи яйца, SEA и SmECS намаляват серумния холестерол (F). | |||
| • Еднополовата инфекция, SEA и smECS не повлияват липидите на черния дроб (F). | |||
| WT C57BL/6 мишки | Инфекция с N. brasiliensis | • Подобрена инсулинова чувствителност и глюкозен толеранс. | [17] |
| • Намалено тегло на перигонадната мастна тъкан. | |||
| • Повишени еозинофили на мастната тъкан в периогонада. | |||
| • Намаляване на общите макрофаги на мастната тъкан. | |||
| (G) WT (H) IL-10 -/- или (I) Fxr-α -/- (Nr1h4) C57BL/6J мишки | МОРЕ | • Подобрена инсулинова чувствителност и толерантност към глюкоза по IL-10-зависим начин (G и H). | [21] |
| • Повишена циркулация на IL-4 и IL-10 (G). | |||
| • Насърчава експресията на M2 и метаболитните гени и намалява експресията на M1 гени в епидидималната мастна тъкан (G). | |||
| • Защитена срещу чернодробна стеатоза и потисната липогенна генна експресия (g) | |||
| • Намалена липогенеза чрез активиране на Fxr-α (G, I). | |||
| (J) WT (K) STAT6 (-/-) (L) IL-13 (-/-) C57BL/6 мишки | Инфекция с N. brasiliensis | • Намалено увеличаване на теглото, предизвикано от диетата, и насърчаване на загуба на тегло при затлъстели мишки. | [28] |
| • Намалена маса на епидидима и кафява мастна тъкан и циркулиращ лептин (J). | |||
| • Подобрен глюкозен толеранс и кръвен инсулин на гладно (J). | |||
| • Намалена абсорбция на глюкоза в червата, свързана с намалена експресия на транспортери на глюкоза (J). | |||
| • Намалена чернодробна стеатоза и повлияна експресията на гени, свързани с липидния метаболизъм (J). | |||
| • Регулирана генна експресия на Th2 цитокини в различни органи, включително епидидимална мазнина (J). | |||
| • Регулирана нагоре генна експресия на М2 маркерите Arg1 и YM1 в епидидимална мазнина (J) | |||
| • Загубата на тегло и затихването на чернодробната стеатоза частично или изцяло зависят от IL- | |||
| • 13 и STAT6 (J, K, L) | |||
| (M) LDLR -/- или WT (N) c57BL/6 мишки | МОРЕ | • Индуцирана регулация на Th2 гени на далака (M) | [20] |
| • Индуцирани противовъзпалителни перитонеални макрофаги, но не повлияват експресията на M2 гена (M). | |||
| • Намалено системно възпаление на миелоидно ниво (М). | |||
| • Намален холестерол в плазмата в частиците с размер на VLDL и LDL (M). | |||
| • Атенюирано развитие на атеросклероза и намалена некроза на плаките (M). | |||
| • In vitro, лекуваните със SEA макрофаги показват противовъзпалителен фенотип и са по-малко прилепнали към активиран ендотел (N). |
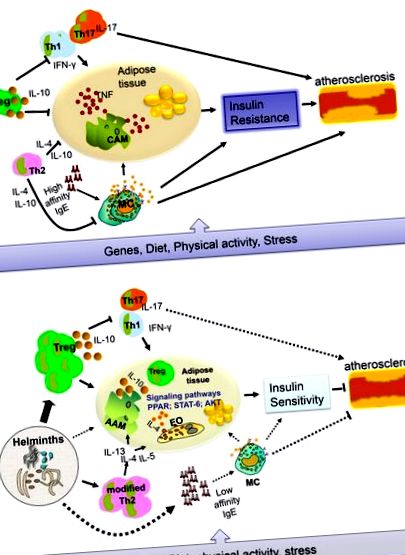
В проучване, използващо апоЕ -/- мишки, беше показано, че факторите, освободени от яйцата на S. mansoni, имат липидопонижаващи ефекти [19]. Наскоро доклад в друг модел (c57BL/6 LDLR -/- мишки) показа, че лечението с S. mansoni-разтворим яйцеклетен антиген (SEA) индуцира противовъзпалителни макрофаги, които могат да намалят системното възпаление, отслабват развитието на атеросклероза и инхибират некрозата на плаките [20]. Освен това Bhargava et al. [21] демонстрираха, че лакто-N-фукопентоза III, имуномодулиращ гликан, който може да се намери в човешкото мляко и неговата част на Lewis-X върху паразитни хелминти (в SEA), може да подобри инсулиновата чувствителност чрез засилване на инсулиновата сигнализация от бяла мастна тъкан чрез индукция на производството на IL-10. Дали инфекциите с хелминти водят до подобни промени при хората, все още изисква допълнително проучване. В скорошно проучване установихме, че общият имуноглобулин Е (IgE), който е свързан с хелминтни инфекции, е свързан с намалени нива на глюкоза и липиди на гладно [13]. Схемата, която показва ролята на възпалението в развитието на T2D и CVD при липса и наличие на хелминтни инфекции, е дадена на фигура 1 .
Има ли още за IgE и ССЗ?
Връзката между общия IgE и ССЗ при липса на хелминти е изследвана при животински модели. Wang et al. са докладвали, че IgE е свързан с ССЗ чрез свързването му с FcεR1α върху макрофагите, за да се насърчи нестабилността на плаката [22]. Те също така съобщават, че нивата на IgE са по-високи при субекти със ССЗ, особено при тези с нестабилна стенокардия и остри коронарни събития. В градска зона в Китай се съобщава, че по-високото ниво на IgE и химаза, протеаза на мастоцитите, е потенциален рисков фактор за T2D [23], [24]. Изглежда, че тези изследвания противоречат на нашите открития, че високият общ IgE е свързан с намалена глюкоза и липиди на гладно [13]. Неотдавнашната работа обаче предполага, че има два вида IgE, които провокират различни реакции, когато са свързани с Fcε рецептори на мастоцитите [25]. Единият е IgE, който има висок афинитет и може да инициира дегранулация и анафилаксия на мастоцитите, когато е свързан с неговия антиген, докато друг е IgE с нисък афинитет, който е функционално по-малко активен. Изследването на това как IgE участва в патогенезата на MetS и как биологичните дейности на IgE се различават в отсъствието или наличието на хелминтни инфекции, може да генерира нови прозрения за възможната MetS патогенеза и лечения.
Появяващата се зона на хелминтни инфекции и MetS
Изкушаващо е да се предположи, че възможният защитен ефект срещу MetS на живот в райони, където хелминти са силно ендемични, се основава на наличието на силни противовъзпалителни и модифицирани реакции (Фигура 1). За да се провери тази хипотеза, са необходими достатъчно мощни надлъжни изследвания под формата на рандомизирано, двойно-сляпо, антихелминтно-плацебо-контролирано проучване, което може да разкрие дали обезпаразитяването води до MetS. Друг метод би бил заразяването на пациенти с MetS с хелминти, за да се прецени дали лечението може да подобри MetS. Само тогава ще бъде възможно да се преодолее разликата между откритията в животински модели и ситуацията при хората. След това може да е интересно да се тества кои хелминти или кой от техните продукти могат да бъдат използвани за модифициране на възпалителни реакции като лечение на T2D или CVD, както се прави в момента в областта на алергията, автоимунитета и възпалителните заболявания на червата [10].
Благодарности
Благодарим на Леони Хусаартс за помощта с масата и Бруно Гуигас за помощта с фигурата и за критичното четене на ръкописа. Авторите се извиняват на колеги, чиито статии не могат да бъдат цитирани поради ограничение на пространството.
- Ефекти на FTO генотипа върху отслабването и метаболитните рискови фактори в отговор на калориите
- Инфекцията с цитомегаловирус може да допринесе за метаболитен синдром
- Мастните клетки могат да усещат слънчева светлина - липсата на достатъчно увеличава риска от метаболитен синдром EurekAlert!
- Ефект на отслабването върху кинетиката на LDL и HDL в диабетната грижа за метаболитен синдром
- Ефект на загуба на тегло върху маркери на богатия на триглицериди метаболизъм на липопротеините в метаболизма