Резюме
Съобщава се за хиперинсулинизъм и синдром на хиперамонемия като причина за умерено тежък хиперинсулинизъм с дифузно засягане на панкреаса. Разстройството се причинява от усилване на функционални мутации в гена GLUD1, което води до намален инхибиторен ефект на гуанозин трифосфат върху ензима глутамат дехидрогеназа (GDH). Изследвани са дванадесет несвързани пациенти (шест мъже, шест жени) с хиперинсулинизъм и синдром на хиперамонемия. Фенотипите са клинично хетерогенни, с неонатална и начална хипогликемия с променлива реакция към медицинско (диазоксид) и диетично (левцин-ограничена диета) лечение. Хиперамонемия (90–200 μmol/L, нормално
Хиперинсулинизмът е честа причина за повтаряща се хипогликемия в ранна детска възраст. Причинява се от постоянно увеличаване на секрецията на инсулин (1, 2). Инсулиновата секреция зависи от съотношението ATP/ADP в В клетките, което причинява тяхната деполяризация, засилва притока на Са 2+ и екзоцитозата на инсулина. Глюкозата и левцинът регулират секрецията на инсулин чрез регулиране на глутаминолизата чрез глюкоза (3) и чрез директното действие на глюкозата и левцина върху GDH. GDH е митохондриален ензим, който окислява глутамат до α-кетоглутарат, използвайки NAD и/или NADP като кофактор (4-8).
Наскоро беше съобщено, че нов синдром, свързващ хиперинсулинизма с хиперамонемия, HHS, е причина за дифузен и умерен хиперинсулинизъм (9-11). Това води до прекомерна активност на GDH (EC 1.4.1.3) в резултат на промяна в неговата регулация чрез намалена чувствителност към инхибиране от GTP. Предполага се, че повишеното окисление на глутамат до α-кетоглутарат стимулира секрецията на инсулин от В-клетката на панкреаса чрез увеличаване на съотношението ATP/ADP, въпреки че това все още не е експериментално тествано. Прекомерното окисление на глутамат може да намали н-ацетилглутамат в черния дроб, съществен етап в активирането на карбамил фосфат синтаза I. Този ензим катализира първия етап в детоксикацията на амоняка в урейния цикъл. Генът GLUD1 е картографиран на 10q23.3 (12) и съдържа 13 екзона, кодиращи 505-аминокиселинен зрял ензим. Мутации, причиняващи HHS, са идентифицирани в екзони 11 и 12 на гена GLUD1 (аминокиселинни позиции 445–454) (10, 13). Съвсем наскоро бяха открити и други мутации в екзони 6 и 10 (14, 15). Всички изследвани пациенти са хетерогенни за една от тези мутации, със спорадична форма на заболяването или фамилно заболяване според доминиращото наследство.
Този доклад описва 12 несвързани пациенти с HHS, причинени от анормална GDH, и дава пълни подробности за клиничните и биохимични характеристики на хипогликемията и хиперамонемията. Нашите резултати ясно показват, че хиперинсулинемичната хипогликемия е клинично хетерогенна, с неонатална и начална хипогликемия и променлива реакция на медицински и диетични лечения, потвърдена от променлива реакция на култивираните лимфоцити към левцин. Пероралният карбамилглутамат не нормализира NH3 на венозната кръв. Мутациите са локализирани както в рамките на GTP-свързващото място, така и извън него, без никаква връзка между фенотипа и генотипа.
ПАЦИЕНТИ И МЕТОДИ
През последните 20 години в нашата институция бяха изследвани серия от 175 пациенти с хиперинсулинемия. От 1997 г. насам са измерени плазмени концентрации на амоний при 71 от тези пациенти, 45 новородени и 26 кърмачета, а при 12 пациенти е открита хиперамонемия (> 50 μM).
Описани са диагностичните критерии за хиперинсулинизъм и лечението на пациентите с хиперинсулинизъм (16). Пациентите с хиперамонемия са изследвани допълнително. Венозните плазмени нива на глюкоза и амоний на всички пациенти се определят преди и след всяко хранене. Измерванията са направени, когато са били на нормална протеинова диета за период от 72 часа, след перорално натоварване с протеини (2 g/kg) и левцин (150 mg/kg) за период от 48 часа при четирима пациенти и след диета с ограничен протеин и левцин (2 g протеин и 200 mg левцин на хранене) за период от 72 часа при девет пациенти (Таблица 1).
Нивото на артериалния амоний се измерва едновременно с венозната концентрация при девет пациенти.
Четирима пациенти са подложени на селективна катетеризация на панкреаса (пациенти 1, 2, 4 и 6), под обща анестезия, преди да разберем за съществуването и причината за хиперамонемия. Кръвни проби бяха събрани от порталната и чернодробната вени на пациент 1 по време на катетеризация на панкреаса, за да се сравнят пре- и постхепаталната амонемия (17). Този пациент е анестезиран с кураре, за да отпусне скелетните мускули, с убеждението, че хиперамонемията може да е от мускулен произход. Уреята в урината, плазмените аминокиселини и органичните киселини в урината бяха измерени чрез масова спектрометрия с газова хроматография.
Пациентите получават орален карбамилглутамат и натриев бензоат по 0,5 g/kg, разделени на три дози в продължение на 3 дни. Венозната кръвна глюкоза и амоний се измерват преди всеки прием на тези лекарства.
Чернодробна орнитин транскарбамилаза, н-ацетилглутамат синтетаза и активността на глутамин синтаза бяха измерени при пациенти 1 и 5.
Активността на GDH в лимфобластните хомогенати и ефектът от добавените ADP или GTP се определят спектрофотометрично съгласно протокола на Stanley и др.(10). CDNA GLUD1 е обърната, транскрибирана от лимфобластна иРНК и усилена от PCR според Stanley и др.(10). GLUD1 cDNA беше секвенирана за търсене на мутации. Резултатите са средната стойност ± SEM от три до пет определяния. Статистическите сравнения бяха извършени с помощта на непараметричен тест на Ман-Уитни. A стр стойност
РЕЗУЛТАТИ
Хиперинсулинемична хипогликемия.
Клиничните характеристики на пациентите с HHS са обобщени в таблица 1. Всички пациенти (шест мъже и шест жени) с изключение на един (пациент 11) са имали несвързани родители. Лелята по майчина линия на пациент 1 е страдала от хиперинсулинизъм по време на ранна детска възраст. Майката на пациент 6 е страдала от чувствителна към левцин хипогликемия, диагностицирана на възраст 11 месеца. Тя е била лекувана с нископротеинова диета до 9-годишна възраст, когато се е смятало, че се е възстановила спонтанно. В момента нейното интелектуално развитие е нормално. Останалите пациенти нямат фамилна анамнеза за хипогликемия. Бащата на пациент 2 почина от карцином на панкреаса на възраст 43 години, без предишна хипогликемия.
Всички пациенти са родени в пълен срок и само четирима пациенти са макрозомични при раждането (Таблица 1). Хипогликемията започва през първите 3 дни от живота в четири случая, а по-късно в ранна детска възраст в останалите случаи. Припадъкът е присъщият симптом на хипогликемия при повечето пациенти. Десет пациенти се нуждаят от непрекъснато орално или i.v. глюкоза, за да поддържат плазмената си глюкоза> 3 mmol/L. Въпреки това, средната скорост на приложение на глюкоза е била само 11,7 mg/kg/min и нито един пациент не се нуждае i.v. глюкагон в допълнение към глюкозата. Девет пациенти са напълно чувствителни към диазоксид, един е устойчив на диазоксид (пациент 6), а други двама изискват царевично нишесте в допълнение към диазоксид (пациенти 1 и 8). Диета с ограничен левцин (200 mg/хранене) адекватно контролирана хипогликемия в пет случая (пациенти 1, 4, 5, 6, 10), поддържаща плазмената глюкоза> 3 mmol/L, докато пациентите са били хранени на нормални интервали и не са получавали iv глюкоза или други лекарства в продължение на поне пет последователни дни. Той беше неефективен в четири случая (пациенти 3, 7, 8, 11). Сред пациентите, които са били чувствителни към диета с ограничен левцин, четирима са получили орално левциново натоварване и са страдали от хипогликемия с хиперинсулинемия 1 час след натоварването. При последните пациенти не се дава орално левциново натоварване поради потенциалния риск от тежка хипогликемия.
Като цяло всички пациенти с изключение на един (пациент 6) са били лекувани успешно медицински, като са използвали диазоксид, диета с ограничен левцин и/или царевично нишесте. Пациент 6, който е диагностициран преди описанието на HHS, е претърпял резекция на панкреаса, включваща опашката и половината тяло на панкреаса. Предоперативната венозна катетеризация на панкреаса е показала високи нива на инсулин в целия панкреас. Неговото хистопатологично проучване потвърждава, че хиперинсулинизмът е дифузен, но лезията е необичайна с хипертрофични островни клетки, подредени в лентови шарки. Пациентът все още е имал хипогликемия след операция, но е бил успешно лекуван с диета с ограничен левцин. Останалите трима пациенти (пациенти 1, 2 и 10), подложени на катетеризация на панкреаса, също са показали дифузна секреция на инсулин в целия панкреас и те не са били оперирани.
Хиперамонемия и метаболитни изследвания.
Хиперамонемията е открита преди хипогликемия при пациенти 1 и 5, докато е открита ретроспективно при останалите пациенти, които преди това са били диагностицирани с хиперинсулинизъм. Характеристиките на хиперамонемията са обобщени в таблица 2.
Концентрацията на венозен плазмен амоняк е леко повишена при всички пациенти (90–200 μmol/L, нормално 50 μmol/L) при всички изследвани пациенти, с изключение на пациент 1 (артериален амоняк 36–40 μmol/L, периферна венозна амонемия 150 μmol/L). Този пациент е имал повишени концентрации на амоняк в порталната вена (111–132 μmol/L), но нормални стойности в подхепаталните вени (38–41 μmol/L) по време на катетеризация на панкреаса (17).
Концентрациите на плазмен глутамин и урина в алфа кетоглутарат варират (Таблица 2), докато плазмените концентрации на аргинин, урея в урината и оротична киселина са нормални при всички изследвани пациенти. Чернодробна орнитин транскарбамилаза и н-ацетилглутамат синтазата (пациенти 1 и 5) и глутамин синтазата (пациент 1) бяха нормални.
Глутамат дехидрогеназа.
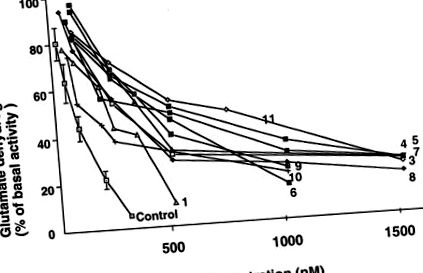
Активността и алостеричните отговори на GDH в лимфобласти от 10 от 12 пациенти са показани в Таблица 2. Всички изследвани пациенти са имали нормални базови GDH дейности. IC50 на GTP е 70–600% по-висок от този на контролите, в съответствие с прекомерна активност на GDH (фиг. 1). Алостеричният ефект на активирането от ADP е нормален. Ефектът на 1 mM левцин върху активността на GDH варира при пациентите (фиг. 2). Налице е значително намаляване на GDH чувствителността към активиране от левцин при пациенти 4, 7, 8 и 10.
Ефекти на GTP върху активността на GDH в лимфобласти от пациенти с HHS и нормални субекти. Базални GDH дейности за пациенти (н = 10) и контроли (н = 9), изразени като nmol/min/mg протеин, са посочени в таблица 2. ID50 са определени графично и са показани в таблица 2.
Молекулярният анализ на гена GDH показа, че четирима пациенти са хетерозиготни за мисенс мутация в рамките на екзон 11 (пациенти 1, 8, 9, 11) и двама в екзон 12 в антенната област на ензима (пациенти 3, 12) (Таблица 2 ). Четирима други пациенти (пациенти 1, 5–7) са имали хетерозиготна мутация в екзони 6 и 7 в GTP-свързващото място (18). Досега не е открита мутация за пациент 10, след секвениране на екзоните 5-13 на гена. Повечето изследвани пациенти са имали един мутант и един алел от див тип, съобразен с доминиращата експресия на мутациите. Проби от родители на пациенти не са били достъпни за анализ на мутацията.
ДИСКУСИЯ
Тук докладваме характеристиките на 12 пациенти с HHS. Десет от тези пациенти, които са били подложени на ензимни и молекулярни изследвания, са имали абнормна активност на глутамат дехидрогеназа, подкрепяйки концепцията, че промяната в GDH е причината за HHS. Според Стенли и др.(1) и в противоречие с Йорифуджи и др.(14), чувствителността на GDH ензима към инхибиране от GTP е намалена, въпреки че основната му активност е нормална, което е в съответствие с неговата свръхактивност in vivo. Хетерозиготни мутации в гена GLUD1 са открити при всички пациенти с изключение на един. Тези мутации са локализирани в антенната област на ензима при шест пациенти и в GTP-свързващото място при четирима пациенти. Мутациите в GTP-свързващия сайт, кодирани от екзони 6 и 7, също са описани от Miki и др.(15) и Сантер и др.(19). Не е установена корелация на фенотип-генотип според местоположението на мутациите (15). Мутациите както в GTP-свързващия, така и в антенния регион са свързани с новороденото и началото на хипогликемията при новородени, както и с променлива реакция на диазоксид. По същия начин е установена сравнима свръхактивност на GDH при субекти с двете места на мутации.
Въпреки че левцинът директно регулира секрецията на инсулин, като въздейства върху отделно левцин-свързващо алостерично място върху GDH (8), изненадващо, ефектът от 1 mM левцин върху лимфобластната активност на GDH варира сред пациентите (фиг. 2). Лимфобластната GDH активност при пациенти 4, 7, 8 и 10 намалява в отговор на левцин. Мутациите на гена GLUD1 на тези пациенти са разположени на екзони 11 и 12, както и екзони 6 и 7. Тези открития не подкрепят концепцията, че диетата с ограничен левцин е постоянно ефективна върху плазмените нива на глюкоза в HHS (9, 20, 21).
Докато хипогликемията е резултат от увеличеното съотношение В-клетъчни ATP/ADP чрез намаляване на чувствителността към алостерично инхибиране на GDH към GTP, механизмът на хиперамонемия все още не е ясен. Всички изследвани пациенти са имали нормална екскреция на урея в урината и ензимна активност на урейния цикъл. По същия начин венозният амоняк не зависи от приема на протеини с храната и не намалява в отговор на натриевия бензоат, което предполага, че амонякът се детоксикира от черния дроб. По-интересно, н-карбамилглутамат, аналог на н-ацетилглутаматът, естественият алостеричен активатор на урейния цикъл, не нормализира венозния амоняк при нито един пациент, което се противопоставя на хипотезата, че хиперамонемията се причинява от намалена н-синтез на ацетилглутамат от черния дроб. И накрая, при пациент 1, който има GLUD1 мутация в екзон 7, нивата на амоняк в периферната венозна кръв се нормализират по време на кураризацията и артериалният му амоняк е нормален. Това предполага, че мускулната релаксация намалява концентрацията на циркулиращ амоняк и че хиперамонемията може да има периферен мускулен произход (17).
В заключение серумната концентрация на амоняк трябва да се измери при всеки пациент, изследван за хиперинсулинизъм, тъй като лечението, проследяването и генетичното консултиране се различават коренно. И обратно, хипогликемия трябва да се търси при пациенти с хиперамонемия с несигурна етиология. Въпросът дали умереният хиперинсулинизъм без хиперамонемия може да бъде резултат от аномалия на GDH, както наскоро беше описано от Santer и др.(19), остава да се изясни, особено при пациенти, които имат левцин-чувствителен хиперинсулинизъм. И накрая, ако последиците от GDH мутация върху метаболизма на глюкозата са ясно свързани с неподходяща секреция на инсулин, последиците от GDH мутация върху метаболизма на амонемия все още не са ясни.
Съкращения
хиперинсулинизъм и синдром на хиперамонемия
- JFMK Безплатен пълен текст Ефектите от упражненията и лентата Kinesio върху физическите ограничения при пациентите
- IJMS Безплатно пълнотекстово чревно-медиирано възпаление и чревна пропускливост при пациенти с
- Клинични изследвания на подагра Рочестър
- Сертификат за дипломиран специалист по детско хранене - Колеж по обществено здраве на Робърт Стемпъл; Социална работа
- Списание за затлъстяване и диабет (ISSN 2638-812X) Билиарна дискинезия Изследователски статии жлъчен мехур