Резюме
Хроничното бъбречно заболяване (ХБН) е състояние на ускорено сърдечно-съдово заболяване, при което последното остава основната причина за смърт при тази популация пациенти [1]. Нетрадиционните рискови фактори, допринасящи за сърдечно-съдовата патология при ХБН, включват хронично възпаление, оксидативен стрес, загуба на протеинова енергия, нарушен метаболизъм на минералите и дефицит на ендогенни инхибитори на калцификацията [2–4]. По отношение на хроничното възпаление, множество диализни и недиализни фактори вероятно играят роля, включително инфекция, интравенозно приложение на желязо, интерфейс кръв-диализатор и съществуваща сърдечна недостатъчност [5,6]. Трябва да се отбележи, че въпреки техническите нововъведения през последните десетилетия като биосъвместими диализни мембрани, нетоксична стерилизация на оборудването, по-малко имуногенни железни препарати и ултрачист диализат, феноменът на системно възпаление с произтичащия от него оксидативен стрес продължава при пациенти с ХБН [7].
Натрупващите се доказателства през последните години подчертават стомашно-чревния тракт като основен източник на хронично възпаление при ХБН. Фрагменти на чревна бактериална ДНК са открити в кръвта както на пациенти с ХБП преди диализа, така и на пациенти с хронична хемодиализа [8]. Използвайки 16s рибозомно усилване на ДНК и пиросеквенция, Shi et al. открити бактерии (по-голямата част от чревния произход) в плазмата на 12 от 52 пациенти с хронична диализа [9]. Наличие на бактерии, корелирани с повишен плазмен С-реактивен протеин, интерлевкин-6 и D-лактат, при което последният служи като маркер на пропускливостта на червата [9]. Ендотоксинът, получен от клетъчната стена на Грам-отрицателни бактерии, е измерим в кръвта на пациенти на диализа и корелира със тежестта на системното възпаление при липса на клинично откриваема инфекция [10]. Всъщност нивата на циркулиращия ендотоксин се увеличават с тежестта на стадия на ХБН и са най-високи при пациенти с хронична хемодиализа и перитонеална диализа [11,12].
Възникване на микробиота при ХБН и производство на уремични токсини
Симбиотичната връзка с чревната микробиота е от съществено значение за регулиране на локалния и системен имунитет [13,14], при което микробиотата е модификатор „отвън“, който определя подгрупите на Т-клетките и естествените клетки-убийци [15–17]. В здравите черва анаеробните Bacteroidetes и Firmicutes допринасят> 90% от бактериалните видове [18]. В съответствие с намаляващото напрежение на кислорода бактериалните концентрации се увеличават от стомаха (10 2–10 4 клетки/ml) до дебелото черво (> 10 12 клетки/ml) [13]. Бактериалните клетки, които изграждат чревната микробиота, също са част от важна хранителна среда, като осигуряват богати на енергия метаболити и витамини на ентероцитите [13]. Растителните полизахариди или устойчиви нишестета преминават непокътнати в дебелото черво, където се разграждат от Bacteroides и ферментират, за да освободят водород, въглероден диоксид, алкохол и късоверижни мастни киселини (ацетат, бутират, пропионат и D-лактат) [13]. Клетките на дебелото черво и бактериите се конкурират за богати на енергия мастни киселини с къса верига и съществуват регулаторни механизми, за да се гарантира, че не настъпва свръхрастеж, което ще лиши чревните клетки от този хранителен източник [13].
В присъствието на тази нарушена бактериална колонизация се увеличава производството на уремични токсини, получени от червата, като индоксил сулфат и р-крезил сулфат [25]. Тези токсини индуцират провъзпалителни отговори и насърчават стимулирането на левкоцитите [26,27] и са свързани с повишени нива на възпалителни маркери при пациенти с ХБН в стадий 3-4, като интерлевкин-6 и глутатион пероксидаза [28,29]. През 90-те години групата на Niwa демонстрира, че индоксил сулфатът стимулира инфилтрацията на моноцити в остатъчния бъбрек на 5/6-нефректомирани плъхове, като по този начин стимулира производството на трансформиращ растежен фактор-бета 1 и прогресията на бъбречната недостатъчност [30]. Р-крезил сулфатът също корелира с увеличената скорост на пулсовата вълна, показателна за втвърдяване на съдовете [28]. Наскоро групата на Hazen демонстрира, че плазмените нива на триметиламин-N-оксид (TMAO), получени от микроорганизми в червата, корелират с повишен 5-годишен риск от смъртност при пациенти с ХБН след многовариантна корекция [31]. Диетичните добавки на TMAO при животински модели водят до повишена тубулоинтерстициална фиброза и прогресираща бъбречна дисфункция [31].
Разграждане на чревната епителна бариера и транслокация на бактериални токсини
Удивително е, че 10 12 бактериални клетки/ml в лумена на дебелото черво се отделят от тялото на гостоприемника само с еднослоен абсорбиращ епител. В здраво състояние има лигавична бариера, състояща се от слузен слой, дефензини и лектини, които предпазват епитела и имунната система от директен контакт с микробиотата [15,32].
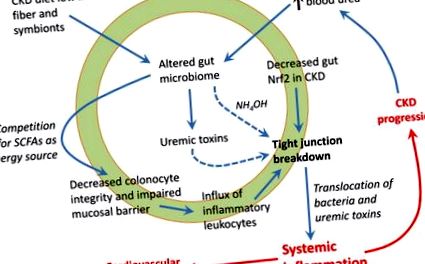
Към днешна дата са изяснени два механизма, чрез които се получава пробив на плътно кръстовище (Фигура 1). Уреята се дифузира от кръвта в лумена на червата и се метаболизира от чревната бактериална уреаза до амоняк, който се хидролизира в разяждащ амониев хидроксид, който разяжда епителната бариера [40,41]. Това стимулира притока на възпалителни левкоцити, което задейства втория механизъм, при който локалното производство на цитокини индуцира ретракция и ендоцитоза на трансцелуларните протеини с плътно свързване (клаудини и оклудин) [42,43]. Лесно е да се види как тези пътища могат да се превърнат в порочна верига, която насърчава хроничното системно възпаление.
Неотдавнашната ни работа показа, че противовъзпалителният транскрипционен фактор Nrf2 (фактор 2, свързан с ядрен фактор еритроид 2) се потиска в червата на плъхове с ХБН и лечението с агонист на Nrf2 не само намалява възпалението на червата, но и подобрява експресията на протеини с плътно свързване [44]. Необходими са повече изследвания, за да се определи клиничното значение на чревния Nrf2 път като нова терапевтична цел.
Терапевтични възможности: пред- и пробиотици и противовъзпалителни интервенции
Добре известно е, че диетата с ХБН с ниско съдържание на калий и фосфор влияе върху чревния микробен състав и по-специално ограничението на калия противоречи на диетата с високо съдържание на зеленчуци/плодове, която е здрава за сърцето, свързана с по-малко сърдечно-съдови събития в общата популация . Има обаче ясни данни, че по-високите серумни нива на калий и фосфор в популацията с ХБН и диализа корелират силно с повишен риск от смъртност [45]. Теоретично разумният прием на растителни фибри и богато на симбионт кисело мляко/сирена (може би при едновременна употреба на калий-свързващи смоли и фосфатни свързващи вещества) може да доведе до по-балансиран чревен микробиом и по този начин да подобри възпалителните параметри, но са необходими рандомизирани контролирани проучвания преди новата диета могат да бъдат предложени насоки.
Осъзнаването, че чревното възпаление и микробиомните нарушения са основен фактор за хроничното възпаление и неблагоприятните резултати от ХБН, стимулира насочените към червата терапевтични изследвания. Показано е, че адсорбентът за активен въглен през устата частично възстановява експресията на протеини с плътно свързване на дебелото черво и води до понижаване на плазмените ендотоксини и възпалителни маркери при плъхове с ХБН, вероятно чрез адсорбираща урея и други луминални токсини [46]. Въпреки това, рандомизираните контролирани проучвания в Япония и САЩ не успяха да покажат благоприятни ефекти при пациенти с ХБН по отношение на забавяне на прогресията на ХБН [47,48]. Неотдавнашният ни доклад, подчертаващ дефицита на Nrf2 в червата от гризачи с ХБН, демонстрира, че лечението с активатор Nrf2 може да подобри експресията на протеини с плътно дебело черво, да намали възпалението на дебелото черво и да намали нивата на урея и креатинин в кръвта [44]. Потенциалната полза от модулирането на активността на Nrf2 на червата при пациенти с ХБН остава да бъде проучена.
Планирането на клинични проучвания около чревния микробиом и интерпретирането на резултатите със сигурност не е лесно. Факторите, които могат да допринесат за вариабилност в отговор на терапията при отделни индивиди, включват различна плътност на чревната флора, генетични различия, засягащи взаимодействията между гостоприемника и микробите и различен микробен състав. Всъщност през 2011 г. беше съобщено от анализ на фекални метагеноми от четири страни, че има три забележими ентеротипа на човешкия микробиом [57]. Понастоящем също не е ясна степента на промяна в измерените серумни възпалителни маркери, които биха се превърнали в значими клинични резултати.
Обобщение
Благодарности
Работата се подпомага от грантове на NIH-NIDDK K24-> DK091419 (KKZ) и благотворителни субсидии от г-н Харолд Симънс и г-н Луис Чанг.
- Когато детето ви има хронична бъбречна болест - DaVita
- Разбиране на хроничната бъбречна болест (ХБН) - DaVita
- Компанията във Ванкувър възстановява допинг лекарството на Съветския съюз за лечение на бъбречно заболяване Georgia Straight
- Какво да ядем, когато имате бъбречно заболяване 1 или 2 етап - DaVita
- Загуба на тегло при пациент с поликистозна бъбречна болест, когато чернодробните кисти вече не са невинни